Method Article
Électrofusion cellulaire visualisé par microscopie à fluorescence
Dans cet article
Résumé
Dans cette vidéo, nous démontrons électrofusion efficace des cellules In vitro Par le biais de la méthode de l'adhésion modifié en utilisant l'électroporation et la détection ultérieure de la visualisation des cellules fusionnées avec la microscopie à fluorescence.
Résumé
Électrofusion cellulaire est une méthode sûre et non-viraux et non-chimiques qui peuvent être utilisés pour la préparation de cellules hybrides pour la thérapie humaine. Électrofusion implique l'application de courtes impulsions à haute tension électrique aux cellules qui sont en contact étroit. Application de courtes impulsions électriques de haute tension provoque la déstabilisation de la membrane plasmique des cellules. Déstabilisé membranes sont plus perméables aux molécules différentes et également sujettes à la fusion avec toute membranes voisins déstabilisés. Électrofusion est donc une méthode pratique pour réaliser une fusion non-spécifique de cellules très différentes
Protocole
I. Chargement des cellules avec les cellules et les trackers CMFDA SACSM
- Des expériences ont été réalisées sur des cellules préalablement préparé de la lignée cellulaire de souris mélanome (B16-F1). Les cellules sont cultivées dans deux flacons séparés 25 cm de la culture 2 (PPT, ZDA) à 70-80% de confluence dans un milieu de culture DMEM (milieu de Dulbecco modifié Eagle) complété avec 10% de sérum de veau fœtal, 0,15 mg / ml de L-glutamine, 16 mg / ml de gentamicine (tous de Sigma-Aldrich, Allemagne), 200 unités / ml crystacillin (Pliva, Croatie), et incubés dans 5% de CO 2 à 37 ° C.
- Préparer deux solutions mères 10 mM de trackers cellulaire (Invitrogen, USA) en ajoutant 10,76 ul ul et 9 (pour le vert et le CMFDA pour Orange SACSM, respectivement) de DMSO (Sigma-Aldrich, Allemagne) à 50 pg du colorant dans l'original flacon Invitrogen. La solution stock peut être stockée dans un réfrigérateur à 4 ° C pendant quelques mois. Avant de commencer les expériences, de réchauffer la solution jusqu'à ce que les cristaux se dissolvent de DMSO.
- Préparer le bicarbonate sans tampon Krebs-HEPES (130 mM NaCl, 4,7 mM de KCl, 1,2 mM MgSO 4, 1,2 mM KH 2 PO 4, 11,7 mM D-glucose, 1,3 mM de CaCl2, 10 mM d'HEPES, pH 7,4). Dans deux tubes de 15 ml Eppendorf séparément mélange de 2,1 l de chaque solution mère (10 mM CMFDA ou CMRA, respectivement) dans 3 ml de bicarbonate sans tampon Krebs-HEPES. Cela donne une «solution de chargement" contenant environ 7 uM (ou SACSM) CMFDA.
- Rincer les cellules deux fois avec du bicarbonate sans tampon Krebs-HEPES, puis insérez le chargement des solutions dans les flacons. Incuber les cellules pendant 30 minutes dans 5% de CO 2 à 37 ° C. Durant cette première incubation réactifs passer librement à travers les membranes cellulaires, mais une fois dans la cellule, les réactifs sont transformés en cellules imperméants produits de la réaction fluorescente.
- Après une incubation d'abord, rincez et incuber les cellules avec un milieu de culture pendant deux heures dans 5% de CO 2 à 37 ° C.
- Trypsiniser cellules dans les deux flacons (chargé avec CMFDA et SACSM) et mélanger les globules rouges et verts ainsi que dans un rapport 1:1 dans un tube à centrifuger de 50 ml (PPT, ZDA). Ajuster la concentration de cellules de 5 x 10 6 cellules / ml par dilution avec du milieu DMEM ou par concentration avec la centrifugeuse. Déposer une goutte 20 pl de suspension cellulaire dans chaque puits de la plaque 24 multipuits (PPT, ZDA). Incuber les cellules dans 5% de CO 2 à 37 ° C pendant 20 min pour leur permettre de peu s'attachent à la surface du puits et établir des contacts cellulaires.
II. Électrofusion
- Préparer isoosomolar tampon phosphate de potassium (10 mM KH2PO4, 10 mM K 2 HPO 4, 1 mM MgCl2, 250 mM de saccharose) et hypoosmolaire tampon phosphate de potassium (10 mM KH2PO4, 10 mM K 2 HPO 4, 1 mM de MgCl2, 75 mM de saccharose) .
- Placez le multipuits avec des cellules sur la platine du microscope, la position des électrodes au fond du puits et les connecter au générateur d'impulsions.
- Laver les cellules avec 1 ml de tampon phosphate de potassium isoosomolar. Ajouter 350 ul de tampon phosphate de potassium hypoosmolaire afin d'induire un gonflement cellulaire. Le tampon devrait couvrir les électrodes.
- Laisser les cellules dans un tampon de hypoosmolaire pendant 2 minutes avant d'appliquer des impulsions électriques. Durant cet afflux de temps des molécules d'eau dans les cellules en raison d'un déséquilibre osmotique entre l'intérieur et l'extérieur des cellules provoque une augmentation du volume cellulaire. Impulsions électriques doivent être appliqués lorsque les cellules sont proches de leurs volumes maximum, avant le début diminuer le volume de la réglementation.
- Pour atteindre et maintenir électrofusion optimale la viabilité des cellules, les paramètres optimaux d'impulsions électriques doivent être utilisés. Celles-ci dépendent lignée cellulaire utilisée [1]. Dans cette expérience, un train de 8 impulsions rectangulaires (chacune avec une durée de 100 ms à 1 Hz) est appliquée à chaque échantillon, en utilisant un dispositif d'électroporation (dans notre cas, Cliniporator, IGEA, Italie). Les impulsions sont délivrées à deux électrodes parallèles de fil de Pt / Ir de 0,8 mm de diamètre et 5 mm de distance entre eux, créant un champ électrique d'environ 1200 V / cm entre les électrodes dans chaque puits, sauf pour le contrôle du puits.
- Laisser les cellules au repos pendant 10 minutes après la livraison du pouls. Déterminer le rendement de fusion par le biais de la microscopie fluorescente et de contraste de phase.
III. L'acquisition d'images et de la détermination du rendement de la fusion
- Les cellules sont observées en utilisant un microscope à fluorescence (dans notre cas Zeiss Axiovert 200, Zeiss, Allemagne) équipé d'un objectif (x20) et une caméra CCD refroidie (VisiCam 1280, Visitron, Allemagne). Les images sont acquises en MetaMorph 7.1.1 (Molecular Devices, USA), mais d'autres logiciels d'acquisition similaire peut également être utilisé. CMFDA est excité par un monochromateur (Polychrome IV, Visitron, Allemagne) à 492 nm et 548 nm au SACSM. La fluorescence de CMFDA et SACSM est acquise au moyen de deux filtres d'émission, l'un centré à 535 nm (HQ535/30m, pour CMFDA) et l'autre centrée à 510 nm (D605/55m, pour CARM, tant Chroma, USA). L'utilisation de miroir dichroïque (Q515LP) a empêché la diaphonie de canal.
- L'acquisition de trois images (contraste de phase, la fluorescence rouge et verte) pour cinq champs choisis au hasard dans chaque puits. Créer trois images de canal de chaque triplet d'images. Dans l'image telle cytoplasme fluorescent peut être vu avec les membranes cellulaires. Les cellules fusionnées peuvent ainsi être facilement déterminée [Figure 1].
- Compter toutes les trois types de cellules (rouge, vert et doublement fluorescents) dans chaque image à trois canaux. Déterminer le pourcentage de cellules fluorescentes doublement en divisant le nombre de cellules fluorescentes doublement du nombre de toutes les cellules de chaque image. Fusion de rendement est défini comme le pourcentage de cellules fluorescentes doublement multiplié par 2 puisque la moitié des cellules fusionnées ne sont pas détectés (lorsque les cellules du fusible de même couleur).
Les résultats représentatifs
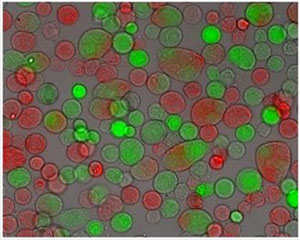
Figure 1 Trois images de microscopie canal de cellules B16F1 après électrofusion:. Contraste de phase, SACSM de fluorescence (excitation à 548 nm) et CMFDA fluorescence (excitation à 492 nm), grossissement de l'objectif 20x
Discussion
La capacité des membranes cellulaires de fusionner de manière non spécifique, par exemple, par des champs électriques extérieurs, est important pour les biotechnologies, la médecine et la recherche en biologie. Ces non-spécifique de fusion permet de produire des cellules hybrides très précieux et leurs produits, tels que les anticorps monoclonaux, et fournit des informations sur les mécanismes fondamentaux de la fusion [2]. Électrofusion est une méthode potentiellement très efficace, car elle peut être correctement ajusté pour différents types de cellules. Électrofusion est atteint lorsque les cellules en contact physique étroit sont amenés dans leur état fusogène (sujettes à la fusion) au moyen d'impulsions à haute tension électrique. L'efficacité de l'électrofusion dépend de divers paramètres qui affectent les deux parties du processus d'électrofusion. Première partie du processus de électrofusion est d'obtenir la contact physique étroit entre les cellules, qui peuvent être obtenues avec différentes méthodes [3-8]. Méthode de l'adhésion (cellules en croissance jusqu'à la confluence) peuvent être utilisés efficacement en raison de contacts cellulaires spontanément établies dans les zones de grandes entre les cellules, mais il produit de très grandes cellules fusionnées avec de nombreux noyaux. Nous utilisons la méthode de l'adhésion modifiés, où des cellules plus petites (de 2 à 5 noyaux), qui sont plus susceptibles de survivre et de proliférer, sont obtenus (figure 1). Le contact entre les cellules bénéficient également d'un gonflement osmotique des cellules, due à un traitement osmotique utilisé dans l'expérience [9]. Deuxième partie du processus de électrofusion est la réalisation de l'état fusogène des membranes cellulaires. Etat fusogène corrèle bien avec l'état electropermeabilized de la membrane (cellules ne sont pas spécifiquement perméabilisées à des molécules qui normalement ne peuvent pas traverser la membrane intacte) et est régie par les mêmes paramètres des impulsions électriques (amplitude, durée, nombre et fréquence) [10] . Les valeurs des paramètres électriques nécessaires pour l'électroporation optimale [1] et électrofusion diffèrent entre les différentes cellules et dépendent de la taille des cellules et leurs propriétés biologiques. Les paramètres électriques ont donc besoin d'être optimisé pour différentes lignées cellulaires, qui sont utilisés en tant que partenaires de fusion, pour obtenir la fusion.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par l'Agence slovène pour la recherche (projet J2-9764 et le programme P2-0249). Cette vidéo présente le matériel supplémentaire pour les "électroporation basée sur les technologies et traitements" atelier scientifique et cours de troisième cycle, organisé par la Faculté de génie électrique à l'Université de Ljubljana, en Slovénie.
matériels
| Name | Company | Catalog Number | Comments | |
| CMRA | Reagent | Invitrogen | C34551 | Cytosolic fluorescent dye |
| CMFDA | Reagent | Invitrogen | C7025 | Cytosolic fluorescent dye |
| DMSO | Reagent | Sigma-Aldrich | D2650 | |
| DMEM | Reagent | Sigma-Aldrich | D5671 | Dulbecco’s modified Eagle’s medium |
| Fetal calf serum | Reagent | Sigma-Aldrich | F4135 | |
| L-glutamine | Reagent | Sigma-Aldrich | G7513 | |
| crystacillin | Reagent | Pliva | 625110 | antibiotic |
| gentamicin | Reagent | Sigma-Aldrich | G1397 | antibiotic |
| Hepes | Reagent | Sigma-Aldrich | H0887 | |
| KH2PO4 | Reagent | Merck & Co., Inc. | A124873 927 | |
| KH2PO4 | Reagent | Sigma-Aldrich | 4248 | |
| MgCl2 | Reagent | Sigma-Aldrich | M-8266 | |
| NaCl | Reagent | Fluka | 71382 | |
| KCl | Reagent | Merck & Co., Inc. | A154336 908 | |
| MgSO4 | Reagent | Sigma-Aldrich | M2643 | |
| D-glucose | Reagent | Sigma-Aldrich | G8270 | |
| CaCl2 | Reagent | Sigma-Aldrich | C4901 | |
| sucrose | Reagent | Sigma-Aldrich | 16104 | |
| Electric pulse generator | Tool | IGEA | Cliniporator VITAE | |
| Multiwell plate | Tool | Techno Plastic Products | 92424 | |
| 50 ml centrifuge tube | Tool | Techno Plastic Products | 91050 | |
| 15 ml centrifuge tube | Tool | Techno Plastic Products | 91015 | |
| 25 cm2 culture flask | Tool | Techno Plastic Products | 90026 | |
| Electrodes | Tool | Custom Made | Pt/Ir |
Références
- Čemazar, M., Jarm, T., Miklavčič, D., Maček-Lebar, A., Ihan, A., Kopitar, N. A., Serša, G. Effect of electric-field intensity on electropermeabilization and electrosensitivity of various tumor-cell lines in vitro. Electro. Magnetobiol. 17, 263-272 (1998).
- Trontelj, K., Reberšek, M., Kandušer, M., čurin šerbec, V., Miklavčič, D. Optimization of bulk cell electrofusion in vitro for production of human-mouse heterohybridoma cells. Bioelectrochemistry. 74, 124-129 (2008).
- Rols, M. -. P., Teissié, J. Modulation of electrically induced permeabilization and fusion of Chinese hamster ovary cells by osmotic pressure. Biochemistry. 29, 4561-4567 (1990).
- Neil, G., Zimmermann, U. Electrofusion. Methods in Enzymology. 220, 174-196 .
- Abidor, I. G., Li, L. -. H., Hui, S. W. Studies of cell pellets: II. Osmotic properties, electroporation, and related phenomena: Membrane interactions. Biophysical journal. 67, 427-435 (1994).
- Jaroszeski, M. J., Gilbert, R., Fallon, P. G., Heller, R. Mechanically facilitated cell-cell electrofusion. Biophys J. 67 (4), 1574-1581 (1994).
- Ramos, C., Bonefant, D., Teissié, J. Cell hybridization by electrofusion on filters. Analytical biochemistry. 302, 213-219 (2002).
- Cao, Y., Yang, J., Yin, Z. Q. Study of high-throughput cell electrofusion in a microelectrode-array chip. Microfluid Nanofluid. 5, 669-675 (2008).
- Ušaj, M., Trontelj, M., Kandušer, M., Miklavčič, D. Cell size dynamics and viability of cells exposed to hypotonic treatment and electroporation for electrofusion optimization. Radiol. Oncol. 43, 108-119 (2009).
- Teissié, J., Ramos, C. Correlation between electric field pulse induced long-lived permeabilization and fusogenicity in cell membranes. Biophys. J. 74, 1889-1898 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon