Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Photoconversion de protéines purifiées fluorescentes et double-sonde optique dans Soulignant cellules vivantes
Dans cet article
Résumé
Ce protocole décrit une approche générale pour effectuer photoconversion de protéines fluorescentes sur un microscope confocal à balayage laser. Nous décrivons les procédures de photoconversion d'échantillons de protéines puried, ainsi que pour les bi-sonde optique dans les cellules soulignant vivre avec mOrange2 et Dronpa.
Résumé
Photoconvertible protéines fluorescentes (PC-PC) sont une classe de protéines fluorescentes "surligneur optique" capacité, ce qui signifie que la couleur de la fluorescence peut être changé par l'exposition à la lumière d'une longueur d'onde spécifique. Soulignant optique non invasive permet le marquage d'une sous-population de molécules fluorescentes, et est donc idéal pour le suivi des cellules individuelles ou les organites.
Les paramètres critiques pour les photoconversion efficaces sont l'intensité et la durée d'exposition de la lumière photoconversion. Si l'intensité est trop faible, photoconversion sera lente ou ne se produira pas du tout. D'autre part, l'intensité d'exposition trop ou trop longtemps peut photobleach la protéine et ainsi réduire l'efficacité de photoconversion.
Ce protocole décrit une approche générale comment mettre en place un microscope confocal à balayage laser pour des applications photoconversion PC-PF. Premièrement, nous décrivons une procédure de préparation des échantillons purifiés de gouttelettes de protéines. Ce format de l'échantillon est très pratique pour étudier le comportement photophysiques des protéines fluorescentes sous le microscope. Deuxièmement, nous allons utiliser l'échantillon de gouttelettes de protéines de montrer comment configurer le microscope pour photoconversion. Et enfin, nous allons montrer comment réaliser soulignant optiques dans des cellules vivantes, y compris à double sonde optique avec soulignant mOrange2 et Dronpa.
Protocole
1. Préparation des échantillons fluorescents gouttelettes de protéines
Un échantillon de protéine fluorescente se compose de gouttelettes d'une émulsion 1-octanol/eau avec la protéine fluorescente résidant dans la phase aqueuse. Cette émulsion est pris en sandwich entre une lame de microscope et d'un verre carré de 22 mm de couverture pour les applications de microscopie.
- Avant de prendre des échantillons de gouttelettes de protéines fluorescentes les lames de microscope et des lunettes de couvrir les besoin d'être nettoyé et recouvert d'un agent hydrophobe.
- Nettoyer la verrerie en lavant 5 minutes avec de l'acétone et laisser sécher à l'air. (En option, après le nettoyage de la verrerie peut être traitée pendant 30 secondes dans un nettoyeur de plasma pour obtenir des résultats optimaux revêtement).
- Préparer une solution à 2% dans l'acétone et méthyltriméthoxysilane manteau de la verrerie au cours d'une incubation de 2 minutes dans cette solution. Après revêtement enlever les verres de la solution et laisser sécher à l'air. Ensuite, rincez avec de l'éthanol à 70% à partir d'un flacon pulvérisateur et laisser sécher de nouveau. (En option, à ce stade de la verrerie peut être cuit pendant 1 heure à 80 ° C à covalente lien le revêtement de la verrerie). Verrerie couché peut être stocké pendant au moins un mois.
- Les protéines fluorescentes sont purifiés comme ses protéines 6-balisé à partir de E. Coli 1. Mesurer le spectre d'absorbance de la protéine purifiée et préparer une dilution d'actions avec une densité optique d'environ 0,1 à STE tampon (150 mM NaCl, 10 mM Tris-HCl pH 8, EDTA 1 mM), contenant 0,1% d'albumine sérique bovine (BSA) . En plus de préparer 10 ml d'un mélange 1:1 de tampon 1-octanol et STE dans un tube de 15 ml conique et mélanger vigoureusement. Après un congé de mélanger jusqu'à ce que la séparation de phase est terminée. La phase supérieure est le 1-octanol. (Attention: Parce que le 1-octanol a une odeur forte, il est important d'utiliser un conteneur à déchets fermé pour tout ce qui vient en contact avec le 1-octanol).
- Pour rendre l'émulsion pipette 45 ul du 1-octanol et 5 protéines fluorescentes ul dans un tube de centrifugeuse. Appuyez sur le tube une fois avec votre doigt pour commencer la formation de l'émulsion, puis soniquer le tube pendant 30 secondes dans un bain de sonication. En attendant obtenir une lame de microscope couché et couvercle en verre prêt. Après sonication l'émulsion doit être complètement couvert. Immédiatement après sonication pipette 4 émulsion ul à partir du milieu du tube sur une lame de microscope couché et couvrir avec un couvercle en verre enduit.
- Si la procédure est effectué correctement, l'émulsion doit répandre uniformément entre la lame de microscope et le verre objet. En quelques minutes, l'échantillon doit être stable, composé de ~ 10 um d'épaisseur gouttelettes fluorescentes à diamètres variables. La plus grande gouttelettes sont près du centre de l'échantillon et le plus petit est situé plus loin vers les bords.
2. Mise en place d'une expérience photoconversion
La procédure suivante est une stratégie générale pour la mise en place d'une expérience protéine fluorescente photoconversion. Cette procédure peut être appliquée pour des protéines purifiées ainsi que pour les cellules vivantes.
- Les paramètres suivants constituent un point de départ pour mettre en place votre expérience photoconversion:
40x objectif 1.3NA immersion dans l'huile
Taille de l'image = 512 x 512 pixels
Balayage zoom = 4
Pixel temporisation = 6 msec.
Z-résolution (taille sténopé) = 3 um - Configurer deux canaux de détection de la fluorescence initiale et photoconverted, ainsi que d'un "canal photoconversion". Dans cet exemple nous allons utiliser purifiée mOrange2 protéine, qui est une orange à rouge protéines fluorescentes photoconvertible. Les espèces d'orange est détecté à l'aide d'excitation 561 nm et la fluorescence est collectée entre 570 nm et 630 nm. Les espèces photoconverted rouge est détectée à l'aide d'excitation 633 nm et la fluorescence est collectée entre 640 nm et 700 nm. Pour le «canal photoconversion" sélectionner 488 nm d'excitation et de collecter la fluorescence entre 490 nm et 540 nm. (Remarque:. Imagerie du canal photoconversion n'est pas strictement nécessaire)
- Utilisez le canal pour l'imagerie de la fluorescence initiale avec balayage continu d'ajuster la puissance du laser et de gain du détecteur de qualité d'image optimale.
- Activez le canal photoconversion et sélectionnez un laser de puissance faible. Démarrer une série d'imagerie laps de temps et d'augmenter progressivement le laser photoconversion jusqu'au significative de blanchiment de la fluorescence initiale est observée. Poursuivre l'analyse jusqu'à la fluorescence initiale est d'environ 75% blanchi.
- Désactiver le canal photoconversion et d'activer le canal de détection de la fluorescence de photoconverted. Démarrer l'imagerie avec un gain élevé et détecteur de laser de puissance faible et augmenter progressivement la puissance du laser jusqu'à la fluorescence photoconverted est détecté. Une fois que vous détecter la fluorescence photoconverted vous pouvez ajuster la puissance du laser et de gain du détecteur de qualité d'image optimale.
- Enfin, la puissance du laser utilisépour photoconversion ainsi que la durée de photoconversion besoin d'être optimisé. L'augmentation de la puissance du laser sera photoconversion accélérer le rythme de photoconversion, la puissance du laser Cependant trop de photobleach la protéine.
- Une fois la puissance optimale photoconversion laser et la durée ont été déterminés, ces paramètres peuvent être utilisés pour configurer un photoblanchiment standard ou module de FRAP et le «canal photoconversion" n'est plus nécessaire.
3. Double-sonde soulignant optique avec mOrange2 et Dronpa
En raison de l'décalée vers le rouge propriétés spectrales, mOrange2 peut être utilisé en combinaison avec la protéine verte Dronpa photoswitchable fluorescente à double sonde optique pour permettre soulignant soulignant sélective de 4 cellules individuelles (organite) des populations.
- Les cellules sont cultivées dans des plats en verre MatTek bas et transfectées 24 heures avant d'imagerie utilisant la norme Lipofectamine2000 transfection 1.
- Mettre en place le microscope pour mOrange2 photoconversion comme décrit dans la section 2.
- Configurer le microscope pour photocommutation Dronpa. Dronpa fluorescence peut être imagée en utilisant le «canal photoconversion" mOrange2 (voir étape 2.2). (Remarque: Réduire la puissance du laser utilisé pour l'imagerie Dronpa, parce que la puissance du laser trop de provoquer l'inactivation de Dronpa.) Ajouter un canal pour la photoactivation Dronpa. Nous utilisons 800 nm excitation à deux photons pour la photoactivation, mais alternativement cela peut être réalisé à l'aide d'excitation 405 nm. Déterminer la puissance du laser nécessaire pour l'imagerie, photoactivation, et photoinactivation des Dronpa fluorescence.
- Attention: photoconversion de mOrange2 et l'inactivation de Dronpa deux survenir lors d'excitation 488 nm. En raison de la puissance du laser élevées requises pour mOrange2 photoconversion ce sera aussi inactiver Dronpa fluorescence. D'autre part, l'inactivation Dronpa produit déjà à la puissance du laser beaucoup plus faible et peut être réalisée sans photoconversion mOrange2 significative.
- Une fois les paramètres de photoconversion mOrange2 et photocommutation Dronpa sont fixés, en soulignant la sonde optique double est réalisé par les étapes suivantes. Tout d'abord, inactiver Dronpa fluorescence dans l'ensemble du champ de vue avec l'excitation de puissance nm bas 488. Deuxièmement, sélectionnez une région d'intérêt et mOrange2 photoconvert avec excitation de puissance nm haute 488. Enfin, sélectionnez une région d'intérêt pour activer Dronpa fluorescence.
4. Les résultats représentatifs
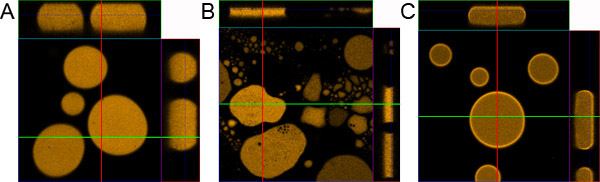
Figure 1. Préparation de l'échantillon des gouttelettes. Un échantillon) gouttelettes correctement préparé. B) L'échantillon préparé sans revêtement de la lame de microscope et couvercle en verre. C) échantillon préparé sans ajouter 0,1% de BSA.
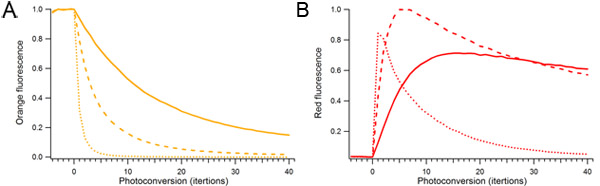
Figure 2. Effet de la puissance du laser et la durée des photoconversion mOrange2 photoconversion. Gouttelettes contenant Simple mOrange2 protéines étaient continuellement photoconverted utilisant différentes quantités de puissance du laser 488 nm. Puissance du laser utilisé pour photoconversion relative était de 10% (solide), 25% (en pointillés), et 100% (en pointillés). A) les espèces orange fluorescent. B) Photoconverted rouge des espèces fluorescentes.
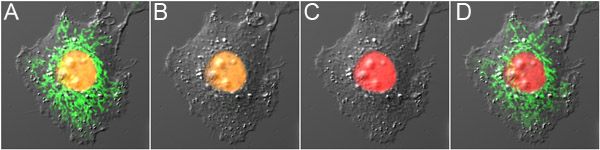
Figure 3. Double-sonde soulignant optique avec mOrange2 et Dronpa. Une cellule) exprimant mOrange2-histone H2B et Dronpa-Mito avant photoconversion, montrant la fluorescence orange dans le noyau et la fluorescence verte dans les mitochondries. B) Dronpa fluorescence était éteint avec l'excitation de puissance nm bas 488, provoquant photoconversion minimale de mOrange2. C) a été mOrange2 photoconverted au rouge avec une excitation de puissance nm haute 488. D) Dronpa de fluorescence a été allumé à nouveau en utilisant 800 nm à 2 photons d'excitation. Les panneaux sont des superpositions d'images de fluorescence de la collaboration avec l'image de contraste interférentiel différentiel.
Discussion
Le purifiée échantillon fluorescent gouttelettes de protéines est un exemple de format très pratique pour la caractérisation des protéines fluorescentes photophysiques, par exemple pour étudier la cinétique de photoblanchiment et cinétique photoconversion. Le volume de gouttelettes extrêmement petite (~ 20 picolitres) facilite photoblanchiment et des expériences photoconversion, qui peuvent être difficiles à réaliser dans les systèmes de base cuvette. En outre, comme indiqué ici de l'échantillon des...
Déclarations de divulgation
Remerciements
Nous remercions Mike W. Davidson (Florida State University) pour fournir l'ADN plasmidique codant pour des protéines fluorescentes. Ce travail a été soutenu par les Instituts nationaux de la santé accorde GM72048 (au DWP).
matériels
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
Références
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon