Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microdissection laser des Drosophile Neurones périphériques
Dans cet article
Résumé
Dans cette vidéo, article, nous présentons une méthode pour isoler un ou plusieurs Drosophile Neurones DA à partir de larves du tiers utilisant la capture infrarouge (IR) classe de microdissection par capture laser (LCM). L'ARN obtenu à partir des neurones isolés peuvent être facilement utilisés pour des applications en aval, y compris qRT-PCR ou microréseau analyses.
Résumé
L'arborisation dendritique (da) des neurones du système nerveux périphérique chez la drosophile (SNP) fournissent un excellent modèle dans lequel d'étudier les mécanismes moléculaires sous-jacents spécifiques à chaque classe 1,2 morphogenèse dendrite. Pour faciliter les analyses moléculaires des classes spécifiques de développement da neurone, il est vital d'obtenir ces cellules dans une population pure. Bien que toute une gamme de cellules différentes, et tissu-spécifique des techniques d'isolement d'ARN existent pour les cellules de drosophile, y compris magnétiques purification cellulaire perles basée 3,4, fluorescent tri cellulaire (FACS) 5-8, et l'ARN protéine de liaison des stratégies basées sur neuf, aucun des ces méthodes peuvent être facilement utilisées pour isoler une ou plusieurs classes spécifiques drosophile neurones DA avec un haut degré de précision spatiale. Microdissection par capture laser (LCM) a émergé comme un outil extrêmement puissant qui peut être utilisé pour isoler des types cellulaires spécifiques des sections de tissus avec un haut degré de résolution spatiale et de précision. L'ARN obtenu à partir de cellules isolées peuvent ensuite être utilisées pour des analyses, y compris qRT-PCR et profilage de l'expression biopuces dans un type cellulaire donné 10-16. À ce jour, LCM n'a pas été largement appliquée dans l'analyse des tissus et des cellules de drosophile 17,18, y compris les neurones DA à l'étape du stade larvaire tiers de développement.
Ici, nous présentons notre protocole optimisé pour l'isolation des neurones DA drosophile en utilisant l'infrarouge (IR) classe de LCM. Cette méthode permet la capture d'unique, spécifiques à chaque classe ou de plusieurs neurones DA avec une haute spécificité et la résolution spatiale. Appariés selon l'âge des larves troisième stade exprimer une HES-mCD8:: GFP 19 transgène sous le contrôle soit de la classe IV da neurone spécifique PPK-GAL4 20 conducteur ou le pan-da neurone spécifique 21-7-21 GAL4 chauffeur ont été utilisés pour ces expériences. L'ARN obtenu à partir des neurones da isolé est de très haute qualité et peuvent être directement utilisés pour des applications en aval, y compris les qRT-PCR ou microréseau analyses. Par ailleurs, ce protocole LCM peuvent être facilement adaptées pour capturer d'autres types de cellules de drosophile à divers stades de développement dépend du type de cellule spécifique, le modèle d'expression GAL4 axée sur la GFP.
Protocole
Commentaires généraux sur LCM de Drosophila périphérique neurones
Laisser partir de 6 heures, jusqu'à une semaine ou plus pour LCM selon le type de tissu et le nombre de cellules nécessaires.
Toutes les procédures sont menées en stricte RNAse free conditions suivant les procédures standard. Les larves exprimant soit 21-7-GAL4, SAMU-mCD8:: GFP ou PPK-GAL4, SAMU-mCD8:: GFP lignes journaliste transgéniques ont été utilisées pour ces expériences.
1. Préparer les larves
- Recueillir 30-40 appariés selon l'âge des larves troisième stade et lavez-les dans le trou DDH 2 O suivie par rinçages brève RNAse Away (Sigma-Aldrich), et un lavage final dans le trou DDH 2 O pour enlever RNAse Away. Mèche pour enlever l'excédent ddH 2 O complètement avec un Kimwipe nettoyer avant l'enrobage des larves dans l'ensemble.
- Prenez un moule tissu propre intégration et de la couche elle avec un mince (1,5 à 2 mm) couche de PTOM, juste assez pour couvrir une seule couche de larves.
- Avant l'enrobage des larves, si nécessaire, refroidir les PTOM à 0 ° C dans les moules intégration tissulaire. Pour ce faire, en plaçant le moule contenant les PTOM sur un bloc de glace. Cela aidera à réduire le mouvement des larves au cours du processus d'intégration.
- Placer les larves propre sur les PTOM pré-refroidi et les disposer en parallèle à une autre. Une fois que les larves ont été organisées, lentement remplir le moule avec PTOM sans déranger l'arrangement des larves. Aligner figer le moule en le plaçant sur un bloc de glace sèche. [Etape critique:. Snap-geler les larves instantanément pour réduire le mouvement] Cette méthode permettra aux larves d'être dans un seul plan, en maximisant le nombre de cellules disponibles pour la capture par section.
Si elle est nécessaire pour préserver la morphologie des tissus permettant d'identifier les cellules d'intérêt, ou si le nombre attendu de cellules par section est jugé satisfaisant puis passez directement à l'étape 11.
Alternativement, si les cellules sont marquées spécifiquement et peuvent être identifiés avec un marqueur facilement identifiable, comme la GFP ou DP, mais le nombre de cellules par section est jugée faible, puis les étapes 5-10 mai être utile pour augmenter le nombre de cellules disponibles pour la capture par section. Ces étapes sont facultatives et ne doit être envisagée que si nécessaire, comme une méthode pour augmenter le nombre de neurones DA disponibles pour LCM par section quand la méthode échoue à fournir d'autres résultats favorables. [Attention: cette méthode peut perturber la morphologie du tissu ensemble et rendre l'identification des tissus basés sur la localisation spatiale spécifique très difficile.]
- Lavez 50-70 larves troisième stade tel que décrit dans l'étape 1. Placer les larves dans un tube de 1,5 ml contenant 500 ul de PBS 1X RNAse.
- Dounce les larves aide d'un pilon en polypropylène (USA scientifique), avec 6-7 lents coups puissants.
- Centrifuger la solution à 16 000 g (x) pour les 5-10 secondes (jusqu'à ce que les cuticules des larves s'installent au fond du tube de microcentrifugation]. Jeter le surnageant. Le culot devrait principalement consister à cuticule des larves à laquelle le SNP, y compris les neurones da , est étroitement adhéré.
- Laver la cuticule granules 2-3 fois dans du PBS 1X et resuspendre le culot dans 500 ul de PBS 1X. Faites tourner la solution à 16 000 g (x) pendant 1 minute pour former une compacte à granulés. Aspirer le surnageant complètement en utilisant une amende pipette Pasteur.
- Retirer délicatement le culot du tube de microcentrifugation aide d'une spatule propre, et la mèche pour enlever l'excédent avec un mouchoir PBS Kimwipe propre. [Note: Il est important de garder la pastille aussi compact que possible pour augmenter le rendement cellulaire]. Placez la cuticule compacte à granulés sur un moule en plastique contenant une couche mince de l'OCT (environ 1mm).
- Écartez doucement le culot dans une zone circulaire mince. Remplissez le moule avec des PTOM, et de geler le tissu comme décrit dans l'étape 4.
- L'utilisation d'un cryostat, couper les coupes congelées à 5-8 um d'épaisseur sur la plaine, étiquetés, non chargé, RNAse lames de microscope. [Etape critique: Position des sections de tissu près du centre de la diapositive.]
- Stocker les diapositives soit directement sur la glace sèche ou à -80 ° C dans un endroit propre glisser la boîte avant d'être prêt pour la microdissection. Effectuer LCM préférence au sein d'une semaine après la coupe du tissu.
2. La déshydratation et de suppression des cuticules Frozen Sections larvaires
[Etape critique: Toutes les solutions pour la déshydratation doit être préparé avant chaque session de LCM. Déshydratation complète des coupes de tissus congelés larvaire est essentiel pour atteindre l'efficacité optimale de microdissection]
- Retirez les diapositives contenant les sections gelées de tissu larvaire du congélateur à -80 ° C et les placer sur la glace sèche.
- Supprimer une seule lame de glace sèche et immédiatement le placer directement dans un TU conique de 50 mlêtre rempli avec fixateur d'éthanol à 70%, suivie par une courte rincer à RNAse ddH O 2 selon les époques recommandées présentées dans le tableau 1.
- La présence de la cuticule des larves dans les sections gelées peuvent nuire à l'efficacité de captage efficaces en empêchant LCM bouchon-cellule de contact qui peut conduire à la capture non-spécifique. Si nécessaire, effectuer les étapes suivantes (4-5) pour effacer la cuticule des coupes de tissus.
- Délicatement la pipette 50 ul de trypsine 2,5% directement sur les coupes de tissus et incuber pendant 5-30 secondes à température ambiante. [Etape critique: Cette étape peut nécessiter l'optimisation. Le temps d'incubation dépend du tissu à microdisséquées et l'épaisseur de la section. D'incubation plus longue peut tout effacer, y compris les cellules d'intérêt, tandis qu'une courte incubation peut être insuffisant pour enlever la cuticule]
- Rincer les sections brièvement dans un tube conique de 50 ml contenant RNAse free ddH 2 O pour enlever la trypsine, et les fragments de cuticule vaguement adhéré.
- Plonger les lames de manière séquentielle dans chaque partie de l'éthanol en suspens et solutions pour le xylène durées recommandées (tableau 1) pour compléter le processus de déshydratation.
- Après le gradient déshydratation, les diapositives sont brièvement séché sous un courant d'air doux pendant 60-120 secondes à température ambiante avant de procéder à LCM. [Attention: Sécher le xylène complètement les coupes de tissu avant de procéder à LCM. Le xylène est connu pour dissoudre le bouchon LCM polymère résultant de l'échec de microdissection].
| L'éthanol à 70% (fixateur) | 3-10 secondes |
| ddH 2 O | 5-10 secondes |
| Incubation trypsine 2,5% | 5-30 secondes |
| ddH 2 O | 5-10 secondes |
| L'éthanol à 70% | 60 Secondes |
| L'éthanol à 95% | 60 Secondes |
| L'éthanol à 100% | 120 Secondes |
| L'éthanol à 100% | 120 Secondes |
| 100% Xylène | 120 Secondes |
| 100% Xylène | 120 Secondes |
| Air sec dans un courant d'air doux | 60-120 secondes |
Tableau 1: Procédure recommandée pour la déshydratation de la GCV des coupes de tissus congelés larvaire.
3. Microdissection laser
PixCell IIe LCM instrument équipé Fluor 300 optique à épifluorescence optimisé pour EGFP a été utilisé pour effectuer le LCM.
[Etape critique: Si possible, effectuez la microdissection dans une chambre à humidité contrôlée pour éviter toute réduction de l'efficacité de microdissection due à l'humidité accrue. L'humidité ambiante est un facteur crucial affectant l'efficacité de microdissection. Humidité ambiante faible peut provoquer une augmentation autostatique résultant de la capture non-spécifique, tandis que l'humidité ambiante élevée peut entraîner l'efficacité de microdissection faible. Nous avons atteint l'efficacité optimale entre LCM 25-50% d'humidité relative.]
- Tournez sur la puissance pour le microscope et le boîtier de commande laser.
- Chargez le support de montage CapSure bouchon avec HS LCM bouchons (Molecular Devices): Deux cartouches de bouchons LCM peuvent être chargés en même temps.
- Ouvrez le logiciel Molecular Devices et entrez les détails expérience, y compris le numéro de diapositives et le numéro de lot du Cap.
- Chargez une nouvelle HS LCM bouchon de la cartouche sur l'instrument PixCell IIe LCM et le positionner correctement par rapport à la manette pour assurer le bon positionnement de la PAC par rapport à la zone de capture.
- Placez la lame de microscope contenant fraîchement déshydrate coupes de tissus larvaires sur la platine du microscope pour la microdissection.
- Repérez les cellules marquées par fluorescence en utilisant les oculaires ou l'écran d'ordinateur. En raison de la grande spécificité de PPK-GAL4, SAMU-mCD8:: ligne GFP journaliste transgéniques, la classe IV neurones DA peut être facilement identifié par fluorescence de la GFP.
- Sujet le tissu à l'aide de LCM CapSure HS LCM bouchons [pour un ensemble détaillé d'instructions pour la mise de l'instrument, focalisation du laser et l'exécution LCM voir référence 22].
- Réglez le "Power" et "Durée" laser paramètres d'impulsion pour atteindre un endroit précis polymère fondu, dont la taille correspond à la taille du spot laser sélectionné. Ajustez les paramètres pour personnaliser la taille de polymère zone fondue. Les paramètres suivants ont été utilisés pour microdissecting seule classe IV da neurones: Diamètre du spot 7,5 um, de la force au laser 30-50 mW, le temps de laser et de deux-4 Ms et 1-2 coups par cellule ont été utilisés. [Etape critique: les paramètres du laser requise pour un bon endroit peut varier selon l'épaisseur des tissus et des conditions d'humidité ambiante. Réglez la «Power» et «Durée» réglages nécessaires pour atteindre les dimensions fondue place polymère pour microdissecting cellules simples ou multiples.]
- Afin de maximiser la spécificité, microdissect cellules avec un chevauchement minimal et une forte fluorescence. Chaque capuchon est capable de capturer de nombreux corps cellulaires. [Etape critique: Pour éviter la dégradation de l'ARN, de limiter le temps total d'analyse notamment la déshydratation et la microdissection à moins de 45 minutes]
- Une fois toutes les cellules d'intérêt ont été capturés, soulever le bouchon HS LCM avec les cellules microdisséquées et le plaça sur une lame propre à confirmer la présence des cellules capturées et inspecter visuellement le bouchon de la présence de cellules indésirables ou des débris.
4. L'isolement d'ARN à partir des cellules dérivées de LCM
- Fixez le capuchon contenant les cellules à une microdissection ExtracSure (Molecular Devices) dispositif. Ajouter 12μl de tampon d'extraction de l'ARN (PicoPure, Molecular Devices) à la surface de bouchon contenant les cellules et de connecter un tube de réaction inverse à parois minces (GeneAmp, Applied Biosystems) à l'appareil ExtracSure. Placez l'ensemble sur un plateau d'alignement (Molecular Devices) et le couvrir avec un bloc d'incubation (Molecular Devices) préalablement chauffée à 42 ° C dans un incubateur.
- Après une incubation de 30 minutes, centrifuger les tubes contenant les extraits à 800 g (x) pendant 2 minutes. Fermer les tubes et de stocker les extraits cellulaires à -80 ° C jusqu'au moment de purification d'ARN.
- Extraire et purifier l'ARN colonne selon le PicoPure (Molecular Devices) des instructions kit d'extraction d'ARN. Traitement à la DNase est facultative et peut être effectuée sur une colonne lors de la purification de l'ARN comme nécessaire. Si nécessaire, des échantillons de LCM multiples peuvent être regroupées lors de la purification dans une seule colonne d'augmenter le rendement final de l'ARN et peuvent être élues dans un petit volume (11-30 pi) de tampon d'élution (PicoPure, Molecular Devices) et conservés à -80 ° C jusqu'à utilisation. Si vous le souhaitez une aliquote de 1 ul peuvent être utilisés pour évaluer la qualité totale ARN sur un bioanalyseur 2100 (Agilent Technologies, Inc.)
Les résultats représentatifs
Microdissection laser (LCM) a été utilisée pour isoler unique, spécifiques à chaque classe ou de plusieurs neurones DA de la drosophile stade larvaire tiers (figure 1). LCM permet un degré élevé de précision et de spécificité dans l'isolement des corps cellulaires des neurones da drosophile (Figure 2a-c). Par ailleurs, l'ARN total purifié à partir de ces neurones isolés da a été jugée d'excellente qualité, comme indiqué par la présence de 5.8S forte, 18S et 28S du ribosome pics ARN lorsqu'il est analysé sur une bioanalyseur Agilent 2100 (Agilent Technologies, Inc) (figure 2d).
Pour évaluer l'enrichissement neuronaux spécifiques de nos cellules isolées nous avons effectué quantitative en temps réel la transcription inverse PCR (qRT-PCR) en utilisant le gène spécifique neuronale marqueur, elav. Pour les analyses qRT-PCR, nous avons calculé les niveaux relatifs d'expression elav dans le LCM microdisséquées neurones DA et normalisée cette expression à celle de notre contrôle endogène (rp49) et par rapport à l'ARN total isolé à partir de larves entier en utilisant la méthode ΔΔCt 23. Ces analyses ont révélé plus de 2,5 fois plus d'enrichissement des niveaux relatifs des elav dans LCM micro-disséqués da échantillons neurone par rapport à des animaux entiers (figure 3).
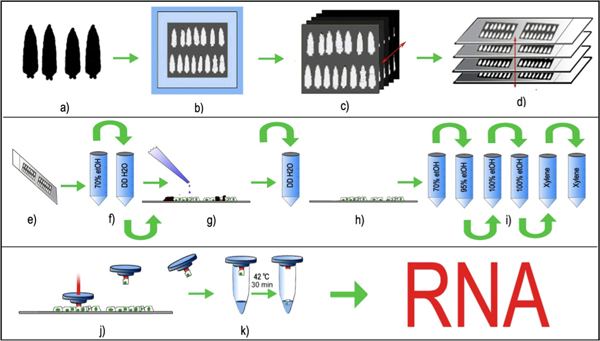
Figure 1: PPCM de neurones périphériques drosophile. (A) appariés pour l'âge des larves troisième stade sont sélectionnées, lavées et (b) incorporé dans un cryomold avec PTOM et congelé à -80 ° C, (c) 8μm sections de tissu de série sont créés en utilisant un cryostat standard et (d) placé de manière uniforme sur lames de verre propre. Les lames de verre avec les coupes de tissus fixés sont stockés à -80 ° C avant le traitement LCM. (E, f) Immédiatement avant LCM, les coupes de tissus sont décongelés et brièvement fixés dans l'éthanol à 70% suivie par rincer brièvement dans le trou DDH 2 O. (g) Les lames sont incubées avec la trypsine brièvement et rincés avec ddH 2 O pour enlever les cuticules (noir) à partir des sections de larves. (h, i) des coupes de tissus, sans cuticule des larves sont ensuite déshydratées dans un gradient d'éthanol et enfin effacé dans le xylène . (j) Le plafond de LCM avec un polymère thermolabile est placé sur la section de tissu et le laser est pulsé sur le corps cellulaire fluorescent choisi. L'impulsion laser fait fondre le polymère et engloutit le corps de cellules sélectionnée. Le bouchon de polymère, avec le corps de la cellule capturée est levée, et (k) de tampon d'extraction d'ARN est ajoutée à la cellule. La cellule capturée, avec le tampon d'extraction d'ARN est incubé à 42 ° C pendant 30 minutes et peut être soit conservés à -80 ° C, ou directement traitées pour la purification de l'ARN.
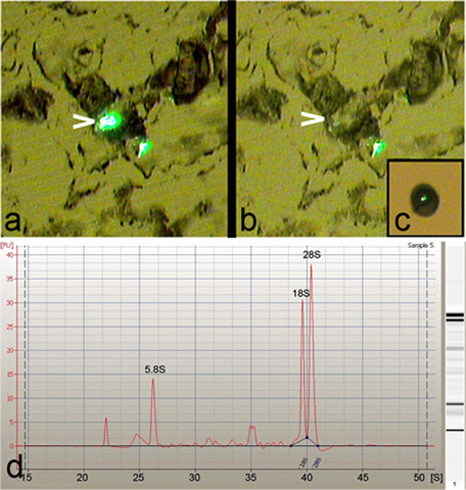
Figure 2: LCM facilite la capture de haute précision des neurones DA. (A) image représentant d'une déshydratation et à la trypsine traitée 8 microns coupe de tissu avant de LCM de la scène, montrant deux classes IV neurones étiquetés avec la GFP da par le PPK-GAL4, UASmCD8:: souche rapporteur GFP. Remarque, l'un des neurones est en surbrillance (tête de flèche) pour la capture. (B) le corps cellulaire du neurone en surbrillance (flèche) est proprement micro-disséqués avec une grande spécificité de la section de tissu. (C) Fin de vue d'une classe unique IV-da neurone capturés sur le bouchon de LCM. (d) bioanalyseur Agilent 2100 (Agilent Technologies, Inc) électrophérogramme d'ARN total isolé à partir de neurones da LCM dérivés, montrant une excellente qualité de l'ARN, comme indiqué par la présence de forte 5.8S, 18S et 28S ARNr pics.
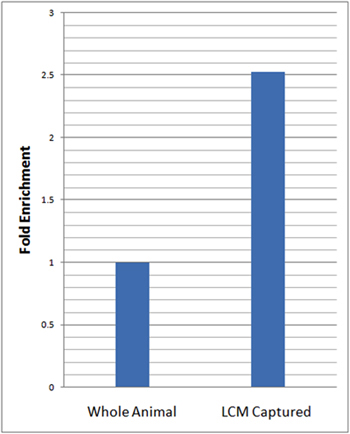
Figure 3:. QRT PCR révèle un enrichissement substantiel de l'expression du marqueur génique neuronale dans LCM capturé neurones DA par rapport à l'animal entier qRT PCR analyses de neurone-spécifique l'expression du gène marqueur (elav) dans LCM capturé da neurones (21-7-GAL4, SAMU-mCD8:: GFP) et des animaux entiers dans appariés pour l'âge des larves troisième stade a été réalisée en trois exemplaires. Les niveaux relatifs d'expression elav dans LCM capturé neurones DA ont été normalisées pour le contrôle endogène (rp49) et par rapport à l'ensemble des larves en utilisant la méthode ΔΔCt 23. Un enrichissement de 2,5 fois dans les niveaux relatifs de elav dans LCM capturé da échantillons neurone a été observée par rapport à des animaux entiers.
Dépannage
Problème: dégradés, ou de mauvaise qualité ARN.
Assurez RNAse condition libre à travers l'expérimentation. Essayez de réduire le temps passé sur LCM par diapositive à 30 minutes. Gardez les lames et les échantillons sur glace sèche, sauf lors de l'exécution de LCM. Éviter les coupes de tissu fonte une fois qu'ils sont coupés.
Problème: la plupart des cellules sont perdues de la diapositive en cours de traitement trypsine (étape 17-18).
Essayez de réduire le temps de traitement à la trypsine. Essayez de réduire la concentration de la trypsine.
Problème: Présence de la cuticule et d'autres débris de tissus non spécifiques sur le polymère de la PAC.
Essayez d'enlever les débris de tissu en tamponnant la surface du polymère avec le côté collant d'une note d'adhésif 22.
Problème: l'efficacité LCM basse.
Essayez d'augmenter le temps d'incubation dans de l'éthanol 100% et les xylènes. Réduisez l'humidité ambiante à l'aide de déshumidificateurs.
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole présentés ici décrit notre méthode optimisée pour l'isolement des neurones chez la drosophile périphérique via LCM. Alors que ce protocole a été conçu LCM pour l'isolement spécifique de simple, spécifiques à chaque classe ou de plusieurs neurones da drosophile de l'étape de troisième stade larvaire de développement, des modifications mineures du protocole pourrait être facilement adaptée à la capture d'autres types de cellules de drosophile de to...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Nous remercions les Drs. Yuh-Nung Jan et Wes Grueber pour fournir des stocks volantes utilisées dans cette étude, et Virginia Espina, Dr Emanuel Petricoin et le Dr Lance Liotta d'aide à la LCM. Les auteurs remercient F. Thomas et Kate Miller Jeffress Memorial Trust pour le soutien de cette recherche (DNC) et l'Université George Mason Provost s de bureau (EPRI).
Access restricted. Please log in or start a trial to view this content.
matériels
Equipement:
- Cryostat
- Tube de 50 ml conique pour la fixation de diapositives, rinçage, traitement à la trypsine et de l'éthanol / déshydratation xylène
- Congélateur à -80 ° C
- Incubateur
- PixCell IIe LCM Instrument avec Fluor 300 optique à épifluorescence optimisé pour l'EGFP (Molecular Devices-Molecular Devices)
Références
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Parrish, J. Z., Emoto, K., Kim,, Jan, Y. N. Mechanisms that regulate establishment, maintenance, and remodeling of dendritic fields. Annu. Rev. Neurosci. 30, 399-423 (2007).
- Wang, X., Starz-Gaiano, M., Bridges, T., Montell, D. Purification of specific cell populations from Drosophila tissues by magnetic bead sorting, for use in gene expression profiling. Nature Protocols. , (2008).
- Iyer, E. P. R., Iyer, S. C., Sulkowski, M. J., Cox, D. N. Isolation and purification of Drosophila peripheral neurons by magnetic bead sorting. J Vis Exp. 34, 2912-2917 (2004).
- Tirouvanziam, R., Davidson, C. J., Lipsick, J. S., Herzenberg, L. A., Tirouvanziam, R., Tirouvanziam, R. Fluorescence-activated cell sorting (FACS) of Drosophila hemocytes reveals important functional similarities to mammalian leukocytes. Proc. Natl. Acad. Sci. 101, 2912-2917 (2004).
- Shigenobu, S., Arita, K., Kitadate, Y., Noda, C., Kobayashi, S. Isolation of germline cells from Drosophila embryos by flow cytometry. Dev. Growth Differ. 48, 49-57 (2006).
- Reeves, N., Posakony, J. W. Genetic programs activated by proneural proteins in the developing Drosophila PNS. Dev. Cell. 8, 413-425 (2005).
- Jinushi-Nakao, S. Knot/Collier and Cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Yang, Z., Edenberg, H. J., Davis, R. L. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucl. Acids Res. 33, (2005).
- Appay, V. Sensitive Gene Expression Profiling of Human T Cell Subsets Reveals Parallel Post-Thymic Differentiation for CD4+ and CD8+ Lineages. J. Immunol. 179, 7406-7414 (2007).
- Ginzinger, D. G. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp. Hematol. 30, 503-512 (2002).
- Keays, K. M., Owens, G. P., Ritchie, A. M., Gilden, D. H., Burgoon, M. P. Laser capture microdissection and single-cell RT-PCR without RNA purification. J. Immunol. Methods. 302, 90-98 (2005).
- Volgin, D. V., Swan, J., Kubin, L. Single-cell RT-PCR gene expression profiling of acutely dissociated and immunocytochemically identified central neurons. J. Neurosci. Methods. 136, 229-236 (2004).
- Emmert-Buck, M. R. Laser capture microdissection. Science. 274, 998-1001 (1996).
- Xiao, W. Gene expression profiling in embryonic mouse lenses. Mol. Vis. 12, 1692-1698 (2006).
- Scharschmidt, T. Analysis of human osteoarthritic connective tissue by laser capture microdissection and QRT-PCR. Connect. Tissue Res. 48, 316-323 (2007).
- Spletter, M. L. regulates Drosophila olfactory projection neuron identity and targeting specificity. Neural Dev. 2, 14-14 (2007).
- Hoopfer, E. D., Penton, A., Watts, R. J., Luo, L. Genomic analysis of Drosophila neuronal remodeling: a role for the RNA-binding protein Boule as a negative regulator of axon pruning. J. Neurosci. 28, 6092-6103 (2008).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. USA. 104, 5199-5204 (2007).
- Espina, V. Laser capture microdissection. Nat. Prot. 1, 586-603 (2006).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402-408 (2001).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon