Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microdissection de tissus embryonnaires Zebrafish Eye
Dans cet article
Résumé
Cet article décrit une approche pour le poisson-zèbre microdissect rétines avec et sans l'épithélium pigmentaire rétinien attachés, de un à trois embryons jours post-fécondation.
Résumé
Le poisson zèbre est un modèle animal populaires pour la recherche sur le développement des yeux en raison de sa rapidité
Protocole
Partie 1: Préparatifs avant microdissection
- Solutions
- E3 moyenne 4 (5 mM de NaCl, 0,17 mM de KCl, 0,33 mM de CaCl2 et 0,33 mM MgSO 4).
- Une solution de Ringer, 5 (116 mM NaCl, 2,9 mM de KCl, 1,8 mM CaCl 2, 5 mM d'HEPES, pH 7,2), stérilisée par filtration.
- NaOH 5N.
- Gravure chimique des aiguilles de tungstène
- Fixez un petit bécher contenant NaOH 5N sur une boîte de Petri par de l'argile.
- Attacher un trombone sur le côté du vase, afin qu'il entre en contact avec la solution de NaOH.
- Connectez l'électrode négative d'une alimentation DC pour le trombone et l'électrode positive à une extrémité d'une pièce courte (~ 2cm) du fil de tungstène.
- Enveloppez l'autre extrémité du fil de tungstène avec une petite boule d'argile et trempette cette fin dans la solution de NaOH.
- Augmenter la tension à environ 3V et tremper le fil de haut en bas dans la solution de NaOH jusqu'à une vitesse de gravure de bons est atteint. Une aiguille dans une bonne qualité peuvent généralement être gravés en 10 minutes.
- Le fil de tungstène exposée à la solution deviendra progressivement plus minces. Quand la boule d'argile tombe, de l'autre côté du fil qui est encore attaché à l'électrode positive aura une forme aiguille pointue.
- Rincer l'aiguille forte avec une solution de Ringer ou E3 pour enlever les dépôts de sel.
- Fixez l'aiguille à un applicateur en bois par un ruban ou un porte-aiguille pour une manipulation facile.
- Les plaques de culture
- Le Falcon 60 x 15 mm plaques en polystyrène de culture prêts à l'emploi pour la microdissection de la rétine.
- Pour disséquer RPE-joint la rétine, écraser deux embryons complètement dans une plaque de culture contenant la solution de Ringer pour se débarrasser de l'adhésivité de la surface 30 minutes avant la dissection. Peu avant la dissection, laver abondamment la plaque avec une solution de Ringer fraîches.
- Collecte des embryons et de la tenue
- Zebrafish adultes sont maintenues comme décrit 4, 5.
- Séparez les poissons d'élevage en cuves parent statiques paires par un diviseur de la nuit avant la reproduction.
- Enlevez le séparateur après la lumière ambiante est activée dans le lendemain matin. Laisser les parents à traverser à intervalles de 10 minutes toutes les demi-heures. Séparez les poissons après chaque passage.
- Maintenir les embryons prélevés sur chaque passage dans le milieu de l'E3 séparément à 28 ° C.
- Embryons au stade de 10 à 12 heures après fécondation (HPF) et aime revenir immédiatement avant la dissection au niveau des points de temps spécifique, selon les critères établis 1, 6.
Partie 2: Dissection - retrait du cerveau et une exposition oculaire
- Les procédures décrites dans cette section sont communes pour disséquer la rétine (partie 3A) et RPE-joint la rétine (partie 3B).
- Tous les dissections fines sont effectuées par un bout de la pince Dumont et assistée par une autre paire de pince Dumont pour le positionnement des tissus. Une aiguille de tungstène chimiquement gravé peut être utilisé pour des manipulations fines, si nécessaire.
- Tous les dissections fines sont effectuées à un grossissement de 8x ~ 5 sous un microscope Olympus SZX16 équipé d'un objectif 1X ou équivalent.
- Maintenir les embryons dans le milieu de l'E3 dans une paillasse étuve à 28 ° C à côté de la loupe pour accéder facilement embryons lors de la dissection.
- La platine du microscope est chauffé à 28 ° C par une plaque thermo pour minimiser l'influence de la fluctuation de la température sur l'expression génique.
- Transfert d'un embryon à un stade précis de développement d'une solution de Ringer dans un Falcon 60 X 15 mm plaque de culture préparé comme décrit dans la Partie 1 # 3.
- Couper la tête avec une partie du tronc antérieur rapidement du corps.
- Pin l'extrémité postérieure de ce tissu sur une plaque de culture avec la pince aider.
- Ouvrez la tête sur le côté dorsal de départ du front antérieur.
- Enlever le cerveau de sorte que le côté médial de l'œil est exposé et est orientée vers le haut pour des manipulations supplémentaires.
Partie 3A: dissection rétiniennes 1
- Préparer l'embryon comme décrit dans la partie 2.
- Brosser soigneusement l'EPR exposé sur la face médiale de la balle des yeux qui est orientée vers le haut par le bout de la pince jusqu'à ce qu'une petite ouverture à la rétine est perçue.
- Poursuivre le brossage et l'épluchage d'action jusqu'à la face médiale de la rétine est presque tous exposés. Évitez de gratter et de poinçonnage de la rétine exposée.
- Pour supprimer l'EPR latérale sur la rétine qui est maintenant tournée vers le bas, approche qui et brosse à un angle de 45 ° environ de la surface de plaque de culture.
- Retirez l'EPR qui est attaché relativement fermement à l'ora serrata en épinglant la partie détachée de l'EPR à la cPlaque ulture pour la dissection, puis soulevez délicatement la rétine.
- Rouler la rétine au fond de la boîte de culture pour nettoyer l'EPR résiduels.
- Nous avons remarqué que cette plaque notamment Falcon culture en polystyrène a une adhésion préférentielle des RPE pendant environ 20 minutes une fois l'embryon est écrasé. Cette propriété est utilisée pour l'enlèvement des restes EPR. Cependant, les cellules rétiniennes ne collent à la surface dans une moindre mesure, qui peuvent être inspectés de près à fort grossissement. On doit trouver un équilibre entre l'exhaustivité de l'enlèvement RPE et l'intégrité de la rétine.
- L'objectif adhère souvent à la plaque de culture et se détache de la rétine au cours du laminage. Parfois, il est nécessaire de détacher le cristallin par une aiguille de tungstène gravé avec une action tourbillonnante sur la surface de la lentille.
- Ces procédures peuvent réussir à éliminer l'EPR de la rétine sans pour autant compromettre l'intégrité du tissu. Ceci est indiqué par une bonne morphologie générale (figure 1B et B ') et l'histologie (figure 1B "), une flèche, en particulier, la préservation de la matrice extracellulaire entre la couche des photorécepteurs et l'EPR est exceptionnellement bonne (figure 1B."; comparer avec l'histologie de l'embryon entier (figure 1A ")).
Partie 3B: RPE-attachée de dissection rétiniennes 3
- Préparer l'embryon comme décrit dans la partie 2.
- Pin la tête à la plaque de culture par la pince assistant. Soulevez doucement l'œil du côté latéral postérieur et rouler sur le côté antérieur.
- La choroïde présomptifs et le tissu scléral à l'extérieur de la couche RPE sont relativement étroitement attachée à la peau et peut être surtout décollée en roulant les yeux attentivement du côté antérieur.
- Retirez la lentille avec une aiguille de tungstène après le côté latéral de l'oeil est exposé et quand l'œil est encore attaché à la peau.
- Ces procédures peuvent réussir à préserver la couche d'EPR entier avec la rétine. Choroïde présomptif et le tissu scléral peut être éliminé en grande partie (figure 1C, C 'et C ").
Partie 4: collecte d'échantillons de tissus pour des travaux d'ARN
- Les échantillons peuvent être disséqués recueillies dans TRIzol dans un tube de micro sans RNase pour la caractérisation aval ARN comme décrit précédemment 1.
Les résultats représentatifs
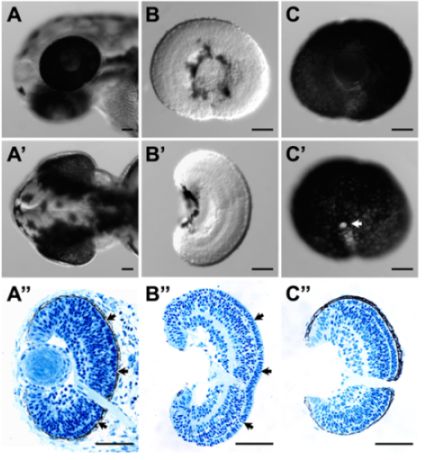
La figure 1 (A). Latérale et (A ') vue dorsale d'une tête de poisson zèbre larvaire à 52 HPF avant dissection. (A ") La section correspondante histologique de la tête des larves dans (A) et (A ') (B). Latérale et (B') vue dorsale d'une rétine disséqués à 54 HPF. La surface de la rétine est intacte des deux latéraux et des vues dorsale. (B ") La section correspondante histologique de la rétine disséqué en (B) et (B '). La structure de la rétine et le laminage rétine est intacte. En particulier, la matrice extracellulaire, entre la couche des photorécepteurs et l'EPR (A ", flèches) a été bien conservé dans la rétine disséqué (B", flèches). (C) et latérale (C ') vue médiale d'un disséqué RPE-attachée rétine à 52 HPF. EPR couche était intact et continu, qui a également été indiqué par la coupe histologique des tissus disséqués (C "). La zone blanche dans C 'est le nerf optique (flèche). Pour l'histologie, les échantillons de tissus ont été prélevés et fixés dans 4% paraformaldéhyde. Plastic enrobage et de sectionnement de ces échantillons ont été réalisées comme décrit 3. Barre d'échelle = 50 microns.
Discussion
Microdissection de tissus oculaires poisson zèbre peut effectivement obtenir des rétines intactes et RPE-attachée rétines. Cette aide substantielle des études d'expression se rapportant à un tissu oculaire spécifique (ie la rétine ou RPE). En fait, nous avons utilisé avec succès ces procédures pour obtenir des profils d'expression ARN de la rétine entière 1 et 3 EPR. L'utilité de ces profils est fortement soutenue par notre récente identification des voies et des familles...
Déclarations de divulgation
Remerciements
Ce travail est soutenu par un fonds de démarrage à partir du Département des sciences biologiques à l'Université Purdue.
matériels
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Références
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish : a practical approach. , (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon