Method Article
Visualisation et quantification des interactions intracellulaires des Neisseria meningitidis Et l'homme α-actinine par imagerie confocale
Dans cet article
Résumé
Neisseria meningitidis (Nm), un agent pathogène respiratoire gram négatif humaines spécifiques, peuvent se lier aux humains α-actinine. Nous présentons ici un protocole pour la visualisation de co-localisation de la bactérie intracellulaire avec des α-actinine après l'entrée des bactéries dans les cellules humaines endothéliales microvasculaires du cerveau (HBMECs).
Résumé
La protéine Opc de Neisseria meningitidis (Nm, méningocoque) est une protéine exprimée en surface intégrante membrane externe, qui peut agir comme une adhésine et un invasine efficace pour les cellules humaines épithéliales et endothéliales. Nous avons identifié endothéliales surface située en tant que récepteurs intégrines majeur pour l'OPC, un processus qui exige Opc pour lier des ligands de l'intégrine premier telles que la vitronectine et via ces à la cellule-récepteurs exprimés 1. Ce processus conduit à l'invasion bactérienne des cellules endothéliales 2. Plus récemment, nous avons observé une interaction des OPC avec une protéine 100kDa trouve dans lysats de cellules entières de cellules humaines 3. Nous avons d'abord observé cette interaction lorsque les protéines de la cellule hôte séparées par électrophorèse et transférées sur nitrocellulose ont été superposées avec OPC-exprimant Nm. L'interaction est directe et ne comportait pas de molécules intermédiaires. Par spectrométrie de masse, nous avons établi l'identité de la protéine comme α-actinine. Comme aucune surface exprimée α-actinine a été trouvé sur une des lignes de huit cellules examinées, et que les interactions avec les cellules endothéliales Opc dans la présence de plomb sérique à l'entrée des bactéries dans les cellules cibles, nous avons examiné la possibilité de deux protéines interagissant intracellulaire. Pour cela, le cerveau humain en culture des cellules endothéliales microvasculaires (HBMECs) étaient infectés par Opc exprimant Nm pour des périodes prolongées et les emplacements des bactéries internalisées et α-actinine ont été examinés par microscopie confocale. Nous avons observé en fonction du temps augmentation de co-localisation des Nm avec la protéine du cytosquelette, qui était considérable, après une période de huit heures d'internalisation bactérienne. En outre, l'utilisation de logiciels d'imagerie quantitative nous a permis d'obtenir une mesure relative de la co-localisation des Nm avec α-actinine et les autres protéines du cytosquelette. Nous présentons ici un protocole pour la visualisation et la quantification de la co-localisation de la bactérie à des protéines intracellulaires après l'entrée des bactéries dans des cellules endothéliales humaines, bien que la procédure est également applicable aux cellules épithéliales humaines.
Protocole
1. Immunofluorescence Protocole
Semis, maladies infectieuses et l'immuno-coloration
Les procédures suivantes nécessitent convient de culture tissulaire de sécurité de niveau et des installations de laboratoire microbiologique.
JOUR 1
A. Préparation des cellules cibles de l'infection
- HBMECs des semences à 50% de confluence (~ 1.5x10 4 cellules / cm 2) sur des lamelles de verre (16 mm de diamètre) placés dans une plaque de 12 puits (3,8 cm zone de croissance 2 / puits).
Milieu de croissance: RPMI 1640 complété avec inactivés par la chaleur de 15% (56 ° C, 30min) FBS, 2 mM de glutamine, 1 mM pyruvate de sodium, 100 U / ml de pénicilline / streptomycine et 1% (v / v) MEM aminés non essentiels solution de 1% des acides et des vitamines MEM solution. - Culture pendant la nuit (O / N) à 37 ° C, dans un 5% de CO 2 incubateur.
B. culture bactérienne
- Cultiver la souche d'intérêt O / N (16-18 h) sur le support de perfusion, par exemple Cœur nécessaire cervelle (BHI) gélose complétée par du sang de cheval 10% chauffé à 37 ° C en atmosphère de CO 2 5% 4.
JOUR 2
A. Préparation de bactéries (N. meningitidis) Suspension
- En utilisant une boucle de la culture uL 10, faire une suspension de la culture bactérienne durant la nuit dans 2 mL PBSB (PBS avec du calcium et du magnésium).
- Autoriser gros agrégats bactériens à régler en laissant la suspension reposer pendant 5 min à température ambiante (RT).
- Sans perturber le culot, le transfert de la tranche supérieure de 1 mL de la suspension (stock d'inoculum) dans un tube stérile.
- Pour estimer le nombre de bactéries dans l'inoculum bouillon, ajouter des aliquotes (20-50 uL) dans des tubes contenant des volumes de 1 ml de SDS 1% dans 0,1 M NaOH et mélanger délicatement pour solubiliser.
- Mesurer la teneur en acide nucléique de la solution en déterminant l'absorbance à 260 nm (A260). Dans nos mains, A260 de 1 correspond à 5x10 8 unités formant colonie / ml (UFC / ml). Ceci peut être vérifié en préparant une série de dilutions de l'inoculum stock dans PBSB, étalement sur gélose et le comptage des colonies après O / N incubation.
- Diluer une aliquote de l'inoculum d'actions dans le milieu d'infection [(M199 supplémenté avec 2% décomplémenté (56 ° C, 30min) du sérum humain normal (SHN)] pour obtenir la densité requise bactérienne pour l'infection de cellules cibles.
- Dans notre laboratoire, un ratio d'infection de 200-300 bactéries par cellule cible est couramment utilisé.
Infection B. Culture Cellulaire
- Lavez les lamelles avec des cellules cibles en culture 3 fois avec le milieu de Hank pour enlever toute trace d'antibiotiques.
- Infecter les cellules fraîchement préparés suspensions bactériennes (décrit ci-dessus) pendant 3 h à 8 h à 37 ° C, en 5% de CO 2.
- A la fin de la période d'infection, lavez les cellules trois fois avec du PBS et de fixer dans 500 ul de 2% de paraformaldéhyde (PFA) pendant 30-45 min à température ambiante ou O / N à 4 ° C.
- Fixation paraformaldéhyde à la concentration et l'heure indiquées ci-dessus a été jugé approprié pour la conservation de la morphologie bactérienne et cellulaire.
- Après le lavage hors paraformaldéhyde, permeabilise les cellules paraformaldéhyde fixé par incubation dans 0,1% de Triton X-100 dilué dans du PBS pendant 10 min.
- Laver les échantillons 3 fois avec PBS.
- Passez à l'immuno-coloration ou, alternativement, laisser des échantillons de 500 pi de 1% de BSA / PBST O / N à 4 ° C.
JOUR 3
Immuno-marquage
Coloration des bactéries intracellulaires et α-actinine peuvent être réalisées successivement ou simultanément par l'utilisation d'anticorps appropriés primaire et secondaire comme suit: toutes les procédures peuvent être menées en plaques de 12 puits.
- Bloquer les lamelles contenant les cellules perméabilisées avec 500 pi de 3% de BSA / PBST (PBS contenant 0,05% de Triton X-100) pendant 30-60 min à température ambiante
- Après un lavage avec du PBS, le transfert de chaque lamelle d'un nouveau puits à sec dans la plaque de 12 puits.
- Ajouter les anticorps primaires contre les bactéries et les α-actinine, quatre-vingt à 100 uL d'anticorps par la lamelle est suffisante si elle est ajoutée soin de couvrir la surface de la lamelle. Incuber pendant 1h à température ambiante.
- Nous avons utilisé antisérum polyclonal de lapin contre Neisseria meningitidis (laboratoire levés) et la souris des anticorps monoclonaux (mAb) contre α-actinine (Abcam) simultanément. Dans certaines expériences, à la place de l'anti α-actinine, anticorps monoclonaux contre l'actine ou la vimentine ont été utilisés (Sigma).
- A la fin de l'incubation, ajouter 200 ul de PBS pour le bien, soulever la lamelle et la placer dans un nouveau puits contenant 500 ul de PBS.
- Après 5 min, retirez du PBS par pipetage, puis ajouter du PBS frais. Répéter deux fois. Transfert à un couvre-nouveau puits à sec.
- Ajouter l'anticorps secondaire approprié conjugué à des fluorochromes différents dilué dans 1% de BSA / PBST; incuber à température ambiante pendant 1h dans le noir.
- Pour la détection de bactéries, nous avons utilisé anti-lapin conjugué à la TRITC Ig et pour la détection de la protéine α-actinine et les autres du cytosquelette, nous avons utilisé Ig anti-souris conjugué à la FITC soit (Sigma) ou Alexa Fluor 488 - (Invitrogen).
- A la fin de l'incubation, laver comme dans les étapes 4 et 5.
- Contre tache avec 0,6 mg / ml en PBS DAPI (colorant ADN) pendant 5 min à température ambiante dans l'obscurité.
- Rincer avec du PBS.
- Mont lamelles (cellules vers le bas) sur des lames avec une goutte de milieu de montage (e, g. Mowiol ou Vectashield)
- Conserver dans l'obscurité à 4 ° C.
- Les échantillons sont prêts pour l'observation au microscope.
2. Microscopie confocale à balayage laser (CLSM)
Pour observer et capturer des images de bactéries intracellulaires et des éléments du cytosquelette, nous avons utilisé des échantillons immunomarquées et les images capturées en utilisant un Leica SP5-AOBS microscope confocal à balayage laser attaché à un Leica DM i6000 microscope à épifluorescence inversé. Toutes les images ont été recueillies en utilisant un 63x NA 1,4 objectif à immersion d'huile et le processus avec le logiciel Leica.
Procédure de CLSM:
- Pour commencer la procédure CLSM, ajouter une goutte d'huile d'immersion à l'objectif et placer la lame spécimen, lamelle vers le bas, sur la platine du microscope.
- Régler le microscope à un mode visuel et de trouver la zone d'intérêt en utilisant les oculaires du microscope.
- Utilisation du logiciel Leica, sélectionnez le mode d'acquisition xyz.
- Sélectionnez le format de 512 x 512 (taille d'image). Pour les études colocalisation, la plus haute résolution, la plus précise de l'image; en gardant à l'esprit la limite de résolution du microscope. Ensuite, sélectionnez le mode bidirectionnel X, ce qui augmentera la vitesse de balayage et d'aider à réduire la photo-blanchiment.
- Mettre en place séquentielle des paramètres de numérisation. Cliquez dans le "seq" fonction et choisir l'un des modes de numérisation. Nous utilisons des «entre les lignes" mode.
- Sélectionnez laser poutres selon les fluorochromes conjugués aux anticorps secondaire: 405 nm pour le DAPI (bleu), 488 nm pour Alexa Fluor 488 (vert) et 561 nm pour TRITC (rouge). Activer tube photomultiplicateur (PMT) 1, 2 et 3, respectivement. Réglez les paramètres de PMT pour détecter la longueur d'onde d'émission correcte.
- Mettre en place des haut («commencer») et en bas («fin») de Z-piles ou une série. Ensuite, réglez le nécessaire "z-pas de taille".
- Neisseria meningitidis est un diplocoque (figure 1G) et puisque chaque coccus a un diamètre approximatif de 0,5 um, la taille z-étape de 0,20 um a été choisi pour renforcer la probabilité de scanner chaque coccus au moins deux fois. Il est également à la taille du pas pour une résolution optimale de 0,1 - 0,2 um.
- Définissez les paramètres de numérisation finale en choisissant une moyenne de 3 lignes pour améliorer le rapport signal sur bruit.
- En cliquant sur "démarrer" images doubles ou triples colorées sont obtenues par balayage séquentiel différentes longueurs d'onde pour éliminer la diaphonie entre différents chromophores.
- Pour une indication de la co-localisation des deux fluorochromes, sélectionnez l'option "overlay" fonction pour fusionner les canaux sélectionnés en une seule image, par exemple, lorsque les deux Alexa 488 (vert) et TRITC (rouge) fluorochromes colocalise, la couleur jaune apparaît dans l'image superposée .
- Compiler z-piles ou une série en utilisant la "projection maximale" de fonction pour la construction d'une image 2D requis pour visualiser colocalisation possible. Une analyse plus détaillée de la co-localisation peut être obtenue par l'analyse de chaque section optique.
- Après l'acquisition de la Z-piles ou une série, traiter vos données pour obtenir une image orthogonale pour la visualisation de la localisation intracellulaire des différents éléments (figure 1E).
3. Quantification de colocalisation
Les analyses statistiques des images microscope confocal à balayage sont réalisées avec le logiciel Volocity (Improvisation, PerkinElmer). Ce logiciel offre un outil conçu spécifiquement pour l'analyse de co-localisation tels que décrits par Manders et al. (1993) 5. Colocalisation dans le contexte de l'imagerie de fluorescence numérique peut être décrite comme la détection d'un signal à la même voxel (volume pixel) l'emplacement de chaque canal. Les deux canaux sont constitués d'images de deux fluorochromes différents pris dans la zone même échantillon (guide de l'utilisateur Volocity). Les analyses statistiques sont réalisées avec le logiciel Volocity (Improvisation, PerkinElmer) en utilisant l'analyse quantitative colocalisation décrit ci-dessous.
Analyse quantitative colocalisation
- Créer une bibliothèque avec des images en utilisant le logiciel Volocity CLSM.
- Sélectionnez "focus étendue" de l'image dans la barre supérieure. Cet outil va compiler z-piles dans une image 2D à analyser.
- Sélectionnez «colocalisation» de l'outil. Les deux canaux à analyser doit avoir la profondeur de la même couleur.
- Sélectionnez la zone que ça va être quantifiés. Régler le seuil de supprimer tout fond.
- Créer la sortie colocalisation en sélectionnant «générer colocalisation». Statistiques colocalisation sont générés pour les régions d'intérêt sélectionnées précédemment.
- Sélectionnez Manders coefficients R (coefficient de recouvrement) et Ma (coefficient de co-localisation).
- Coefficients Manders ne sont pas sensibles à l'intensité de la coloration comme ils sont normalisés par rapport à l'intensité des pixels au total, de sorte qu'ils peuvent être employés lorsque la coloration d'un antigène est plus forte que l'autre.
- Overlap R coefficient en fonction de Manders 5,6 représente le degré réel de colocalisation, c'est à dire le nombre de pixels qui colocalise par rapport au nombre total de pixels.
- D'autre part, le coefficient de co-localisation, Mon, décrit la contribution de fluorescence de la fraction plus abondante (dans ce cas α-actinine, vert) à la moitié moins abondantes (dans ce cas, les bactéries, rouge), c'est à dire le nombre de pixels rouges qui se chevauchent avec des pixels verts par rapport au nombre total de pixels rouges.
- Coefficients Manders comprise entre 1 et 0, 1 étant co-localisation haute, 0 aucun être, mais ils peuvent être exprimés en pourcentage pour faciliter l'interprétation.
- Les statistiques d'exportation des valeurs d'un document Excel pour la présentation des données.
4. Les résultats représentatifs
Localisation intracellulaire des OPC exprimer Neisseria meningitidis et les α-actinine
Imagerie confocale du cerveau humain cellules endothéliales microvasculaires infectés par Nm pour 3 et 8 heures comme décrit ci-dessus indiquée de colocalisation α-actinine et Nm, ce qui semblait être moins fréquents dans les trois expériences d'infection h (non montré) par rapport aux cultures infectées pendant 8 h ( Figure 1 AF). Une colocalisation démontrable de α-actinine avec OPC-exprimant méningocoques a été observée à chaque fois dans> 5 expériences répétées. L'analyse statistique des co-localisation à partir de plusieurs images confocale a été réalisée comme décrit ci-dessus. Globalement, dans HBMEC infectés avec OPC-exprimant les méningocoques,> 25% de chevauchement de la verdure (α-actinine) et rouge (Nm) pixels a été obtenue (figure 2B, Overlap coefficient R). Contrairement aux α-actinine, des expériences dans lesquelles l'étiquetage des bactéries internalisées et soit l'actine ou la vimentine a été réalisé, co-localisation occasionnelle a été observée avec l'actine mais avec la vimentine était rare (Figure. 2B).
Les données ont également été analysés en utilisant le coefficient, Ma, qui prend en compte l'abondance relative de chaque fraction. Ma est une mesure de la fréquence d'apparition du signal plus abondante (dans ce cas, verte, α-actinine) chaque fois que le signal le moins abondant (dans ce cas, rouges, bactéries) se produit. Cette mesure montre un niveau frappant de survenance d'α-actinine dans les environs de intériorisé méningocoques (figure 2A et C).
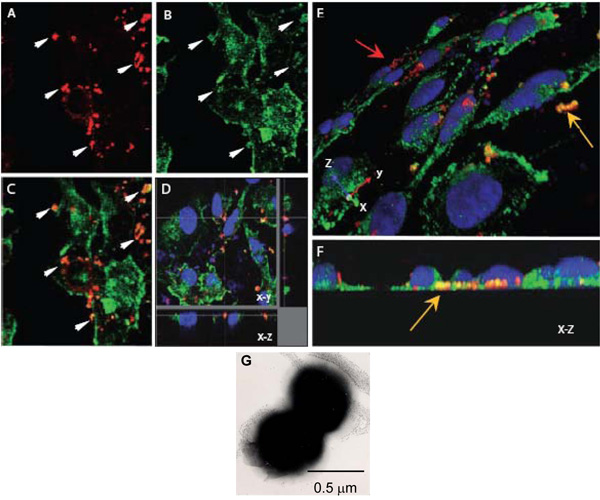
Figure 1. Microscopie confocale à balayage laser pour évaluer les interactions intracellulaires de N. meningitidis avec les α-actinine. AH. Confluent des monocouches endothéliales cultivées sur lamelles ont été infectés avec l'OPC-exprimant (AF) N. meningitidis. Après 8 h, non-adhérent bactéries ont été lavés, des cellules fixées avec du paraformaldéhyde et perméabilisées avec 0,1% de Triton X-100. Par la suite, les bactéries et les α-actinine ont été colorées comme décrit ci-dessus (α-actinine, vert, bactéries, rouge).
AC. Un champ de montrer des images xy de l'emplacement de Nm (A) ou α-actinine (B). La superposition d'image dans (C) indique plusieurs régions dans lesquelles couleur jaune-orange apparaît suggérant colocalisation. Les flèches en (A) et (B) montrent les régions où un haut degré de α-actinine l'accumulation semble avoir eu lieu autour des bactéries.
D. Dissection optique d'une co-localisation HBMEC monocouche infectée indiquant autour des bactéries intracellulaires situé à la base d'une cellule.
Encore une fois, cette co-localisation n'est pas due à la proximité accidentelle d'α-actinine, comme le général tache de α-actinine dans cette région est faible.
E et F. images tridimensionnelles des monocouches infectées HBMEC traitées comme ci-dessus. Une vue oblique de la surface apicale (E) montre bactéries adhérentes colorés en rouge (flèche rouge), alors que plusieurs bactéries situées vers les surfaces basales des cellules endothéliales (flèche jaune) sont nettement orange / jaune. Lieu basale peut être plus clairement vu dans (F) qui est une fin en XZ section.
G. Une image d'électron négatif teinté microscope de N. meningitidis montrant sondiplococcal prédominante à partir. Chaque coccus est d'environ 0,5 m de diamètre.
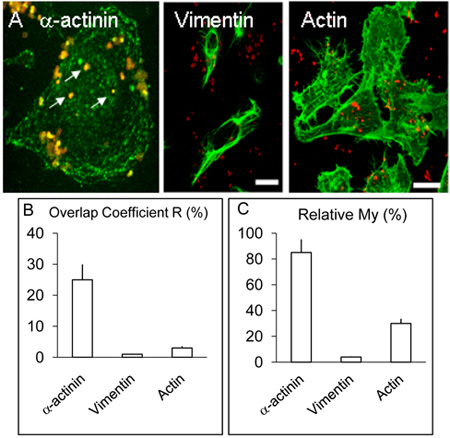
Figure 2. Localisation et distribution des α-actinine, l'actine et la vimentine dans les cellules HBMEC.
Monocouches A. infectée de HBMEC ont été traités comme décrit dans la légende ci-dessus mais en plus de α-actinine, quelques lamelles ont été utilisés pour la détection de l'actine ou la vimentine par procédure similaire à celle de α-actinine. Comme ci-dessus, α-actinine concentrées autour de plusieurs bactéries intériorisées (flèches blanches). Vimentine et l'actine n'a pas colocalise avec des bactéries à un niveau appréciable. Barre représente 20 um.
B. & C. Les valeurs des coefficients R et My ont été obtenus à partir de plus de trois expériences en utilisant le logiciel Volocity comme décrit précédemment.
Discussion
La possibilité de lier des intériorisé Opc exprimant Neisseria meningitidis aux α-actinine a été explorée à l'aide HBMEC par l'examen de la co-localisation de bactéries et de la protéine du cytosquelette dans les cellules infectées après 3 et 8 h d'incubation. Par microscopie confocale, co-localisation de Neisseria meningitidis avec α-actinine a pu être démontrée. Notamment, bien que les bactéries ont été intériorisées à 3 h, il y avait co-localisation peu avec α-actinine à ce point dans le temps. Association bactérienne avec la protéine du cytosquelette semblait exiger une plus longue période de résidence intracellulaire après 8 h période d'infection, un nombre important de bactéries avaient α-actinine, apparemment en étroite association. Alpha-actinine est une protéine multifonctionnelle, et les interactions des bactéries avec l'élément du cytosquelette pourraient avoir une influence significative sur la fonction des cellules cibles, qui est un sujet d'études en cours.
La quantification des co-localisation comme décrit ci-dessus nécessite la préparation des échantillons méticuleux. Une attention particulière devrait être accordée à la fixation des échantillons, le blocage des dilutions époque et d'anticorps. Pour le meilleur rapport signal sur bruit, chaque anticorps primaire et secondaire doit être augmentée par des expériences préliminaires pour déterminer les concentrations optimales. Dans notre expérience, le milieu de montage Mowiol produit de meilleures images.
Déclarations de divulgation
Remerciements
Les études ont été financées par le Wellcome Trust et la méningite Royaume-Uni. Lignée cellulaire HBMEC a été fourni par le Dr KS Kim. Imagerie confocale et la microscopie électronique ont été effectuées dans l'installation de bio-imagerie Wolfson, Université de Bristol. Nous tenons également à remercier M. Alan Leard, le Dr Mark Jepson (Université de Bristol), et M. Alan Tilley (PerkinElmer) pour leur aide et leurs conseils.
matériels
1. Microscopie confocale à balayage laser (CLSM):
Leica SP5 imagerie confocale système: Ce système, en utilisant une combinaison de AOTF (acousto-optique filtre accordable) et une AOBS (acousto-optique séparatrice), simplifie l'excitation avec des longueurs d'onde spécifiques.
2-logiciel:
Leica confocale logiciels LCS, Leica Microsystems, en Allemagne.
Volocity 5, Improvisation, PerkinElmer, USA.
Références
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon