Method Article
Adultes et embryonnaires Culture squelettique Microexplant musculaire et isolement de cellules souches du muscle squelettique
Dans cet article
Résumé
La technique de micro-disséqués explants est une méthode robuste et fiable pour isoler proliférative des cellules musculaires squelettiques de juvéniles, adultes ou embryonnaires muscles comme source de cellules souches du muscle squelettique. Uniquement, ces cellules ont été tirés par clonage pour produire des lignes squelettiques musculaires cellules souches utilisées pour la transplantation in vivo.
Résumé
Culture embryonnaire et adulte des cellules musculaires squelettiques ont un nombre d'utilisations différentes. La technique de micro-disséqués explants décrits dans ce chapitre est une méthode robuste et fiable pour isoler un nombre relativement important de prolifération des cellules musculaires squelettiques de juvéniles, adultes ou embryonnaires muscles comme source de cellules souches du muscle squelettique. Les auteurs ont utilisé des micro-disséqués cultures d'explants d'analyser les caractéristiques de croissance des cellules musculaires squelettiques dans les muscles de type sauvage et dystrophiques. Chacune des composantes de la croissance des tissus, la survie à savoir, la prolifération, la sénescence et de différenciation peuvent être analysés séparément en utilisant les méthodes décrites ici. L'effet net de toutes les composantes de la croissance peut être établi par des moyens de mesurer les taux d'excroissance explant. La méthode de micro-explant peut être utilisé pour établir des cultures primaires d'un large éventail de types de muscles et d'âges différents et, comme décrit ici, a été adapté par les auteurs pour permettre l'isolement des embryons précurseurs du muscle squelettique.
Unique, la micro-explant cultures ont été utilisées pour calculer clonale (origine unicellulaire) du squelette des cellules souches musculaires (SMSC) lignes qui peut être étendu et utilisé pour la transplantation in vivo. En SMSc vivo transplantés se comporter comme fonctionnel, tissu-spécifique, les cellules satellites qui contribuent à la régénération des fibres musculaires squelettiques, mais qui sont également conservées (dans la niche de cellules satellites) comme un petit pool de cellules souches indifférenciées qui peuvent être ré-isolé en culture en utilisant la méthode des micro-explant.
Protocole
Deux approches peuvent être utilisées pour isoler proliférative des cellules musculaires squelettiques. Dans les tissus musculaires premiers sont digérés enzymatiquement pour isoler des cellules individuelles avant le placage sur 1. La seconde méthode consiste à explant des morceaux de tissu musculaire dans la culture pour permettre aux cellules de croître au cours d'incubation 2, 3. La deuxième méthode est décrite dans ce protocole. La culture de tissus a lui-même ses racines dans la culture des explants. L'année 2007 a été le 100e anniversaire des expériences classiques de Harrison dans lequel il a obtenu des excroissances neurone en incubant explants nerveuses dans des gouttes pendantes de la lymphe 4. Les techniques de culture des explants ont été utilisés et raffinée dans une variété de contextes différents dans les 100 années qui ont suivi comme un moyen de générer des proliférative des cultures primaires de cellules embryonnaires adultes et 4, 5. Le principe derrière la technique explant, cependant, reste le même; afin de minimiser le traumatisme de l'isolement de cellules primaires par le maintien de la structure en trois dimensions du tissu parent pendant les étapes cruciales du prolongement cellulaire tout en fournissant les cellules l'étroit avec un rich media nutritifs dans lequel prolifèrent. Dans le muscle squelettique est un avantage supplémentaire à l'utilisation de la culture explant parce que l'acte de la découpe du tissu musculaire imite un traumatisme de la fibre musculaire, le déclenchement d'habitude pour l'activation des cellules satellites, la migration et la prolifération de 3, 6. Adulte cellules satellites du muscle squelettique (également appelées myoblastes) sont la population la tige prolifératives cellulaires responsables de la réparation des fibres musculaires et une croissance de 7.
Explants muscle squelettique ainsi imiter l'environnement in vivo du muscle régénérer et stimuler la migration des cellules souches et la division. Dans l'embryon, la majorité des muscles squelettiques des vertébrés (les muscles du tronc et des membres) provient des somites, bien somitomères et arcs branchiaux donner lieu à la musculature de la tête 8, 9. Le myotome peuvent être identifiés comme deux groupes distincts de Myf-5 cellules souches exprimant situés dans les bords dorsal, médiale et latérale du somite différencier, respectivement. Respectivement, ces cellules génèrent des muscles epaxial du dos, qui se différencient in situ, et la musculature ventrale et latérale hypaxial (membres, l'abdomen et des muscles respiratoires) qui nécessitent la migration des cellules souches musculaires de l'somite 10. La migration des cellules embryonnaires souches musculaires est sous le contrôle de la Pax 3 11. Myf-5 expression est essentielle à l'établissement de la musculature embryonnaire et cette importance persiste aux muscles postnatale, où plus de 98% des cellules satellites activées expriment Myf-5 12. Myf-5 est donc un marqueur fiable et précis de la population proliférante de cellules souches du muscle squelettique dans les tissus adultes ou embryonnaires. Embryonnaire des cellules souches musculaires (aussi appelée progéniteurs des cellules musculaires, les précurseurs du muscle squelettique, les myoblastes ou cellules satellites, même embryonnaires) peuvent être isolés à partir des somites des embryons de souris, le poulet et la grenouille au stade précoce 13. Afin d'isoler les cultures myogénique des muscles squelettiques des embryons âgés embryons, les auteurs ont adapté la technique d'explant microdisséquées tissus embryonnaires. Une approche similaire est utilisée par Cossu et al. 14 à générer des populations de cellules clonales de l'embryon somite 14.
1. Culture cellulaire in vitro des cellules souches du muscle squelettique (SMSC)
SMSc sont des lignées cellulaires d'origine cellule unique qui ont été clonale provenant primaires du squelette des cultures d'explants musculaire. Ils peuvent être cultivés en utilisant la méthodologie standard de culture de tissus si des soins suffisants sont prises. Notez que, sauf indication contraire, toutes les manipulations décrites sont réalisées sous des conditions aseptiques à l'aide d'une hotte à flux laminaire (classe 1 ou 2 du cabinet stérile) et tous les réactifs de culture sont chauffés à 37 ° C dans un bain d'eau avant utilisation.
- Pour apporter SMSc du stockage d'azote liquide (voir la section 1.2 pour la congélation méthode descendante) cryotubes doivent être décongelés rapidement et le contenu transféré dans 5 ml préchauffée (37 ° C) milieu de culture pour la centrifugation immédiate DF10 (1000 g pendant 3 min) pour enlever le DMSO . La meilleure méthode pour décongeler les cellules se fait au moyen de pipetage répétition de petites quantités de milieu de culture pré-chauffé dans le flacon avant de les transférer sur le tube de la centrifugeuse. Le processus de cellules de décongélation devrait être réalisée très rapidement, puisque les cellules cryoconservées contiennent 10% de DMSO qui est toxique pour les cellules à température ambiante (DL50 environ 2 min).
- Après centrifugation le surnageant est éliminé et les cellules sont lavées par remise en suspension le culot cellulaire dans un nouveau 5 ml DF10, puis centrifuger comme avant.
- Le culot cellulaire est ensuite mélangé pour la deuxième fois avec 5 ml de DF10 et la suspension cellulaire obtenue est transférée à un petit 25 cm 2 de culture en plastique avonsSSEL.
- Les cultures sont maintenues à 37 ° C dans un incubateur humidifié contenant 5% de CO 2 dans l'air. Sauf si les bateaux sont utilisés avec un bouchon filtré, le bouchon de la fiole doit être légèrement desserré pendant plusieurs heures pour permettre à l'air dans le récipient de culture à s'équilibrer avec l'incubateur et acidifier le milieu de culture. pH du milieu est contrôlé au moyen d'incorporer un indicateur rouge de phénol pH du colorant dans le milieu de culture.
- Les cellules décongelées doivent toujours être surveillés 24 h après le placage et re-nourris avec des produits frais DF10 à moyen et à garantir l'élimination des débris cellulaires et les toxines résiduelles (voir notes 1 et 2).
1.1. Subculture
Pour établir les lignes SMSC, lorsque les cellules atteignent environ 95% de confluence, ils devraient être retirés de leur récipient de culture, diluée et placée dans une cuve de frais afin de permettre une nouvelle croissance. Cette procédure subculture peut être réalisé au moyen d'un certain nombre de différentes procédures enzymatiques, la trypsine / EDTA étant les plus fréquemment utilisés (voir note 3). Il est habituel (et bonnes) pratiques pour cultiver des cellules à des densités qui les obligent à être repiqué sur la troisième journée de la croissance. Pour la plupart des lignées cellulaires SMS cela peut être réalisé par des cellules fractionnement 1 / 10 à chaque sous-culture. Cela permet un suivi attentif des cellules et permet à ceux effectuant la culture tissulaire pour identifier immédiatement le comportement de croissance inhabituelles (par exemple une croissance plus rapide) qui pourrait indiquer des changements phénotypiques de la lignée cellulaire comme la transformation ou la réduction de l'apoptose provoquée par l'adaptation aux conditions de culture. De plus, une routine de repiquage cohérente et prudente réduit considérablement l'incidence de tels événements.
- Pour la sous-culture en utilisant la trypsine (trypsinisation) les navires sont retirés de l'incubateur et leur support mis au rebut par l'aspiration.
- Les cellules sont ensuite lavées deux fois avec stériles en calcium et en magnésium sans tampon phosphate salin (PBS), 10 ml par lavage, enlevé à chaque fois par l'aspiration.
- Pour dissocier la monocouche cellulaire (25 mm 2 flacon) 1 mL 1 trypsine / EDTA est ajouté et laissé sur les cellules à température ambiante pendant 2 3 min jusqu'à ce que les cellules commencent à se détacher (voir note 4). Ceci peut être vu par les utilisateurs expérimentés que des petits trous formant dans la monocouche légèrement opaque lorsque le ballon est tenu à la lumière (voir note 5). Alors que les cellules doivent être trypsinées suffisamment de temps pour assurer une suspension cellulaire unique, il faut prendre soin à ne pas surexposer SMSC vers trypsinisation depuis cela se traduira par des niveaux élevés de mort cellulaire et une mauvaise prise lorsque les cellules sont re-plaqué.
- Pour arrêter la réaction de la trypsine, milieu contenant du sérum (DF10) est ajoutée à un minimum de 2 volumes (soit le double du volume de la solution de trypsine). Lorsque repiquage de 25 mm 2 flacon il est commode d'ajouter 9 ml DF10 à ce stade. Un split 1 / 10 de cellules peuvent ensuite être facilement réalisée en diluant 1 ml de la suspension cellulaire obtenue dans un flacon de culture nouveaux 25 mm 2 avec une autre 9 mL de milieu de DF10 frais. Les cellules restantes peuvent être utilisées pour l'expansion des cellules (transfert à un plus grand navire), cryopréservés (voir section 1.2) ou comptées et plaqués dans des plats expérimentaux, des puits ou des plaques pour les tests de prolifération et la survie, la différenciation, le traitement du facteur de croissance ou d'autres fins (voir ci-dessous).
1.2. La cryoconservation des lignées cellulaires et des cultures primaires
- Pour les cellules cryoconservation sont dissociées de leur sous-culture monocouche pour (section 3.1.1) et en culot par centrifugation (3 min à 1000 g).
- Le surnageant est éliminé par aspiration et les cellules sont soigneusement et rapidement remis en suspension dans 10 ml de gel de Down Mix (10% de DMSO dans le DF10) avant qu'ils ne soient à nouveau en culot par centrifugation.
- Cette fois le culot est remis en suspension dans le gel suffisamment bas pour permettre à mélanger 0,5 mL de suspension cellulaire par cryovial (voir tableau 1) et immédiatement placés dans 80 ° C pendant la nuit.
- Cryotubes sont transférés à l'azote liquide le lendemain pour stockage à long terme (voir note 6). Comme avec le dégel des cellules, ce processus de cryopréservation doivent être effectuées rapidement. Alors que le DMSO est protecteur pour les membranes cellulaires lors de la congélation, il est très toxique pour les cellules à non températures glaciales.
1.3. Déterminer le nombre de cellules
- Pour déterminer la concentration cellulaire d'une suspension cellulaire unique (sous-culture suivante) un hémocytomètre Neubauer peuvent être utilisés. Pour assurer la précision de comptage la lamelle doit être solidement fixé sur la base hémocytomètre (voir note 7).
- Une petite goutte de suspension cellulaire est ensuite placé à proximité du bord de la lamelle et sera repris par capillarité.
- Les cellules sont ensuite comptées à l'aide d'un microscope inversé à contraste de phase avec l'illumination. Pour augmenter la précision de la concentration cellulaire finale, le caunes dans la chambre de comptage doivent pas se chevaucher, si elles ne la suspension de cellules d'origine doivent être dilués et les cellules recomptés. Agglomérante devrait être évité par une dissociation complète des cellules pendant trypsinisation et 100-200 cellules sur une surface connue doivent être comptées pour obtenir une estimation précise du nombre de cellules. Une méthode pratique utilisant la hémocytomètre Neubauer est de compter les cellules dans deux ou plusieurs ensembles de 16 carrés. La densité des cellules par millilitre est alors obtenue en divisant le total par le nombre de jeux comptés (par exemple 2) et en multipliant par 10 4. Par exemple, 100 cellules comptées plus de 2 x 16 sets carrés = 100 / 2 = 5 x 10 5 cellules / ml.
2. L'établissement primaire squelettique cultures Microexplant Muscle
Primaire micro-explant culture peut être utilisée pour isoler SMSc de toute musculaires squelettiques accessibles, y compris les muscles individuels des membres antérieurs et postérieurs, le diaphragme, muscles dorsaux et abdominaux. La méthode de dérivation des cultures microexplant des muscles juvéniles et adultes est décrite en détail par Smith et Schofield 3 et a ensuite été largement utilisée pour dériver des cellules SMS de juvéniles, les muscles de souris adultes et personnes âgées. La méthode peut également être utilisée pour dériver des cellules cultivées de muscle squelettique de poissons 24 et le muscle squelettique humain (Rao et Smith, inédit). Excroissance du SMSc à partir d'un microexplant musculaires de souris est illustré dans la figure 1a, b. La méthode a été modifiée pour l'isolement des cellules embryonnaires précurseurs du muscle (voir Section 3). La méthode de base est la suivante:
- Dissection aseptique de muscle cible (s) à partir d'une souris fraîchement abattus est réalisé en utilisant des instruments stériles, une zone de travail propre et de l'utilisation libérale de la pulvérisation d'éthanol à 70%.
- Muscles isolés sont lavés par deux changements de DF20 moyennes et sont placés dans un milieu de DF20 frais dans un plat de 60 mm 2. L'utilisation d'un microscope à dissection stéréo muscles sont soigneusement microdisséquées dans des conditions stériles afin d'exclure la graisse, le tissu conjonctif et des os.
- Morceaux de muscle nettoyés sont ensuite coupés en cubes de 3 400 um, qui, en utilisant une pince bijoutier s, sont placés individuellement dans le centre de 60 puits d'une plaque de 96 puits contenant 50 ul DF20 (voir note 8). Les puits sont vérifiés sous le microscope et placés dans l'incubateur. Le puits extérieurs sont remplis de solution saline pour éviter le dessèchement des puits contenant des explants (3).
- L'attachement et l'excroissance Microexplant est marqué après 24-48 h d'incubation et ensuite à intervalles de 48 à 72 h (en fonction du taux de croissance des muscles étant cultivées).
- Pour l'extension et l'isolement des cellules SMS, les cultures prolongement devrait être suivi individuellement pour les cellules avec une morphologie prédominante SMSC, les cellules mononucléées soit sphérique avec réfractivité élevée qui poussent en grappes agrégation (voir Figure 3.1b).
- Une fois excroissance explant est établi puits individuels sont nourris (voir note 9) par l'ajout de tranches de 50 pi de milieu lorsque le milieu s'acidifie en raison de la densité cellulaire accrue. Lorsque le bien est pleine et de culture de cellules confluentes près, les puits sont alimentés par le remplacement de 50% de la moyenne à chaque fois pour assurer le maintien de «conditionnement» des facteurs sécrétés par les cellules (voir les commentaires sur le milieu conditionné sous clonage; section 2.1). Pour supprimer la différenciation, au confluent des excroissances 60-70% explant primaire sont commutés en calcium milieu appauvri en substituant DF20 moyennes pour le calcium appauvri DMEM/F12 (tous les suppléments restent les mêmes) pour l'alimentation des cellules 3.
- Explantation milieu conditionné peut être préparé à partir de cultures à ce stade et stockés pour une utilisation lors de l'expansion et le clonage de SMSc primaire (pour la méthode de clonage, voir la Section 2.1, Figure 1c f). Les cultures sont repiquées en utilisant la méthode dispase (voir section 3.5).
- SMSc clonale dérivée peut être analysé in vivo par injection intramusculaire (figure 3.1 gk) 19.
- Caryotype peut être effectuée sur clonale dérivée lignes SMSc pour confirmer le statut diploïde (voir la Section 2.2, Figure 3.1 l) 25.
- Cette méthode peut être adaptée à la culture des muscles embryonnaires (section 3).
2.1. Dérivation clonale
Cultures primaires myoblastes expiant (figure 1a, b) sont un outil utile et précis pour établir une variété de différents paramètres de croissance de type sauvage et mutant muscles squelettiques. Dérivation clonale, l'isolement d'une lignée cellulaire d'une cellule unique, est une étape essentielle dans l'isolement de cellules souches du muscle squelettique et peut également être utilisé pour sous-cloner les lignes SMSc transfectées avec des constructions ou des ARNi transgènes. Fondée cultures d'explants SMSC et primaires sont fortement dépendantes de la densité et "crash "(détacher de la vaisselle et meurent) si étalées à une densité trop faible de cellules. C'est parce que les facteurs de la libération SMSc solubles qui sont nécessaires pour maintenir la croissance et la survie cellulaire. Afin de simuler une culture à haute densité et la fourniture de ces facteurs lors de la processus de clonage, SMSC sont clonés dans l'auto-milieu conditionné. L'ajout de milieu conditionné a été jugée essentielle pour permettre aux cellules individuelles de proliférer dans un environnement isolé.
- Milieu conditionné est préparé à partir SMSc proliférer en culture pendant 48 h entre 33 et 75% de confluence.
- Les médias dans lequel ces cellules sont cultivées est retiré après 48 h et filtré en utilisant un filtre de 0,2 um seringue, ce qui assure une stérilité du milieu conditionné et supprime toutes les cellules résiduelles et de débris.
- Ce milieu conditionné est mélangé dans un rapport 1:1 avec un milieu de culture frais (moyenne de clonage, voir note 10) et est utilisé comme les milieux de culture pour le clonage de cellules simples.
- Pour réaliser des dilutions de cellules simples cellules sont dissociées d'une suspension cellulaire unique par trypsinisation attention (établi SMSC) ou le traitement dispase (cultures d'explants primaires) et diluée à une concentration d'une cellule par 100 uL moyenne de clonage.
- 50 ul de cette suspension cellulaire peut alors être étalées dans chacun des 60 centres puits d'une plaque de 96 puits.
- Les cellules sont autorisés à joindre en incubation à 37 ° C dans 5% de CO 2 pendant 6 h et chaque puits est ensuite soigneusement marqué pour la présence de cellules. Les puits contenant 0 ou plus d'une cellule sont actualisés à ce stade.
- Les puits contenant une seule cellule ci-joints sont soigneusement notées et la colonie dérivée de cette cellule unique est soigneusement contrôlée (tous les jours pendant les premiers jours) pour s'assurer qu'une seule colonie, dérivée d'une cellule unique, est présent. Les lignées cellulaires ont été uniquement dérivés de puits contenant une cellule. Figure 1c-e illustre l'expansion d'une telle colonie seule cellule dérivée.
- Une fois la colonie atteint la confluence de la plaque de 96 puits peut être repiquées dans un puits d'une plaque de 48 puits.
- Les lignées de cellules clonées peut ensuite être soigneusement étendu à 24 - et de plaques de 6 puits jusqu'au suffisamment de cellules sont disponibles à l'assiette dans un flacon de 25 cm 2.
- L'origine du muscle squelettique de ces cultures peut être démontrée par l'expression de Myf-5 (Figure 1f) ou d'autres muscles squelettiques des marqueurs spécifiques tels que MyoD et Pax 7.
- A ce stade, les lignes sont congelées avant d'expansion (voir tableau 1).
2.2. Caryotype
Caryotype est une méthode importante du phénotype de cellules de contrôle. Les lignées cellulaires dérivées par dérivation clonale doit être caryotype pour s'assurer qu'ils ont conservé un complément chromosomique diploïde, sans brute réarrangements chromosomiques qui pourraient affecter leur phénotype.
- Pour les cellules sont cultivées à caryotype phase exponentielle tardive (80 confluentes%) dans 25 cm de vaisseaux de la culture 2 (2 jours après repiquage) pour maximiser la proportion de cellules en mitose dans la culture.
- Vingt-quatre heures avant le caryotype des cellules sont nourries avec 10 ml milieu de culture frais. 0,2 ml de 10 mg / ml de colchicine (voir note 11) est alors ajouté aux cellules qui sont incubés pendant encore 1 h à 37 ° C.
- Après 1 h, les cellules sont soumises à la procédure standard de subculture trypsinisation sauf que les deux du milieu de culture et des lavages PBS sont conservés afin de maximiser le nombre de cellules en mitose récoltés.
- Les cellules dissociées, conservé moyennes et des lavages PBS sont filées à 1000 g pendant 3 min pour culotter les cellules et le surnageant enlevé et jeté dans l'eau de Javel.
- Le culot cellulaire est ensuite remis en suspension dans 5 ml de chlorure de potassium 0,0075 M pour exactement 4 minutes, avant que les cellules sont de nouveau en culot par centrifugation.
- La plupart du surnageant est aspiré, laissant une petite quantité (~ 50 à 100 ul) dans le tube pour la remise en suspension. Resuspendre les cellules en feuilletant la base du tube falcon jusqu'à une suspension de cellules est atteint. Les cellules sont ensuite placés sur la glace et fixé dans fraîchement glacée fixateur (méthanol: acide acétique glacial dans un rapport 3:1) comme suit: 10 ml de fixateur est lentement ajouté goutte à goutte sur les cellules en utilisant un petit verre de pipette Pasteur ( Cela empêche l'agglutination des cellules).
- Les cellules sont placées sur la glace pendant 30 min puis sédimentées par centrifugation, après quoi le culot cellulaire est remis en suspension dans 0,5 ml fixateur frais.
- Les diapositives sont produites par la chute de la suspension cellulaire fixée sur des lames préparées (voir Section 3.2.2.1) qui s'est tenue à un angle de 45 °. Pour assurer le bien-espacés métaphase répand la pipette devrait être tenue au moins 30 cm au-dessus de la diapositive.
- Pour visualiser les chromosomes, les lames sont colorées pendant 2 min dans de Leishman Stain, dilué avec trois volumes de tampon pH 6,8 Gurr juste avant l'utilisation.
- Les lames sont séchées à température ambiante et monté dans un milieu de DePex montage.
2.2.1. Préparation des lames pour le caryotypage
- Lames de verre (lames de microscope Premium, VWR International, Royaume-Uni) sont préparés pour être utilisés dans le protocole de caryotype en les plaçant la nuit dans un grand (verre) contenant de l'acide sulfurique.
- Les lames sont ensuite placées sous l'eau courante pendant 8 h et sont ensuite conservés dans l'éthanol à 70% le temps nécessaire.
- Avant utilisation, les lames doivent être rincés sous l'eau du robinet pendant 30 minutes supplémentaires et séché à l'air à température ambiante pendant 1-2 h.
3. L'établissement primaire de micro-explant cultures à partir d'embryons
Trois souches de souris ont été utilisés pour valider cette méthode, de type sauvage (C57BL/10) en collaboration avec MDX et CAV3KO (mutants dystrophiques les deux). La souris mdx déficientes en dystrophine née spontanément dans les C57BL/10, cette ligne a été obtenu par le laboratoire Bullfield en 1991 et a depuis été constamment maintenus dans notre colonie consanguine 26. Souris dystrophiques CAV3KO, qui contiennent une mutation dans le gène de la cavéoline-3, ont été élevés sur le fond C57BL/10 depuis 10 générations avant d'être utilisées dans cette étude 27. Chaque ligne de la souris généré un profil robuste reproductibles excroissance, la prolifération et la survie, qui était embryonnaire stade spécifique et différent pour chaque souche. Les protocoles suivants ont été adaptés pour les embryons de Smith et Schofield PN (1994) 3, essentiellement comme dans Merrick 21.
3.1. Collecte d'embryons
- Pour obtenir des embryons mis en scène, les couples sont mis en place comme naturel (1:1) accouplements et les femelles vérifié chaque matin pour les bouchons vaginaux. Le jour de la détection prise, les embryons sont comptés comme jours E 0,5 (12 h après la fécondation).
- Une fois les bouchons vaginaux ont été détectés, les mâles sont enlevés de la cage pour assurer l'exactitude de mise en scène embryonnaire.
- Lorsque le stade embryonnaire désiré est atteint (E11.5 E17.5 d') les mères sont tuées par dislocation cervicale, l'abdomen est rasée, la peau et les zones environnantes sont tamponnées avec de l'alcool 70% et l'utérus est enlevé par une incision horizontale abdominale faite à l'aide d'instruments stériles dissection.
- L'utérus est ensuite lavé une fois dans un milieu de culture primaire explant (PECM) avant d'être placé dans un petit récipient contenant PECM frais avant la dissection.
- E11.5 E17.5 d'embryons sont disséqués de l'utérus en utilisant un microscope à dissection et placés individuellement dans des boîtes de Pétri contenant PECM prêt pour la microdissection détaillées.
3.2. Microdissection Embryon
- Embryons individuels sont encore disséqué pour isoler les zones riches dans le muscle squelettique (voir figure 2a). Hind et des membres antérieurs (hypaxial muscles squelettiques) sont disséquées, ainsi que la partie supérieure et le mur du bas du corps (surtout epaxial muscles squelettiques). Pour ce faire une incision sur toute la longueur du thorax, l'abdomen et le pelvis est créé pour permettre aux organes internes de l'embryon à être enlevé.
- Pour enrichir des embryonnaire des cellules souches musculaires squelettiques (eSMSc), la tête, moelle épinière et tous les organes internes sont ensuite retirés.
- Dans les anciens embryons (E15.5 E17.5-embryons), il est également possible d'enlever la peau et le cartilage / os à nouveau pour accroître la proportion de cellules musculaires dans les cultures.
3.3. Configuration cultures Microexplant Embryon
- Une fois membres antérieurs, postérieurs et supérieurs et les murs du bas du corps ont été disséquées ils sont placés dans PECM frais et autres microdisséquées à produire de petits cubes de tissus de taille égale (~ 0,5 mm 3; figure 2a).
- Ces microexplants sont ensuite mis dans le centre de 60 puits d'une plaque de 96 puits (un explant par puits) contenant 50 pl PECM par puits. Un minimum de 60 puits contenant 1 explant par puits sont établis, par embryon étudié.
- Pour les embryons en culture les 60 centres de puits peut être subdivisé en régions indiquant où l'explant a été dérivé de (Figure 2b). Cette conception permet de 15 puits contenant chacun, respectivement, des membres antérieurs, le mur du haut du corps, des membres postérieurs et inférieurs explants paroi du corps 21.
3.4. Excroissance de surveillance
Excroissance taux est une mesure fiable du taux de croissance des embryons explants muscle squelettique et dans les conditions soigneusement contrôlées décrit ici est hautement reproductible.
- Les explants sont incubés à 37 ° C et 5% de CO 2 pendant 3 semaines et a marqué le 3e jour, 7e, 14e et 21e siècles de culture à l'aide d'un microscope inversé. Les explants sont notés en fonction du niveau de la confluence de cellules dans chaque puits (figure 3a, e).
- Les images photographiques des cultures peuvent être prises, par exemple, en utilisant un appareil photo reflex attaché au microscope et Fuji 100 ASA (couleur) ou Kodak TMAX (noir et blanc) film professionnel (figure 3F).
- Un squelettespécifique du muscle anticorps spécifique pour Myf-5 peut être utilisé pour démontrer l'origine des muscles squelettiques des eSMSc, selon la souche 80 à 95% des cellules isolées en utilisant cette méthode sont Myf-5 positif. D'autres marqueurs tels que MyoD et Pax 7 peut également être utilisé pour démontrer l'origine du muscle squelettique de ces populations cellulaires. Bien que ces cellules contiennent une proportion très élevée des embryons des cellules souches musculaires squelettiques on ne peut pas être pris en charge (surtout pour les jeunes embryons) qu'ils sont tous d'origine du muscle squelettique ou qu'elles sont toutes les cellules souches. Pour isoler purs populations de cellules souches, il est nécessaire de tirer clonale des cultures d'explants primaires comme décrit dans la section 2.1.
3.5. Repiquage des explants embryonnaires primaires
Une fois confluentes, des cultures d'explants affichant les caractéristiques morphologiques de SMSC (figure 3F) peuvent être repiquées comme suit 3, 21:
- Milieu de culture est éliminé des puits sélectionnés, filtrés en utilisant une seringue de 0,2 um Acrodisc R_ filtre et conservés pour une utilisation en tant que milieu conditionné. Le milieu peut être conservé à 4 ° C pendant 1 semaine.
- 100 ul de 01h10 dispase dilué dans PECM est ajouté à chaque puits et les plaques est ensuite retourné à l'étuve à 37 ° C pendant 20 min.
- Une pointe de la pipette est ensuite utilisée pour gratter délicatement les cellules se détachant de la surface du puits.
- La suspension cellulaire est ensuite centrifugée à 1000 g pendant 3 min pour culotter les cellules et le surnageant est enlevé et jeté.
- Les cellules sont remises en suspension dans 200 uL de 1:1 mélange de milieu conditionné et PECM.
- Le mélange cellulaire est transférée à plaques de 48 puits d'expansion.
- Pour l'analyse des cellules in vitro peuvent être étalées à une densité de 5 x 10 3 cellules / cm 2, soit dans plaques de 48 puits (contenant chacun un 9 mm 2 lamelle de verre stériles) ou à 8-bien-lames de verre chambre. Pour les cellules d'analyse de différenciation sont cultivées pendant une nuit au confluent de 50-60% avant qu'elles ne soient transférées dans un milieu de différenciation permissives (voir la section 4 pour plus de détails dans la méthode in vitro) pendant 3 jours, avant la fixation.
4. Analyse in vitro des cellules souches du muscle squelettique et des cultures primaires
4.1. Préparation des cellules
- Dispase repiquées (Section 3.3) des cultures primaires explant embryonnaire sont plaqués en milieu PECM / conditionnées sur des lamelles en plaques de 48 puits à une densité de 3 x 10 3 cellules / cm 2 et autorisés à joindre.
- Pour l'évaluation de l'apoptose et la prolifération des lamelles sont lavées deux fois dans le PBS, fixés dans du paraformaldéhyde 4% (voir section 4.2) dans du PBS pendant 20 min à température ambiante, suivi par un autre 10 min lavez PBS.
- Lamelles préparés de cette façon peuvent être stockés à 4 ° C pendant 1 semaine dans du PBS ou du PBS / glycine.
4.2. Préparation de fixateur Paraformaldéhyde
- Dans une hotte, pèse 4 g de paraformaldéhyde (PFA; Sigma-Aldrich, Royaume-Uni) et ajouter à une bouteille en verre de 100 ml de PBS stérile avec un agitateur magnétique. Un masque et des gants devraient être portés pour se protéger.
- Dans une hotte, la solution est chauffée et continuellement agité sur une plaque chauffante magnétique jusqu'à dissolution de la poudre. Cela prend environ 5-10 minutes à 65 ° C. Des précautions doivent être prises pour éviter que la température s'élève au-dessus de 70 ° C, car il ya un risque d'explosion de la solution à haute température.
4.3. Apoptose et Essai de prolifération
- Lamelles fixes (préparé comme dans la section 4.1) sont colorées avec 10 ug / ml DAPI pendant 3 min.
- Lamelles sont lavées une fois dans du PBS (5 à 10 min) et inversée sur un spot de Vectashield milieu de montage sur une lame de verre 17, 18.
- Les bords de la lamelle sont scellés avec du vernis à ongles (voir note 12).
- Pour le stockage, les lames sont enveloppés dans une feuille et placé à 20 ° C.
- Pour le comptage, les diapositives sont considérés en fluorescence (filtre UV) sur un microscope droit et a marqué pour les cellules apoptotiques et mitotique utilisant un réticule. Vingt grilles distribuées au hasard sont comptés (représentant ~ 1000 cellules), et les cellules sont morphologiquement caractérisé comme non-apoptotiques, apoptotique ou mitose (Figure 3 g).
- Indices mitotiques et apoptotiques sont calculés en proportion du nombre total de cellules.
4.4. L'immunohistochimie
Les cellules fixées sur des lamelles peut également être utilisé pour l'immunohistochimie. Pour la récupération d'antigène en utilisant un autocuiseur lamelles doivent être fermement attachés à des lames de verre en utilisant des clips de papier standard. Immunocoloration peut être utilisé pour identifier les cellules prolifèrent, en utilisant un anticorps Ki67 (1 / 1, 000 de dilution), pour établir l'identité, en utilisant un anticorps pour Myf-cinq (1 / 1 000 de dilution), ou pour enquêter sur l'expression des gènes (voirLa section 4.5). Immunocoloration peut être réalisé en utilisant un certain nombre de méthodes, les éléments suivants (décrits dans (28, 29)) est utilisé couramment par les auteurs:
- Tampon citrate de sodium est préchauffé dans l'autocuiseur. Pour la récupération d'antigène, des diapositives contenant des tissus sectionnés sont placés dans le tampon chauffé et chauffés sous pression pendant 2 min. La pression est obtenue par le verrouillage du couvercle fermement autocuiseur et la mise sur le poids. Une fois le temps de 2 min de récupération s'est écoulé l'autocuiseur est ensuite soigneusement placés sous l'eau froide du robinet pour réduire la pression. Afin d'éviter le tampon bouillante en place, il faut prendre soin de ne pas enlever le couvercle tant que la pression a égalisé à la pression atmosphérique. La pression est suffisamment réduit lorsque le poids peut être enlevé facilement (sans forcer) et le couvercle retiré. Les lames sont ensuite retirés du tampon et lavés à la température ambiante du PBS pendant 10 min.
- Les lames sont pré-bloqués en les immergeant dans 3% d'hydrogène peroxyde / eau du robinet pendant 5 min puis lavées trois fois dans du PBS + 0,05% de Tween 20 (10 min par lavage).
- Le blocage est réalisé par une incubation de 30 min dans un tampon bloquant TNB (fourni dans le kit CST) à température ambiante.
- L'anticorps primaire est dilué dans un tampon de TNB à la dilution appropriée (arrivé à par titrage, voir note 12) et incubées une nuit à 4 ° C (ou bien 1 à 2 h à température ambiante).
- Après trois 10 lavages min dans du PBS + 0,05% de Tween 20, les lames sont incubées pendant 1 h à température ambiante dans l'anticorps appropriés seconde biotinylé dilué dans TNB tampon.
- Après trois lavages encore 10 min dans du PBS + 0,05% de Tween 20, les lames sont incubées pendant 30 min dans streptavidine-HRP (fourni dans le kit TSA) dilué à 1:100 dans un tampon de la TNB et ensuite lavées trois fois (10 min chacun) PBS + Tween 20 0,05%.
- Tyramide biotinyl (réactif d'amplification; TSA Kit) est ensuite ajouté à chaque section pour entre 8 et 15 min (l'heure exacte devrait être obtenue par des expériences d'optimisation).
- Après amplification, laver les lames trois fois (10 minutes chacun) dans du PBS + 0,05% de Tween 20, puis incuber pendant 30 min dans SA-HRP.
- Après trois lavages supplémentaires (10 min chacun) dans du PBS + 0,05% de Tween 20, de visualiser en utilisant 3,3 _-diaminobenzidine tétrachlorhydrate chromogène (DAB) de 5 à 10 min. Puis effectuer deux derniers lavages dans l'eau avant de contre-coloration diapositives dans l'hématoxyline et de lamelles. DAB est un carcinogène connu et doit être manipulée avec soin (comme pour la colchicine, la section 3.2.2).
4.5. Différentiation
- SMSc plaquées sur des lamelles ou des diapositives de chambre (voir note 13) peuvent également être différenciées avant la fixation pour l'analyse des myotubes.
- Pour ces expériences cellules sont étalées à une densité de 10 4 / cm 2 et a permis de fixer pour les 6 à 8 h.
- Les cellules sont ensuite mis dans des conditions de différenciation permissive pour 3 jours (cf. Note 14).
- Milieu de différenciation est composé de DMEM + 0,5% FCS complétée par du sérum de cheval 2% et 1% de glutamine. Ce milieu de culture permissive de différenciation est remplacé à intervalles h 48.
- Lamelles sont ensuite fixées dans du paraformaldéhyde à 4% comme ci-dessus (sections 3.4.1 et 3.4.2).
4.6. La transfection de SMSC: expression de transgènes et constructions shRNAi
Les cellules souches et cultures primaires sont réfractaires à la transfection et avec une majorité de méthodes de transfection dans le taux de SMSC et des cellules primaires de muscle squelettique est très faible (<10%), empêchant l'utilisation de méthodes de transfection transitoire. Pour surmonter ce qu'il a été une pratique courante dans notre laboratoire afin d'isoler les dérivés du transgène cultures clonales transfectées (voir section 3.2.1) suit avec la transfection de phosphate de calcium ou de lipofectamine. Alternativement les cellules peuvent être transfectées en utilisant efficacement l'infection virale de constructions emballé. Figure 1m montre une expression stable de β-galactosidase dans PD50A, un dérivé SMSc clonale isolés sous une infection sélection G418 suivantes avec pIRV, une réplication défectueuse rétrovirus portant les gènes de résistance et d'neo/G418 β-galactosidase (19). Cette lignée cellulaire a été utilisé pour démontrer que formellement SMSc se comporter comme des cellules souches fonctionnelles in vivo (voir Figure 3.1). Alors que la génération d'une lignée cellulaire clonale stable exprimant un gène marqueur est souhaitable pour des expériences de transplantation de cellules souches in vivo, c'est une méthode fastidieuse et peu satisfaisant de l'analyse de la fonction des gènes in vitro. Pour ces raisons, les auteurs ont développé récemment une modification optimisée de la Lipofectamine 2000 réactif de transfection qui est capable de fournir des taux de transfection de 60 à 70%. Cela permet l'analyse de la fonction des gènes en utilisant la transfection transitoire de transgènes ou ARNi constructions dans SMSc ou des cultures d'explants primaires (figure 3h, i). Les auteurs utilisent une courte épingle ARNi vecteur (pSHAG ARNi) (30) pour générer des constructions shRNAi capable de gènes spécifiques ciblant l'expression d'ARNm de SMSC. Le succès de la technique shRNAi dépend de deux éléments: (a) une méthode de transfection efficace et (b) la conception d'une séquence en épingle à cheveux courts qui reconnaît spécifiquement le gène cible. Un shRNAi construire dirigé vers eGFP peut être utilisée pour valider la méthode knockdown ARNi (figure 3j, m).
4.7. Optimisation du Protocole de transfection LipofectamineTM 2000 pour SMSc
- Les cellules sont étalées à 5 à 10 4 cellules / cm 2 dans la chambre diapositives dans 250 uL DF10 milieu de culture et cultivées pendant 18 h pour atteindre la confluence de 95% (confluence optimale pour chaque lignée cellulaire a été établie par l'évaluation des taux de transfection à des densités différentes).
- Pour chaque puits, 0,5 ug d'ADN (vecteurs shRNAi, transgènes) est ajouté à 33 ul de DMEM sans sérum supplémenté avec 2 mM de glutamine et mélangés doucement dans un tube stérile Eppendorf.
- Pour chaque puits, 1,25 ul de Lipofectamine 2000 est séparément diluée dans un supplémentaire de 33 uL d'un milieu sans sérum DMEM + glutamine, délicatement mélangés et conservés à température ambiante pendant 5 min
- Le mélange de l'ADN et lipofectamine sont ensuite rapidement ajoutés ensemble, mélangés doucement pendant 60 s par pipetage, puis incubés à température ambiante pendant 19 min pour permettre l'ADN Lipofectamine 2000 pour former des complexes.
- Pour la transfection, 66 uL du mélange complexe est ajouté à chaque chambre et les diapositives sont bien bercé pendant 10 s afin d'assurer une répartition égale des complexes.
- Les cellules sont incubées pendant 24 à 72 h à 37 ° C et 5% de CO 2. Selon le construire, l'expression des gènes fonctionnels ou knockdown shRNAi est d'abord détectée entre 8 et 24 h post-transfection.
5. Les résultats représentatifs
Lorsque les explants sont soigneusement explantées du muscle squelettique adulte ou à partir d'embryons explants va commencer à générer des cellules en quelques heures à 72 heures d'incubation à 37 ° C (5% de CO 2 / air) (figure 3A). Le temps pris pour que cela se produise dépend de la source des explants: explants embryonnaires grandissent plus rapidement que les explants adultes âgés muscle squelettique. Dans notre expérience, le moment d'excroissance est hautement reproductible 3, 29. L'expansion de la population cellulaire va se produire sur une période de plusieurs jours (explants d'embryons) ou semaines (âgées explants muscle squelettique) pour générer l'agrégation à haute densité des cultures de cellules primaires de SMS (voir figure 3B-F pour l'illustration de ces cultures). Figures 1 et 3 montrent des résultats représentatifs de la dérivation de succès et la culture du muscle squelettique et explants embryonnaires humaines, la dérivation clonale et in vivo de transplantation du muscle squelettique dérivées des cellules souches adultes, β-galactosidase d'étiquetage, caryotype et de myf-5 immunohistochimie des SMSc embryonnaire pour illustrer l'origine du muscle squelettique . populations de cellules Figure 3 montre un résultat représentatif de notation excroissance (en utilisant Myf-5 immunohistochimie pour visualiser SMSC), la morphologie des cellules musculaires embryonnaires primaires; coloration DAPI pour l'apoptose et le protocole de transfection shRNAi. De plus amples détails peuvent être trouvés dans les légendes des figures relatives à ces deux figures. La figure 2 illustre la procédure à partir d'embryons micro-dissection de générer des populations enrichies embryonnaire des cellules souches musculaires squelettiques.
Tableau 1: Tableau de calcul pour estimer le nombre de cryotubes nécessaires à la viabilité cellulaire maximale en période de gel cellule vers le bas des protocoles
| Plate / Flacon / chambre de diapositives | Volume de milieu de culture | PBS lave | Volume de la trypsine | Nombre de flacons gel des bas (3.1.2) |
| De 96 puits | 50 ul | 2 X 100 uL | 25 uL | N / A |
| 48 puits | 150 pi | 2 X 200 uL | 50 ul | N / A |
| De 24 puits | 500 ul | 2 X 700 uL | 200 uL | N / A |
| 6-même | 3 MLS | 2 X 3 mls | 500 ul | 1 |
| Petite (25 cm 2) | 10 ml | 2 X 10 ml | 1 ml | 2 |
| Medium (80 cm 2) | 10 ml | 2 X 10 ml | 3 MLS | 4 |
| Grand (175 cm 2) | 10 ml | 2 X 10 ml | 5 ml | 8 |
| Chambre ainsi | 500 ul | 2 X 500 ul | 100 uL | N / A |
N / A = non applicable, le nombre de cellules étaient trop faibles pour geler le bas, sauf plusieurs puits ont été congelées ensemble.
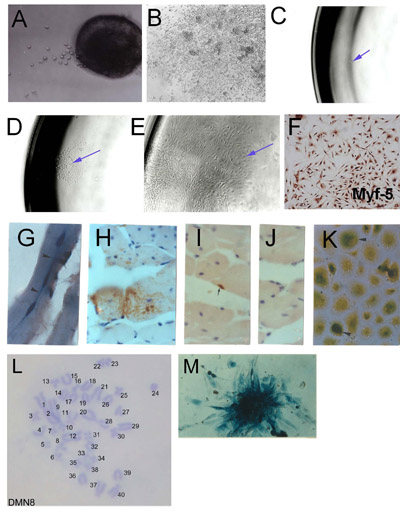
Figure 1. L'isolement des cellules souches du muscle squelettique (SMSC) de microexplants: (A) excroissance précoce de explantés muscle squelettique adulte (jour 2) (B) excroissance explant Fondée montrant cultures agrégées et haute densité cellulaire.. Dérivation clonale de SMSC. (C) une cellule unique isolée dans une plaque de 96 puits. (D) Colonie d'origine cellule unique. (E) Créée population clonale (F). Vérification de l'identité SMSc utilisant Myf-5 immunohistochimie. Les cellules dérivées de SMSc clone PD50A (exprimant β-galactosidase) chez la souris hôte à 3 mois (G) et (HJ) 14 mois après l'injection de cellules de souris en 2000 PD50A muscle jambier antérieur. (G) a récemment fusionné trois (noyaux central ) β-galactosidase des cellules positives (coloration bleue) dans la fibre musculaire (coupe longitudinale). (H) la contribution importante de la β-galactosidase des cellules positives (tache brune, détectés par les anti-β-galactosidase d'anticorps) dans les fibres musculaires (section transversale ). (I) β-galactosidase positives cellules satellites (tache brune, détectés par les anti-β-galactosidase d'anticorps). (J) de contrôle d'anticorps secondaire (pas de coloration). (K) β-galactosidase des cellules positives (coloration bleue) proliférer en culture quand ils sont isolés à partir des muscles injectés hôte 12 mois après l'injection. (L) Caryotype d'une ligne SMSc souris clonale (DMN8) montrant des chromosomes normaux diploïdes complément. (M) Histochemistry montrant β-galactosidase d'expression dans une colonie de cellules PD50A ( Figure 3.1 g, k, reproduite avec la permission de l'AACR presse, Smith et Schofield, 1997).
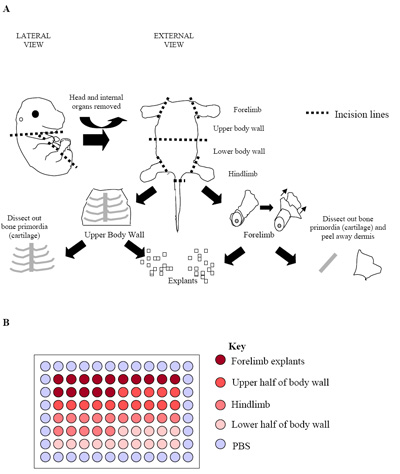
Figure 2. (A) Illustration du processus de dissection embryon. Ce chiffre représente un embryon E15.5 où l'os primordiale (cartilage) pourrait facilement être identifié et disséqué des tissus entourant les muscles squelettiques. A ce stade, et dans des embryons de stade ultérieur (E15.5 E17.5), le derme a également été supprimée afin de maximiser la proportion de cellules du muscle squelettique obtenues. (B) Mise en place de cultures d'explants primaires dans une plaque de 96 puits. Chaque embryon a été utilisé pour produire une plaque comme vu ci-dessus. Pratique habituelle est de la plaque répliques de trois embryons séparés (trois plaques = 180 puits) pour établir les taux excroissance.
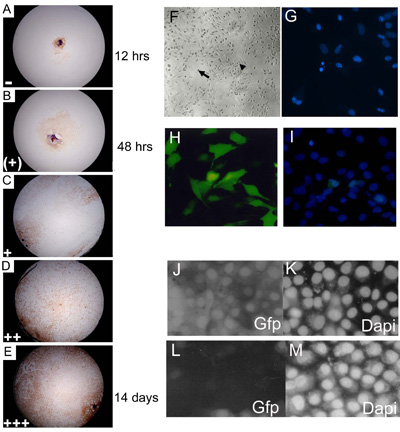
Figure 3. Embryonic cultures d'explants primaires ont été marqués au 3, 7, 14 et 21 jours de culture et affecté un représentant au niveau excroissance du niveau de la confluence. (AE) C57BL10 E15.5 cultures primaires explant embryonnaire colorés avec Myf-5 pour illustrer 0 14% (); 15 24% (+); 25 49% (+); 50 74% 75 100% (++); ( + + +) les niveaux de la confluence. La proportion des puits montrant chaque niveau d'excroissance (chaque jour de cotation) a été multiplié par un nombre arbitraire (= 1; (+) = 2; + = 3; + + = 4 et + + + = 5) avant de rassembler les données pour donner une valeur excroissance finale. Environ 85% de type sauvage (C57BL/10) eSMSc primaires tache pour le marqueur de cellules musculaires squelettiques Myf-5. L'agrandissement est 10. (F) Créée cultures embryonnaires ont les caractéristiques morphologiques des adultes SMSC, les cellules bipolaires (petite flèche) et sphériques cellules monomorphes (grande flèche). (G) l'identification de la fragmentation des noyaux apoptotiques utilisant une coloration DAPI. (HI) Les niveaux élevés (~ 75%) de la transfection d'une construction exprimant la GFP dans des lignées cellulaires de SMS en utilisant la méthode de transfection Lipofectamine optimisé 2000. (I) Comptage du nombre total de cellules est facilité par le DAPI Contre. ARNi utilisant pSHAGshRNAigfp (JM) abolit l'expression de GFP dans les SMSc (voir (29) pour un exemple de cette construction utilisé comme contrôle). (J) Contrôle (transfection maquette) montrant expression de la GFP dans une ligne de GFP SMSC. (K) DAPI de contrôle . (L) shRNAiGfp 24 h après la transfection. (M) pour les cellules de contrôle DAPI shRNAiGfp transfectées dans (L).
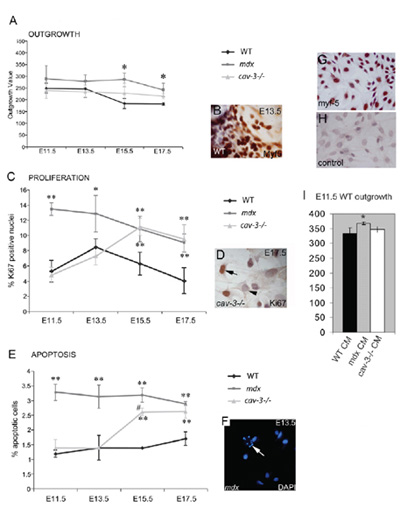
Figure 4. Dystrophique, embryonnaires Myf5 positif myoblastes sont hyperproliferatives et sujettes à l'apoptose. (A) Le taux excroissance de myoblastes embryonnaires à partir de la culture explant musculaire is augmenté tant dans les mutants mdx partir E11.5 et mutants (-/-) CAV-3 à E15.5 E17.5 et lorsqu'on les compare avec des explants WT cultivées en parallèle. (B) Un explant Myf5-immunocolorés. (C) hyperprolifération des myoblastes embryonnaires dans des mutants mdx partir de E11.5 et mutants (-/-) CAV-3 de E15.5, tel que déterminé par Ki67-positives immunoréactivité (D). (E) l'apoptose élevée à partir des embryons E11.5 mdx et à partir des embryons E15.5 (-/-) CAV-3, comme indiqué par coloration DAPI (F); sur la flèche dans F les points d'une cellule apoptotique. * P <0,05 par rapport à WT; ** p <0,01 par rapport à WT; * p <0,05 quand on compare avec mdx CAV-3 (-/-) (G, H) E15.5 cultures primaires de myoblastes embryonnaires avec WT Myf5 coloration. (G) et un contrôle second anticorps (H). (I) Le taux excroissance de explants WT E11.5 augmenté (* p <0,05) dans E11.5 mdx explant milieu conditionné (CM), mais pas en CAV-3 CM (-/-) ou WT. Barres d'erreur indiquent SD Ce chiffre est reproduite sous copyright des auteurs et a d'abord été publié par la Société des biologistes à Merrick et al., 2009.
6. Notes: les étapes critiques et d'éventuelles modifications
- Lorsque les cellules décongelées sont attachés à une densité cellulaire très faible, il est prudent de ne remplacer que la moitié de la moyenne pour empêcher accident de la culture.
- SMSc isolées de muscle dystrophique sont sensibles à l'apoptose et doivent être traités avec un soin particulier. SMSc dystrophique (tels que la lignée cellulaire dfd-13, qui a été établi à partir du muscle squelettique obtenues à partir de 5 semaines, âgé dystrophiques (MDX) chez la souris) doivent être cultivées à des densités cellulaires plus élevés que d'habitude pour les myoblastes. Ces lignées cellulaires d'apoptose sont également sensibles à la cryoconservation des densités plus élevées (voir Sections 1.1 et 1.2) (19).
- Une méthode alternative de prélever des cellules à partir d'un monocouche utilise dispase, qui fournit une méthode plus douce de la dissociation cellulaire, avec l'avantage qu'il peut être effectuée en présence du FCS et du calcium (tous deux présents dans DF10). Dispase peut donc être utilisé pour une sous-culture et de développer des cultures d'explants primaires du squelette musculaire et earlystage clones SMSC (voir les sections 2 et 3).
- Pour les plus grands flacons de la quantité de trypsine / EDTA utilisés doivent être élargis comme suit: 75 mm 2 flacon (3 ml de trypsine) et 175 mm 2 flacon (5 ml de trypsine). De même pour les petites surfaces de réduire la quantité de trypsine utilisée (voir tableau 1).
- Alternativement, la dissociation peut être contrôlée à l'aide d'un microscope inversé, ce qui est recommandé pour les débutants.
- La cryoconservation des lignées de cellules est habituellement effectuée en utilisant une grande confluentes (175 mm 2) récipient en plastique. Entre 7 et 9 cryotubes peuvent être obtenus d'un grand navire tels, selon le profil de survie de la lignée cellulaire étant cryopréservés. Les cultures primaires et des lignées cellulaires nouvellement établies sont souvent très réfractaires à geler les procédures. Pour améliorer la récupération et le succès de gel jusqu'à ces cellules deux approches peuvent être utilisées (séparément ou en combinaison). (A) Le contenu de FCS du gel bas mélange peut être augmenté de 10% (pour un maximum de 50%). (B) Le gel des bas processus peut être ralenti en plaçant cryotubes dans la phase vapeur de N2 pendant 12-24 h avant de transférer les flacons à la phase liquide.
- Un moyen pratique de vérifier l'attachement ferme de la lamelle haemacytometer est de chercher des anneaux de Newton (reflets arc en ciel dans le verre) sur la lamelle ou, alternativement, pour tenir le haemacytometer l'envers sur une main ouverte.
- Une variante de la méthode des explants peuvent être employés à court terme des cultures pour une utilisation dans les tests d'immunohistochimie, la prolifération ou l'apoptose. Explants microdisséquées sont placés sur le verre en utilisant des diapositives chambre 8-même. Une méthode alternative consiste à utiliser 9 mm 2 lamelles placées dans des plaques 24 puits. Dans les deux cas, deux explants sont transférés à chaque puits dans 150 uL moyennes DF20. Alternativement, des cultures primaires peuvent être repiquées par la méthode dispase et étalées sur des lamelles placées dans des plaques 24 puits ou directement dans la chambre diapositives 8-bien.
- Pour l'analyse quantitative des taux d'excroissance d'un minimum de 60 puits contenant 1 explant par puits sont établis, par muscle / souche de souris. Pour établir les paramètres de croissance d'une souche d'au moins trois animaux séparée doit être utilisée. Plaques et des puits individuels ne sont pas nourris tandis excroissance est marqué.
- Pour le clonage établi des lignes SMSc il suffit de cellules en culture unique dans un mélange 1:1 de milieu conditionné et DF10 moyenne. Pour explants primaires, il est nécessaire d'augmenter la teneur du sérum du milieu de culture à 20%.
- La colchicine est hautement toxique et cancérigène connu et doit être manipulé avec soin approprié. Double gantage et de travailler dans les limites d'un plateau désigné est essentielle. Tous les produits jetables (c.-Gilsonconseils) sont placés dans un bécher d'eau de Javel (hypochlorite de sodium à 5%) pendant la nuit avant de les jeter avec de grandes quantités d'eau le jour sui-vantes.
- Nous utilisons actuellement des anticorps primaires spécifiques à Ki67 et Myf-5 chacun à 1 / 1, 000 de dilution. La dilution optimale pour les anticorps primaires doit être établie de manière empirique pour chaque anticorps à utiliser et idéalement aussi pour les différents lots du même anticorps, même s'ils sont obtenus à partir de la même source.
- Diapositives Chambre peut également être utilisé pour ce dosage. Avant de fixer les cellules dans 4% des PFA, le milieu de culture est enlevé et les cellules lavées deux fois avec 37 ◦ C PBS stérile. Les chambres ainsi, le joint et la colle sont enlevés et les lames de verre placé dans un pot de 50 ml en verre contenant Coplin fraîchement préparés paraformaldéhyde 4% à la température ambiante, qui est ensuite bercé sur un agitateur Gyro-Rocker R_ pendant 25 min. Les lames sont ensuite lavées deux fois dans du PBS (température ambiante) et soit utilisé immédiatement ou stocké dans du PBS à 4 ◦ C (à court terme; 1-2 semaines) pour immunohistochimie (IHC) analyse.
- Si la formation de myotubes plus poussée est nécessaire primaires cellules musculaires squelettiques peuvent être différenciées pour un maximum de 8 jours.
Discussion
Cultures d'explants microdisséquées peut être utilisé de façon fiable et reproductible d'isoler des populations de cellules contenant une très forte proportion (~ 85%) des Myf-5 proliférative positifs cellules souches du muscle squelettique (SMSC). Sous les conditions de culture rigoureusement contrôlées décrites ici cultures d'explants primaires peuvent être utilisées pour caractériser les comportements de croissance des souris génétiquement mutant SMSC et peut être utilisé comme un moyen de générer des myotubes détaillée dans l'analyse des processus de différenciation in vitro. Entretenir avec soin et la manipulation de ces cultures permet à long terme de culture et d'expansion. En utilisant les méthodes décrites ici, il est également possible de dériver clonale squelettiques lignes de cellules souches musculaires de cultures d'explants à l'aide d'une dilution seule cellule. Pour parvenir à la prolifération des cellules isolées unique au cours de la procédure de clonage, "milieu conditionné" est utilisé pour imiter l'exigence normale de ces cellules à haute densité de la culture. La méthode est applicable (avec modification) pour l'embryon, les tissus adultes et âgées-adultes et, en plus de la souris peut être utilisée pour isoler les cellules des muscles squelettiques des autres espèces, notamment humains (Rao et Smith, inédit), embryon de poulet et de poisson ( saumon) 24. SMSc clonale dérivée peut être analysé in vivo par injection intramusculaire de transplantation et dans ces conditions injecté SMSc va se combiner avec les myotubes hôte pour former les fibres musculaires hybrides. SMSc intramusculaire injecté ne forment pas des tumeurs et ont été trouvés dans les muscles d'hôte dans la position des cellules satellites plus d'un an après l'injection, ce qui suggère qu'ils sont soumis à un contrôle endogène par les cellules souches satellites niche.These cellule peut être ré-isolé injecté hôtes comme SMSc proliférative plus de 12 mois après l'injection d'hôte 19.
Déclarations de divulgation
Remerciements
Nous remercions Patrick Paddison pour son don du vecteur navette shRNAi. Angela Sloan généré l'image GFP ARNi dans la figure 3. Nous remercions également les organismes de financement suivantes pour leur soutien:
Muscular Dystrophy Campaign numéro de subvention RA2/592/2; ÉTINCELLES numéro de subvention 02BHM04, La Société royale numéro de subvention et le BBSRC 574006.G503/1948./JE numéro de la subvention 6/SAG10077.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Références
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon