Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Sans étiquette In situ de lignification dans les parois des cellules végétales
Dans cet article
Résumé
Une méthode basée sur la microscopie confocale Raman est présenté qui offre sans étiquette de visualisation de la lignine dans les parois des cellules végétales et la comparaison de la lignification dans les différents tissus, d'échantillons ou d'espèces.
Résumé
Réunion de l'énergie demande croissante en toute sécurité et est efficace une urgence planétaire. Par conséquent, la recherche sur la production de biocarburants, qui vise à trouver des solutions rentables et durables est devenue une tâche d'actualité et critique. La biomasse lignocellulosique est en passe de devenir la principale source de biomasse pour la conversion en biocarburants liquides 1-6. Cependant, la réticence de ces matières végétales paroi cellulaire à la dégradation rentable et efficace présente un obstacle majeur pour leur utilisation dans la production de biocarburants et de produits chimiques 4. En particulier, la lignine, un complexe et irrégulière poly-phénylpropanoïde hétéropolymère, devient problématique à l'après-récolte déconstruction de la biomasse lignocellulosique. Par exemple dans la conversion de la biomasse pour les biocarburants, il inhibe la saccharification dans les processus visant à produire des sucres simples pour la fermentation 7. L'utilisation efficace de la biomasse végétale à des fins industrielles est en effet largement tributaire de la mesure dans laquelle la paroi cellulaire végétale est lignifiée. L'élimination de la lignine est un facteur limitant coûteux et 8 et de la lignine est donc devenu une clé de l'amélioration des plantes et de cibler le génie génétique en vue d'améliorer la conversion paroi cellulaire.
Des outils analytiques qui permettent la caractérisation précise rapide de lignification des parois cellulaires des plantes de plus en plus important pour évaluer un grand nombre de populations d'oiseaux nicheurs. Procédures d'extraction pour l'isolement des composants natifs tels que la lignine sont inévitablement destructeur, entraînant chimiques importantes et des modifications structurelles 9-11. Analyse chimique des méthodes in situ sont donc des outils précieux pour la caractérisation de la composition et la structure de matériaux lignocellulosiques. Microscopie Raman est une technique qui s'appuie sur la diffusion inélastique ou Raman de la lumière monochromatique, comme celle d'un laser, lorsque l'évolution de l'énergie des photons laser est liée à des vibrations moléculaires et présente une valeur intrinsèque sans étiquette moléculaire "empreinte digitale" de l'échantillon . Microscopie Raman peut se permettre des mesures non destructives et relativement bon marché avec une préparation minimale de l'échantillon, ce qui donne un aperçu de la composition chimique et la structure moléculaire dans un proche état natif. Imagerie chimique par microscopie confocale Raman a été précédemment utilisé pour la visualisation de la distribution spatiale de la cellulose et la lignine dans les parois cellulaires du bois 12-14. Basé sur ces résultats antérieurs, nous avons récemment adopté cette méthode pour comparer la lignification de type sauvage et de la lignine déficientes transgéniques Populus trichocarpa (peuplier) tige de bois 15. L'analyse des bandes Raman lignine 16,17 dans la région spectrale entre 1600 et 1700 cm -1, l'intensité du signal de lignine et de localisation ont été cartographiés in situ. Notre approche visualisés différences de teneur en lignine, la localisation et la composition chimique. Plus récemment, nous avons démontré l'imagerie Raman de polymères paroi cellulaire chez Arabidopsis thaliana avec une résolution latérale qui est sous-um 18. Ici, cette méthode est présenté offrant une visualisation de la lignine dans les parois des cellules végétales et la comparaison de la lignification dans les différents tissus, d'échantillons ou d'espèces, sans coloration ou l'étiquetage des tissus.
Protocole
1. Préparation des échantillons
- Montez les échantillons végétaux hydratée, de bois de peuplier, par exemple la tige ou une tige d'Arabidopsis thaliana, dans le microtome.
- Couper de fines sections (typiquement 20 um d'épaisseur) à partir du tissu natif.
- Transfert de la section centrale sur une lame de microscope en verre.
- Faire tremper la section centrale dans D 2 O et couvrir avec une lamelle de verre, qui est scellé sur la lame du microscope pour empêcher l'évaporation de D 2 O. La section centrale est maintenant prêt pour l'imagerie ou il peut être stocké pour une utilisation future.
2. Mesure des échantillons
- Appliquer l'huile d'immersion à l'objectif du microscope et / ou de la lamelle.
- Lieu et sécuriser la lame de microscope sur la scène de balayage piézo-électriques du microscope, avec la lamelle face à l'objectif du microscope.
- Voir l'échantillon à travers la lamelle en utilisant un microscope à haute objectif chiffré d'ouverture d'immersion (100x, NA = 1,40) et de localiser la zone d'échantillon d'intérêt.
- Après avoir éteint toutes les autres sources lumineuses de laboratoire et d'un microscope, la position résolue de mesures sont effectuées par microspectroscopie concentrant passe-bande-filtrée monochromatique vert clair (λ = 532 nm) à partir d'un cw-laser sur l'échantillon avec une puissance typique de 10 à 30 mW ( voir la Figure 1 pour un schéma de l'installation). Autofluorescence peut se produire dans certains échantillons, ce qui peut interdire des mesures utiles, dans laquelle l'excitation cas de la lumière laser de longueur d'onde plus peut être souhaitable.
- L'arrière-lumière diffusée Raman Stokes décalée est collectée par l'objectif du microscope, passe à travers un miroir dichroïque, un trou d'épingle, qui sert de filtre spatial dans la configuration confocale, et un filtre longpass, et se concentre dans la fente d'un réseau spectromètre, où la lumière est dispersée spectralement et détecté par une caméra CCD refroidie, ce qui donne un spectre Raman. Un spectre Raman du bois de peuplier est montré dans la figure 2, avec des bandes de lignine caractéristique dans la région spectrale entre 1600 et 1700 cm -1.
- Pour l'imagerie chimique et la visualisation de la distribution spatiale de lignine, une carte à deux dimensions spectrales est acquis par trame de balayage de l'échantillon à travers la focalisation du laser avec l'étape de balayage piézo-électrique et l'enregistrement d'un spectre Raman pour chaque position de l'échantillon. Cartes en trois dimensions spectrales peuvent être générées par l'empilement de cartes en deux dimensions pour lequel la focalisation du laser a été intensifiée consécutivement le long de la direction z.
3. Analyse des données
- Pour Imagerie chimique et la visualisation de lignine, les données recueillies sont analysées à l'aide de MATLAB (The MathWorks, version 7.7). Les données sont organisées dans un cube en trois dimensions hyperspectrale, qui est composé de deux dimensions spatiales et une troisième dimension spectrale des signaux.
- Pour l'analyse de la lignine, la région spectrale entre 1550 et 1700 cm -1 est considéré (voir figure 2). La répartition spatiale de la lignine est visualisée par l'intégration de l'intensité de 1550 à 1700 cm -1 des spectres de référence corrigée (voir figure 3). Comme une alternative à la correction de base, dérivée seconde spectres peuvent être calculées et les sommets de deuxième dérivés utilisés pour l'analyse.
- Localisation lignine et de la chimie, notamment en matière de coniferaldehyde et des groupements alcool coniférylique, peut encore être analysée en évaluant la surface sous les pics gaussiens équipé des trois bandes trouvé entre 1600 et 1700 cm-1 (voir encart de la figure 2 et Refs 15. - 17).
- La normalisation de l'intensité entre les différentes cartes spectrale est réalisée en utilisant comme référence la hauteur du pic de la bande qui s'étend autour extrinsèques OD 2500 cm -1 dans les spectres de lumière moyenne, qui sont obtenus par la classification des k-means clustering. Cela est essentiel et permet de comparer les intensités du signal entre les différentes mesures de lignine, de tissus, d'échantillons et d'espèces.
4. Les résultats représentatifs
Un spectre Raman représentatives du bois de peuplier tige (Populus angustifolia) est montré dans la figure 2. Bandes de lignine caractéristiques se trouvent dans la région spectrale entre 1600 et 1700 cm -1. À titre d'exemple, la distribution spatiale de la lignine dans un bois de peuplier section est présentée en figure 3. Par rapport à l'image visible, morphologiquement distinctes régions paroi cellulaire devient clairement identifiable en raison de l'intensité du signal lignine différente. Haute intensité du signal lignine est observée dans les coins de cellule (CC) et, un peu moins, dans la lamelle moyenne composé (LMC). Des montants inférieurs, mais non négligeable, de lignine sont observées dans la couche murale S2 des fibres. La variabilité de l'intensité du signal lignine se trouve dans une certaine mesure au sein du CC, la LMC et S2, en particulier de fibre en fibre. La résolution latérale spatiale dans nos mesures est d'environ 300 nm. La qualité des données se prête bien à comparer les lignification entre leséchantillons et de disséquer la lignine de chimie 15.
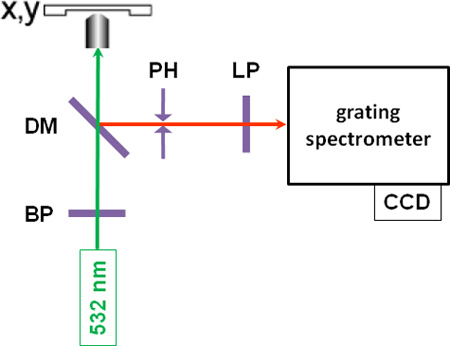
Figure 1: Un schéma de la configuration instrumentale BP:. Filtre passe-bande; DM: miroir dichroïque, PH: sténopé; LP: longpass filtre.
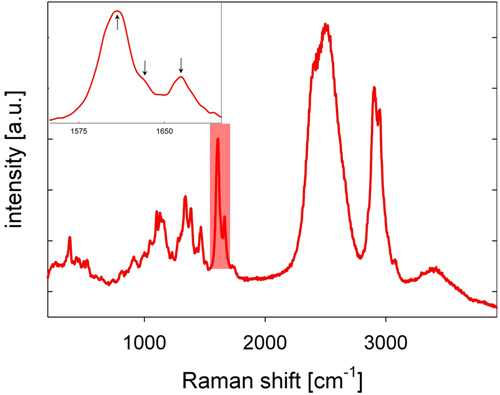
Figure 2: Un spectre Raman représentatives du bois de peuplier tige (Populus angustifolia) enregistrées dans D 2 O. La zone en surbrillance spectrale (voir aussi l'encadré) marque la région spectrale ayant trois sommets spécifiquement attribuables à la lignine.

Figure 3: Raman lignine image (en bas) d'un bois de peuplier de section (en haut: image visible), obtenue en intégrant l'intensité du signal Raman de 1550 à 1700 cm -1.
Discussion
Matières lignocellulosiques sont hiérarchiques et hétérogènes en ce qui concerne à la fois à structure et la composition. Pour un des outils de caractérisation en profondeur d'analyse qui ont une sensibilité chimique, la résolution spatiale, et qui donnent un aperçu de ces matériaux dans le contexte natif sont souhaitables. La méthode décrite permet la visualisation de la lignine et la comparaison de la lignification de la biomasse végétale lignocellulosique avec une résolution spatiale qui est sous...
Déclarations de divulgation
Remerciements
Nous tenons à remercier Andrew Carroll, Bright Chaibang, Purbasha Sarkar (Energy Biosciences Institute, Berkeley), Bahram Parvin (Lawrence Berkeley National Laboratory) et Vincent L. Chiang (North Carolina State University) pour des collaborations fructueuses et des discussions utiles. Ce travail a été soutenu par l'Institut de l'énergie Biosciences. Le travail à la Fonderie Moléculaire a été soutenue par l'Office of Science, Bureau des sciences fondamentales de l'énergie, du Département américain de l'Énergie en vertu du contrat n ° DE-AC02-05CH1123.
matériels
| Name | Company | Catalog Number | Comments |
| microscope slides | |||
| cover slips | |||
| D2O | |||
| nail polish | |||
| immersion oil | |||
| tweezers | |||
| pointed brush | |||
| microtome | |||
| confocal Raman microscope |
Références
- Herrera, S. Bonkers about biofuels. Nat Biotechnol. 24, 755-760 (2006).
- Himmel, M. E. Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science. 315, 804-807 (2007).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54, 559-568 (2008).
- Pauly, M., Keegstra, K. Physiology and metabolism 'Tear down this wall. Curr Opin Plant Biol. 11, 233-235 (2008).
- Ragauskas, A. J. The path forward for biofuels and biomaterials. Science. 311, 484-489 (2006).
- Somerville, C. Biofuels. Curr Biol. 17, R115-R119 (2007).
- Ralph, J., Brunow, G., Boerjan, W. . Lignins in Encyclopedia of Life Sciences. , (2007).
- Chiang, V. L. From rags to riches. Nat Biotechnol. 20, 557-558 (2002).
- Atalla, R. H., Agarwal, U. P. Raman microprobe evidence for lignin orientation in the cell walls of native woody tissue. Science. 227, 636-638 (1985).
- Atalla, R. H., Agarwal, U. P. Recording Raman spectra from plant cell walls. J Raman Spectrosc. 17, 229-231 (1986).
- Fukushima, K. Regulation of syringyl to guaiacyl ratio in lignin biosynthesis. J Plant Res. 114, 499-508 (2001).
- Agarwal, U. P. Raman imaging to investigate ultrastructure and composition of plant cell walls: distribution of lignin and cellulose in black spruce wood (Picea mariana). Planta. 224, 1141-1153 (2006).
- Gierlinger, N., Schwanninger, M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy. Plant Physiol. 140, 1246-1254 (2006).
- Gierlinger, N., Schwanninger, M. The potential of Raman microscopy and Raman imaging in plant research. Spectrosc Int J. 21, 69-89 (2007).
- Schmidt, M. Label-free in situ imaging of lignification in the cell wall of low lignin transgenic Populus trichocarpa. Planta. 230, 589-597 (2009).
- Agarwal, U. P., Argyropoulos, D. S. An Overview of Raman Spectroscopy as Applied to Lignocellulosic Materials. Advances in Lignocellulosics Characterization. , 201-225 (1999).
- Agarwal, U. P., Ralph, S. A. Determination of ethylenic residues in wood and TMP of spruce by FT-Raman spectroscopy. Holzforschung. 62, 667-675 (2008).
- Schmidt, M. Raman imaging of cell wall polymers in Arabidopsis thaliana. Biochem Biophys Res Comm. 395, 521-523 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon