Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Étudier les effets de matrice de rigidité sur la fonction cellulaire en utilisant l'acrylamide basée hydrogels
Dans cet article
Résumé
L'effet de la rigidité des substrats sur la fonction cellulaire peut être modélisé In vitro En utilisant des hydrogels de polyacrylamide de différentes conformités.
Résumé
La rigidité des tissus est un déterminant important de la fonction cellulaire, et des changements dans la rigidité des tissus sont couramment associés à la fibrose, le cancer et les maladies cardiovasculaires 1-11. Des approches traditionnelles de cellules biologiques à l'étude de la fonction cellulaire impliquent la culture de cellules sur un substrat rigide (plats en plastique ou en lamelles de verre) qui ne peuvent pas rendre compte de l'effet d'un ECM élastique ou les variations de la raideur d'ECM entre les tissus. Pour le modèle in vivo les conditions de conformité des tissus in vitro, nous et d'autres utilisent ECM enduits hydrogels. Dans notre laboratoire, les hydrogels sont à base de polyacrylamide qui peut imiter la gamme de tissus conformités vu biologiquement 12. «Réactive» lamelles sont générés par une incubation avec NaOH suivie par l'addition de 3-APTMS. Le glutaraldéhyde est utilisé pour réticuler la 3-APTMS et le gel de polyacrylamide. Une solution d'acrylamide (AC), le bis-acrylamide (Bis-AC) et le persulfate d'ammonium est utilisé pour la polymérisation de l'hydrogel. N-hydroxysuccinimide (NHS) est incorporé dans la solution CA pour réticuler ECM de protéines pour l'hydrogel. Après la polymérisation de l'hydrogel, la surface du gel est recouvert d'une protéine d'ECM de choix tels que la fibronectine, vitronectine, collagène, etc
La rigidité d'un hydrogel peut être déterminé par la rhéologie ou la microscopie à force atomique (AFM) et ajustée en faisant varier le pourcentage de CA et / ou le bis-AC dans la solution 12. De cette manière, la rigidité du substrat peut être adaptée à la rigidité des tissus biologiques qui peuvent également être quantifiés à l'aide de rhéologie ou AFM. Les cellules peuvent ensuite être ensemencées sur ces hydrogels et cultivée en fonction des conditions expérimentales nécessaires. Imagerie des cellules et leur récupération pour l'analyse moléculaire est simple. Pour cet article, nous définissons des substrats souples que ceux ayant modules d'élasticité (E) <3000 Pascal et substrats rigides / tissus comme ceux avec E> 20 000 Pascal.
Protocole
Préparation
- Lamelles doivent être autoclavés.
- Eau distillée stérile ou déminéralisée doit être utilisée pour préparer des solutions et des lamelles à laver.
- AC (40% p / v) et de bis-secteur (1% p / v) solutions sont stérilisées par filtration 0,2 um. Préparer le persulfate d'ammonium à 10% (APS, l'eau 100μg/ml) peu avant l'utilisation et le filtre stérile. Remplacer la solution APS mensuelle.
- Réactifs chimiques tels que 3-APTMS, le chloroforme, glutaradehyde, NHS, et SurfaSil qui ne peuvent pas être autoclavés sont conservés dans une bouteille assigné utilisés uniquement pour la préparation d'hydrogels.
- Pour de meilleurs résultats, les hydrogels devraient être utilisées au sein d'une couple de jours après la nuit d'incubation avec la protéine appropriée ECM.
- Préparer une solution SurfaSil 10% dans le chloroforme (10 ml est généralement suffisant pour 20 lamelles en haut) dans un tube de 50 ml en polypropylène Falcon avant de couler de l'hydrogel. (Notre laboratoire siliconizes habituellement le couvre-dessus lors de l'étape d'incubation glutaraldéhyde 0,5%). Ajouter les lamelles sur le tube de Falcon et de roche pour au moins 10 min. Décanter la solution SurfaSil et l'air sec sur les lamelles Kimwipes dans l'enceinte de sécurité biologique où les hydrogels sera préparé.
- Préparer la solution de BSA inactivée par la chaleur comme suit: a 20 mg / ml, solution d'acides gras libres dans le PBS BSA est incubé dans un bain d'eau à 68 ° C pendant 30 min. La solution est alors filtré stérile et stocké à 4 ° C.
Procédure
- Placez une couche de parafilm sur la moitié inférieure d'un plat de Pétri de 150 mm.
- Placez jusqu'à 9 lamelles de 25 mm sur le dessus du Parafilm et les couvrir avec 1 ml de NaOH 0,1 M. Incuber pendant 3 min, puis aspirer avec une ligne vide.
- Travailler dans une hotte chimique, placer 0,5 ml 3-APTMS sur chaque lamelle. Incuber pendant 3 min, puis aspirer le APTMS. Si vous attendez trop longtemps, une mousse se forme.
- Rincez les lamelles une fois avec 20 ml d'eau désionisée dans le même plat. Retirez les lamelles de l'antenne en utilisant une pince incurvée et de les transférer, avec leur traité côté vers le haut, à un nouveau plat de 150 mm. Lavez les lamelles avec de l'eau déminéralisée à trois reprises, sur la bascule, pendant 10 min à chaque lavage. Si vous n'arrivez pas à supprimer tous les APTMS, il va réagir avec le glutaraldéhyde à l'étape suivante et laissez un précipité blanc laiteux (figure 1).
- Décongeler les glutaraldéhyde (~ 10 min avant utilisation).
- En utilisant des pinces courbes, transférer les lamelles dans un plat propre couches de Parafilm et aspirer tout le liquide restant. Utilisez une ligne vide ou Kimwipe pour éponger l'eau restante, au besoin.
- Couvrir chaque lamelle complètement avec 0,5 ml de glutaraldéhyde à 0,5% dans de l'eau déminéralisée stérile et incuber pendant 30 min dans une hotte chimique. Aspirer le glutaraldéhyde. Rincez et lavez les lamelles comme dans l'étape 4. Sécher les lamelles complètement. [Vous pouvez vous arrêter là et laisser les lamelles pendant plusieurs semaines dans un endroit sec].
- Lorsque vous êtes prêt à préparer les hydrogels, utilisez une pince incurvée pour transférer les lamelles, jusqu'à côté réactif, d'une feuille de Parafilm qui a été enregistré sur la surface de l'enceinte de sécurité biologique. Assurez-vous que les lamelles sont à plat sur la surface Parafilm.
- Préparez une solution saturée du NHS dans le toluène. (Dissoudre une petite quantité de NHS en assez de toluène pendant l'expérience particulière. Continuez à ajouter peu à peu jusqu'à ce NHS le NHS ne se dissout plus. La solution saturée est généralement nuageux et rose.)
- Ensuite, préparer l'acrylamide, le bis-acrylamide, l'eau et l'APS pour atteindre le pourcentage d'acrylamide désiré. Ajouter les réactifs dans des microtubes comme indiqué ci-dessous pour un volume total de 0,8 ml.
- Ensuite, une aliquote à un moment, ajoutez le NHS et TEMED à la solution 0,8 ml AC, vortex brièvement et verser immédiatement 3-5 gels en utilisant 140 ul par lamelle dans la hotte de sécurité biologique. Autant que possible, toutes les étapes de ce point devrait être effectué dans une enceinte de sécurité biologique. [Note: des lamelles de tailles différentes peuvent être utilisées en fonction des besoins. Si 18 mm lamelles sont utilisées, l'utilisation ~ 33 ul solution CA par lamelle et une lamelle de 18 mm supérieure siliconée.]
Bis-AC (%)0,3 (rigide) 0,15 0,06 0,03 (soft) ul ul ul ul Eau 402 522 594 618 AC 150 150 150 150 Bis-AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS 228 228 228 228 - Placer rapidement l'siliconé de 25 mm lamelle sur le dessus de chaque gel avant qu'il ne commence à se polymériser. Ajout de la lamelle supérieure doit permettre à l'AC pour couvrir complètement la lamelle du bas. Incuber ce «sandwich» à température ambiante jusqu'à ce que le CA se polymérise. (Vérifiez la solution résiduelle AC dans le tube à centrifuger pour déterminer quand la polymérisation s'est produite. Généralement que quelques minutes pour les gels rigides et un peu plus long pour les doux suffira.).
- Soigneusement ramasser les sandwichs (gants stériles sur!) Et faites glisser la lamelle supérieure jusqu'à ce qu'elle surplombe le gel polymérisé. Vous pouvez alors le soulever hors gel. Si vous attendez trop longtemps avant d'enlever la lamelle supérieure, le gel va déchirer que la lamelle est retirée.
- Jeter la lamelle supérieure. Placez le fond de gel des lamelles (ci-après appelé l'hydrogel) dans des plaques 6 puits avec 2 ml de PBS / puits. PBS peuvent être ajoutés avant ou après le gel-lamelle à chaque puits. Lavez les hydrogels avec PBS à trois reprises, sur une bascule, à 5 min par lavage.
- Répétez les étapes 11 à 14 jusqu'à ce que le nombre requis d'hydrogels ont été préparés.
- Couvrir chaque hydrogel avec 2 ml d'une solution de fibronectine (3 pg / ml dans le PBS) ou de protéines ECM d'autres (voir Klein et al. 13 pour plus de détails.). La protéine ECM devient liée de manière covalente à l'hydrogel pendant une nuit d'incubation à 4 ° C.
- Aspirer la solution d'ECM et de bloquer NHS n'ayant pas réagi avec 1mg/ml inactivé à la chaleur des acides gras libres dans le sérum de BSA-médias libres pendant au moins 30 min à 37 ° C dans un incubateur de culture cellulaire. Rincez les hydrogels une fois avec du PBS stérile ou de milieu de culture cellulaire.
- Cellules de la plaque dans le milieu de culture approprié contenant FBS. Le nombre de cellules ensemencées sur l'hydrogel doit être déterminée par l'utilisateur basée sur le degré d'étalement cellulaire et la confluence requis pour l'expérimentation. Environ 10 5 cellules est généralement suffisante pour l'analyse western blot et qPCR.
- Après la période d'incubation, les protéines cellulaires ou ARNm peut être extrait. Les lamelles sont soigneusement retirés du puits en utilisant une pince incurvée et placé (cellule vers le bas) sur le dessus de 100 gouttelettes ul de tampon de lyse qui ont été espacées (2-3cm) le long d'une feuille de parafilm sur la paillasse. (Nous utilisons tampon standard de l'échantillon SDS et TRIzol, respectivement, pour préparer des échantillons pour western blot et d'isoler l'ARN pour qPCR). Incuber les cellules avec le tampon de lyse pour exactement une minute. Retirez les lamelles et le transfert du tampon de lyse à un tube à centrifuger. Sinon, pour l'extraction d'ARN seulement, l'utilisateur peut transférer chaque hydrogel pour un nouveau 6-même assiette et ajouter 1ml de TRIzol / puits. Incuber pendant 3 minutes et retirer la solution pour le stockage dans TRIzol un microtube.
Des informations supplémentaires sur les procédures telles que l'immunofluorescence, marquage BrdU, la transfection, etc pour les cellules ensemencées sur des hydrogels est décrite dans Klein et al. 2007 13.
Les résultats représentatifs
Lavage soigneux des lamelles après addition de APTMS est une étape importante dans la production de «réactive» des lamelles. Si on ne parvient pas à retirer le APTMS complètement, il va réagir avec le glutaraldéhyde à l'étape suivante et de produire un précipité blanc laiteux comme on le voit dans la figure 1A. Figure 1B montre une lamelle correctement lavés et séchés. Si le précipité se développe, toute la procédure doit être recommencé depuis le début que la lamelle n'est plus utilisable.
Après la formation d'hydrogel et le revêtement avec des protéines ECM nuit, les cellules peuvent être ensemencées le jour suivant. Comme la figure 2 montre, il ya une nette différence entre les cellules épandage sur des hydrogels raides et douces. Comme peut être vu par coloration phalloïdine dans des fibroblastes de souris embryonnaires (MEF), les cellules réparties à une plus grande mesure sur les raides par rapport aux hydrogels mous. En effet, la plupart des cellules attachant à un hydrogel mou restera compact et attachent moins efficacement.
Bien que la morphologie du MEF est montré dans la figure 2, la différence dans la cellule d'épandage est uniforme à travers plusieurs autres lignées cellulaires testées 11-12,14.
Les secrets du succès
- Une fois la procédure est lancée, il est très important de garder les lamelles avec le «réactif» vers le haut et garder à l'esprit de quel côté a été enduit.
- Les gants doivent être portés à tout moment pendant la procédure d'offrir un environnement de travail qui est aussi stérile que possible.
- La plupart des étapes initiales sont effectuées entre une hotte et la table de laboratoire. Toutes les étapes ultérieuresà éliminer l'excès de glutaraldéhyde les lamelles doivent être exécutées sous une enceinte de sécurité biologique.
- En raison de différences dans la cellule d'étalement (figure 2), nous recommandons l'ensemencement du double du nombre de cellules sur des hydrogels mous par rapport aux hydrogels raide.
- Le procédé de polymérisation AC est extrêmement rapide. Pour les utilisateurs de première fois, on peut diminuer la quantité de l'APS ou TEMED dans la solution de prolonger le processus de polymérisation. Ne pas essayer de préparer plus d'un couvre-rares à la fois.
- Dans les études du cycle cellulaire où la synchronisation dans G0 est nécessaire, nous avons l'habitude de sérum affamer les cellules dans des boîtes de culture en plastique, trypsiniser les cellules et les réensemencer sur les hydrogels de conformités différente en présence de mitogènes (FBS et / ou facteurs de croissance). Cette procédure garantit que la population de départ de G0-synchronisés cellules est identique dans tous les échantillons. Cependant, de nombreuses études de transduction du signal, la période de stimulation mitogène requise ne peut être suffisamment longue pour permettre l'attachement et la propagation des cellules. Dans ce cas, nous sérum affamer les cellules sur les hydrogels et ensuite directement les stimuler avec des mitogènes.

Figure 1A. Mal lavés lamelle. Après ajout de APTMS, lamelle a été lavé pendant 1-2 minutes avant l'addition de la solution de glutaraldéhyde. Un précipité se forme sur la lamelle qui n'a pas été lavés selon les étapes décrites dans la procédure.

Figure 1B. Correctement lavés lamelle. Après l'addition des APTMS, lamelle a été lavé trois fois de 10 minutes chacune, avant addition de la solution de glutaraldéhyde. Aucun précipité se forme sur la lamelle.
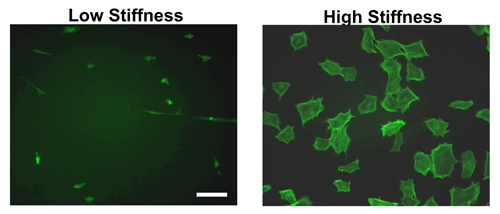
Figure 2. Morphologie des cellules sur des hydrogels de différentes raideurs. Établie FAE ont été ensemencées sur fibronectine revêtement hydrogels de rigidité élevée ou basse pendant 9 heures. Après la période d'incubation, les cellules ont été fixées, perméabilisées et colorées avec FITC-phalloïdine qui se lie à la F-actine. FAE sur des gels présentent une grande rigidité des fibres de stress et sont bien réparties par rapport à celles ensemencées sur les hydrogels faible rigidité. Barre d'échelle = 50 microns.
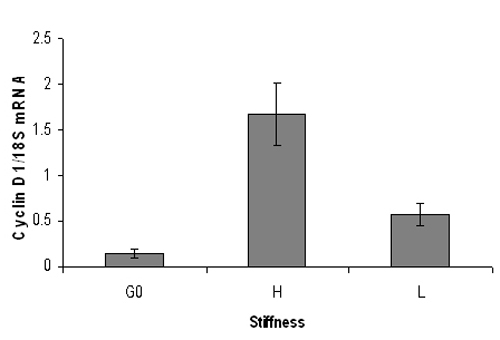
Figure 3. Représentant la PCR quantitative raison des niveaux de la cycline D1 souris ARNm. Sérum fibroblastes de souris affamée embryonnaires ont été plaquées sur élevé (3% d'acrylamide) ou faible rigidité des hydrogels (0,3% d'acrylamide) et stimulées avec du FBS à 10% pour 9 heures. Suite à l'extraction d'ARN, analyse en temps réel de PCR quantitative a été réalisée pour D1 niveaux d'ARNm cycline (normalisée à l'ARN 18S). G0 représente cycline D1 ARNm de cellules quiescentes. Niveaux d'ARNm cycline D1 augmenter de manière significative sur les hydrogels raides mais pas sur des hydrogels mous. Données sont des moyennes + / - SD de réactions PCR en double.
Discussion
Un élément crucial du processus de polymérisation hydrogel est d'éviter la formation de bulles d'air qui permettent aux cellules de se lier à la lamelle de verre plutôt que l'hydrogel ECM revêtement lui-même. Ceci peut être évité en prenant soin de pipetage la solution de polymérisation après vortex et visuellement en s'assurant qu'aucune bulle d'air sont devenus piégés dans le gel. Nous recommandons toujours la préparation supplémentaires "réactive" des lamelles et de...
Déclarations de divulgation
Remerciements
Le travail est notre laboratoire est soutenu par des subventions du National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
Références
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon