Method Article
Visualisation de la réplication d'ADN mitochondrial dans des cellules individuelles par amplification du signal EdU
Dans cet article
Résumé
Nous avons développé une technique sensible à l'étiquette nouvellement synthétisés d'ADN mitochondrial (ADNmt) dans des cellules individuelles, afin d'étudier la biogenèse ADNmt. La technique combine l'incorporation de EdU avec une amplification du signal tyramide (CST) du protocole de visualiser la réplication au sein de l'ADNmt compartiments subcellulaires des neurones.
Résumé
Les mitochondries sont des régulateurs clés de l'énergie cellulaire et la biogenèse mitochondriale est un élément essentiel de régulation de numéros de mitochondries dans les cellules saines 1-3. Une approche pour le suivi biogenèse mitochondriale est de mesurer le taux d'ADN mitochondrial (ADNmt) réplication 4. Nous avons développé une technique sensible à l'étiquette ADNmt nouvellement synthétisés dans des cellules individuelles, afin d'étudier la biogenèse ADNmt. La technique combine l'incorporation de 5-éthynyl-2'-désoxyuridine (EDU) 5-7 avec une amplification du signal tyramide (TSA) 8 du protocole de visualiser la réplication au sein de l'ADNmt compartiments subcellulaires des neurones. Edu est supérieur à d'autres analogues de la thymidine, tels que le 5-bromo-2-désoxyuridine (BrdU), parce que la réaction initiale de cliquer à Edu étiquette 5-7 n'exige pas que le traitement à l'acide ou de dures enzyme digère qui sont nécessaires pour exposer l'épitope BrdU . Le plus doux étiquetage des EdU permet la comparaison directe de son incorporation à d'autres marqueurs cellulaires 9-10. La capacité de visualiser et de quantifier l'ADNmt biogenèse fournit un outil essentiel pour étudier les mécanismes utilisés pour réguler la biogenèse mitochondriale et donnerait un aperçu de la pathogenèse associée à la toxicité des médicaments, du vieillissement, le cancer et les maladies neurodégénératives. Notre technique est applicable pour les neurones sensoriels ainsi que d'autres types cellulaires. L'utilisation de cette technique pour mesurer la biogenèse ADNmt a des implications importantes dans la poursuite de la compréhension de la physiologie normale à la fois cellulaire ainsi que les états pathologiques d'ébriété.
Protocole
1. Préparation de Neurones
- Dorsale racines ganglionnaires (DRG) sont cultivés sur des neurones stérile (autoclavés) 12 lamelles de verre mm dans une plaque de culture 24 bien.
- Le stock de 10 mM d'Edu (dans le DMSO, Cliquez-iT EdU microplaques Assay Kit) est généralement dilué à 1:100 dans un milieu de culture pour obtenir une solution EdU 10X (100 uM) puis dilué 1:10 dans les puits de culture (par exemple 30 ul de la solution EdU 10X en un total de 300 ul de milieu de culture). Neurones DRG sont incubées avec une concentration finale de 10 uM EdU à 37 ° C et 5% de CO 2 entre 2-24 heures. La longueur du temps dépend de la manière dont les traitements affectent le taux de synthèse de l'ADN mitochondrial.
- Dans une hotte, les neurones DRG sont fixés dans du paraformaldéhyde à 2% pendant 10-15 min à température ambiante, lavées deux fois dans du PBS 1X 2-5 minutes à chaque lavage et stockées dans l'eau douce du PBS 1X pour un maximum de 1 mois à 4 ° C.
- Lamelles sont transférées avec une pince à pointe fine à une chambre humide préparée (plat BioAssay Corning avec fond noir pour tapissée revanche, enveloppé dans du papier aluminium pour protéger les composants sensibles de lumière et humidifié avec de l'eau saturée Kimwipes) et placé sur une feuille de parafilm M qui fournit une surface hydrophobe de limiter les solutions à la lamelle. Le protocole ci-dessous est conçu pour les 28 lamelles et les solutions sont préparées pour 32 lamelles (environ un volume supplémentaire de 14%). Solutions avec des composants coûteux ou limitées sont faits de sorte que 75-80 ul sont utilisés sur chaque lamelle. Sinon, 200-300 uL sont utilisés pour des solutions de lavage et de bloquer les laver à fond les solutions précédentes.
- Ré-appliquer PBS 1X pour couvrir la surface de chaque lamelle (200-300 ul). Préparer le dosage Cliquez-it et tyramide kits d'amplification du signal comme décrit ci-dessous et dans les instructions du fabricant.
Préparation de Click-iT EdU microplaques Assay Kit
La plupart des composants du kit Cliquez-iT EdU Assay microplaques sont pré-faites et sont conservés à 4 ° C [2x Cliquez-iT tampon de réaction (composant E 10x), CuSO4 (100 mM, composante F), Cliquez-iT EdU fixateur ( Tampon composant D) et le blocage (Component 2x H)]. Cliquez-iT Additif Tampon Edu (Component 10x G) est stocké à -20 ° C à l'empêcher de tourner jaune-brun avec le temps. Ce composant supporte répétés de gel-dégel.
L'Oregon Green 488 azide (volet B) devrait être divisé en petites portions (10-20 uL) pour minimiser les cycles gel-dégel et conservés à -20 ° C.
Pour préparer une solution stock de conjugué anti-Oregon Green HRP (volet I), ajouter 75 ul de Milli Q dH O 2 dans le flacon. Mélanger doucement par pipetage ou par inversion pour éviter de faire mousser et stocker à 4 ° C. Ne pas vortex.
Préparation de la TSA Kit N ° 12, avec HRP de chèvre anti-lapin IgG et Alexa Fluor 488 Kit tyramide
Pour préparer la solution mère tyramide, dissoudre la matière solide (Alexa Fluor 488 tyramide, le composant A) dans 150 ul de DMSO (composant B). Retournez le flacon à plusieurs reprises pour dissoudre tout revêtement tyramide les côtés du flacon. Solution stock magasin en petites aliquotes (10-20 uL) à ≤ -20 ° C, desséchée et protégé de la lumière.
2. Cliquez-iT 5-éthynyl-2-désoxyuridine (EDU) Étiquetage
REMARQUE: Toutes les solutions sont retirés avec une pipette de transfert ampoule avec une pointe de 200 ul apposée à la fin pour enlever délicatement les liquides sans cellules perdre. Évitez d'utiliser une ligne de vide, ce qui généralement supprimer des solutions trop vigoureusement. Une pipette ampoule est utilisée pour les inondations en douceur avec des lamelles de 200 à 300 uL de solutions de lavage pour laver la solution précédente.
- Les cellules sont perméabilisées avec 0,1% de Triton-X-100 dans du PBS 1X solution pendant 10 minutes à température ambiante dans une chambre couverte et humide. Utilisez 1% de Triton-X-100 solutions de stock.
- Faire 3000 ul de 0,1% de Triton-X-100 en ajoutant 300 ul 1% de Triton-X-100 d'actions à 2700μL PBS 1X.
- Utilisez 75-80 ul par lamelle.
- Retirez le Triton X-100 solution et rincer deux fois avec du PBS 1X.
- Activité peroxydase endogène est arrêtée par 1% de H 2 O 2 dans du PBS 1X solution pendant 30 minutes à température ambiante. Diluer 30% H 2 O 2 solution avec du PBS 1X. Cette solution doit être préparée, mais peuvent être faites pendant l'étape de perméabilisation 10 minutes ci-dessus (étape 3.1).
- Faire 3000 ul de 1% H 2 O 2 par ajout de 100 uL 30% H 2 O 2 à 2900 ul de PBS 1X.
- Utilisez 75-80 ul par lamelle.
- Retirer la solution de peroxydase et rincer deux fois avec du PBS 1X.
- Cliquez-iT Réaction EdU
- Pour 32 lamelles (32 x 80 uL =2560 uL) un total de 2560 uL est nécessaire. La réaction se fait en 2x 1280 ul, qui est la moitié du volume total de la réaction.
- Fraîchement préparer le cocktail Réaction Cliquez-elle avant de commencer le correctif après 5 minutes (étape 3.5 ci-dessous).
- Mélanger le cocktail par aspiration et refoulement. Ne pas vortexer lors de cette réaction.
2 Cocktail de réaction x
Les composants sont de Click-iT EdU microplaques Assay KitLa moitié du volume: 1280 uL Milli Q dH 2 O 1132,8 uL 2x tampon de réaction Cliquez-iT (composant E 10x) 100,3 uL Cliquez-iT Additif Tampon Edu (G Component 10x) 25,6 uL CuSO 4 (100 mm, F Component) 25,6 uL Oregon Green azide (un composant) 6,4 uL Total des 1290,7 uL
REMARQUE: Les volumes utilisés ci-dessus sont proportionnelles aux volumes figurant dans les directions Cliquez-iT microplaques EdU trousse de dosage. Le volume final de réaction Cocktail est un peu plus de 1280 pi. - L'Cliquez-iT 2X réactionnel est dilué avec un volume égal de Click-iT EdU fixateur (composant D) juste avant l'utilisation. Le mélange de ces même fait une solution de réaction uniforme pour toutes les lamelles.
- Ajouter 1290,7 uL Cliquez-iT EdU fixateur (composant D) pour le cocktail 1290,7 réaction ul. Utilisez 75-80 ul par lamelle.
- Post-fixer les neurones avec Click-iT EdU fixateur (composant D) pendant 5 minutes à température ambiante.
- Retirer corriger et d'ajouter un cocktail réaction ci-dessus (étape 3.4). Couvrir pour protéger de la lumière et incuber pendant 25 minutes à température ambiante. Retirez délicatement le cocktail de réaction. Laver deux fois avec diluée tampon de blocage 1X (2X composante H).
- Faire 5200 ul de tampon de blocage 1X en diluant 2600 pi de tampon de blocage (2x composante H) avec un volume égal de MilliQ d H 2 O (2600 ul). Utilisez 75-80 ul par lamelle.
- Sous un microscope épi-fluorescence, vérifiez Oregon Green coloration des noyaux de cellules de contrôle mitotique active.
3. Amplification du signal tyramide (TSA) de Edu Signal
- Ajouter 1% d'une solution à chaque bloc de TSA lamelle et incuber pendant 30 minutes à température ambiante.
- Faire uL d'une solution de 6000 blocs de 1% du CST en pesant 0,06 g de réactif de blocage TSA (TSA n ° 12 de kit, la composante D) et en l'ajoutant à 6000 ul de PBS 1X. Vortex pour mélanger. L'addition de sérum de chèvre 5% dans la solution de bloc TSA 1% sera souvent aider à réduire la liaison non spécifique.
- Centrifuger brièvement l'anti-Oregon Green peroxydase de raifort d'anticorps conjugués des stocks (volet I de l'Assay Cliquez-iT EdU microplaques), préparé 2-24 heures à l'avance de la TSA. Diluer l'anticorps primaire 1:300 dans 1% TSA solution de blocage et inverser ou d'une pipette de haut en bas doucement pour mélanger. Ne pas vortexer pour éviter de perturber l'anticorps HRP-conjugué. Retirer solution à 1% de bloc TSA, ajouter 75 ul de chaque lamelle et incuber une nuit à 4 ° C.
- L'anticorps peut être utilisé plus concentrée, comme 1:150, mais il est fourni en quantités limitées, donc l'utiliser avec parcimonie. Encore une fois, l'ajout de sérum de chèvre 5% dans la solution de bloc TSA 1% sera souvent aider à réduire la liaison non spécifique de l'anticorps anti-peroxydase de raifort Oregon Green conjugués.
- Faire 2560 ul d'une solution d'anticorps 1:300 en ajoutant 8,53 uL du Lapin stock de lutte contre l'Oregon Green-HRP (Cliquez-iT EdU microplaques Assay) pour 2560 uL 1% Blocage TSA. Mélanger à la pipette doux ou inversion.
- Le lendemain, retirez la solution d'anticorps et rincer trois fois avec du PBS 1X. Incuber les lamelles dans le lavage final pour un 30-60 minutes supplémentaires à température ambiante afin d'assurer que les anticorps primaires non liés est enlevé.
- Préparer la réaction tyramide pour 2560 uL (32 x 80 lamelles uL).
- Faire 400 ul d'un 0,15% H 2 O 2 solution (100X) en ajoutant 2 ul de 30% H 2 O 2 (TSA kit n ° 12, Composant F) à 398 uL tampon d'amplification (TSA n ° 12 de kit, composant E) . Cela devrait être fait juste avant nécessaire.
- Pour un volume final de 2560 uL combiner:
- 25,6 tyramide-488 uL (TSA Kit Volet A)
- 2508,8 tampon d'amplification uL (E TSA composant du kit)
- 25,6 uL 0,15% H 2 O 2 (ci-dessus pour une finale de 0,0015% H 2 O 2)
- Retirer du PBS 1X et incuber avec la réaction tyramide pendant 15 minutes à température ambiante.
- Retirez la réaction tyramide et rincer trois fois avec du PBS 1X, l'incubation dans le lavage final pendant 30-60 minutes à température ambiante comme avant.
- Vérifier l'ADNmt étiquetage sous un microscope épi-fluorescence.
- Mont lamelles sur des lames de microscope en verre avec un milieu de montage Antifade, comme Prolongez l'or avec le DAPI. Alternativement, l'étiquetage et l'amplification EdU peut être suivie par immunocytochimie fluorescents standards pour étiqueter les autres marqueurs cellulaires.
4. Les résultats représentatifs: Visualisation de la réplication d'ADN mitochondrial comme marqueur de la biogenèse mitochondriale
Nous nous intéressons à la manière dont les neurones sensoriels (figure 1) réguler le nombre de mitochondries. Ce protocole d'étiquettes ADNmt nouvellement synthétisées avec un marqueur fluorescent comme un moyen de mesurer de nouvelles mitochondries. L'incorporation de l'EDU nucléotidique synthétique suivie par la chimie clic de l'amplification Oregon Green-azide et ultérieures avec les 488 Alexa-Fluor résultats tyramide dans l'étiquetage de l'ADNmt avec un signal de fluorescence verte (figure 2). Si fait correctement, le signal amplifié vert est suffisamment supérieure à la fluorescence de fond (tels que l'autofluorescence cellulaire ou un effet secondaire de la réaction HRP-TSA).
Cette technique est conçue pour l'étiquette ADNmt nouvellement répliqué afin de visualiser et de quantifier l'ADNmt au sein de la biogenèse des compartiments subcellulaires de neurones (figure 3). L'étiquetage permet d'immunocytochimie EdU fluorescentes à la suite de l'étiquette d'autres marqueurs cellulaires tels que des neurofilaments (figure 3D).
La réaction du CST peut aussi être fait avec d'autres fluorescents Alexa Fluor tyramides comme Alexa Fluor 594-tyramide. Il en résulte un signal vert fluo nucléaires de la réaction Orégon cliquez vert-azoture dans le noyau, mais aucun signal vert dans l'ADNmt, qui est indétectable avant la TSA. L'amplification avec Alexa Fluor 594-tyramide intensifie l'étiquette nucléaire et révèle l'EDU incorporé dans l'ADN mitochondrial avec un signal fluorescent rouge (figure 4). Une procédure d'amplification similaire est utilisé pour visualiser l'incorporation de BrdU dans l'ADN mitochondrial nouvellement synthétisées (figure 5), cependant, cette méthode nécessite une étape supplémentaire pour récupérer l'épitope BrdU soit par un acide sévère (HCl) ou de l'enzyme digérer, ce qui n'est pas nécessaire pour Edu l'étiquetage.
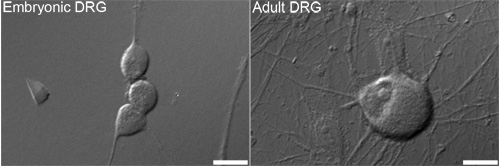
Figure 1. Représentant contraste d'interférence différentiel (DIC) des images d'embryons (à gauche) et adulte (à droite) ganglion de la racine dorsale (DRG) les neurones qui sont généralement utilisés pour l'analyse. Bars = 10 um.
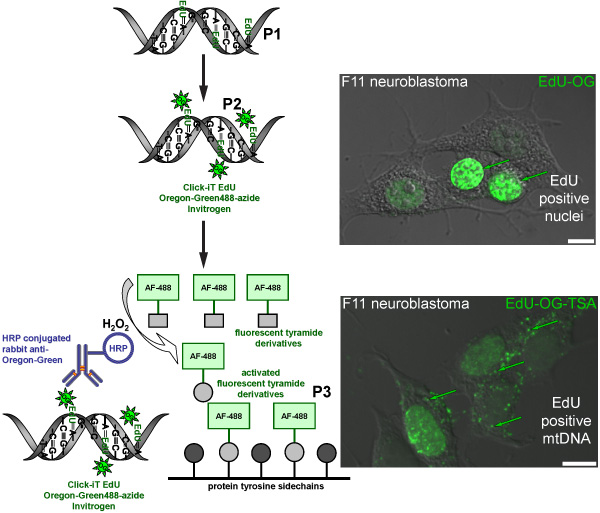
Figure 2. Schéma représentant la procédure à suivre pour l'étiquetage EdU l'ADNmt avec un signal fluorescent vert. Le schéma représente le protocole en trois étapes pour l'étiquetage EdU l'ADNmt avec un signal fluorescent vert. Mitotiquement actives F11 cellules de neuroblastome servir de contrôle positif et d'illustrer le modèle d'étiquetage des EdU qui a été incorporé dans l'ADN nucléaire et mitochondrial. La première étape (P1) est d'incorporer un analogue de la thymidine dans l'ADN mitochondrial nouvellement synthétisées par des cellules d'incubation en présence de Edu. La deuxième étape (P2) est basée sur la chimie de cliquer à l'étiquette EdU incorporé avec une Oregon Green-azoture. Signal vert est visible dans les noyaux des cellules qui reproduit leur ADN nucléaire. L'étape finale (P3) est d'amplifier le Gr. Orégoneen-azoture de signal par incubation avec un anticorps de lapin HRP-conjugué contre Oregon Green suivie d'une incubation avec Alexa Fluor 488 tyramide marqué en présence de peroxyde d'hydrogène (H 2 O 2) pour visualiser le signal vert dans l'ADNmt.
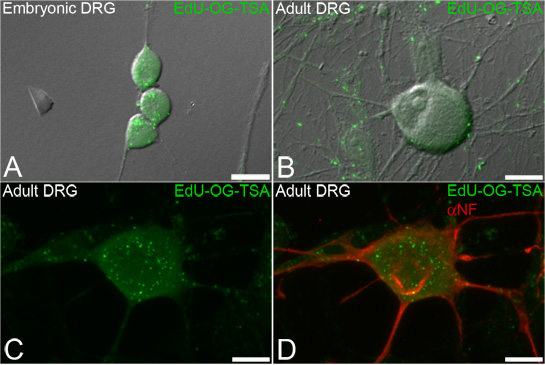
Figure 3. EdU étiquetage de l'ADNmt dans le ganglion de la racine dorsale (DRG) les neurones. Neurones sont incubées avec Edu et le signal est ensuite amplifié à révéler l'ADNmt qui incorporait Edu. Représentant des images de fluorescence superposée sur la lumière transmise montrant verte ponctuée de signaux amplifiés EDU (EDU-OG-TSA, vert) incorporé dans l'ADN mitochondrial des deux nouvellement synthétisées embryonnaires (A) et adulte (BD) neurones DRG. La procédure d'étiquetage EdU permet immunofluorescence ultérieure des marqueurs neuronaux tels que neurofilaments (D, αNF, en rouge). Barres d'échelle = 10 um.
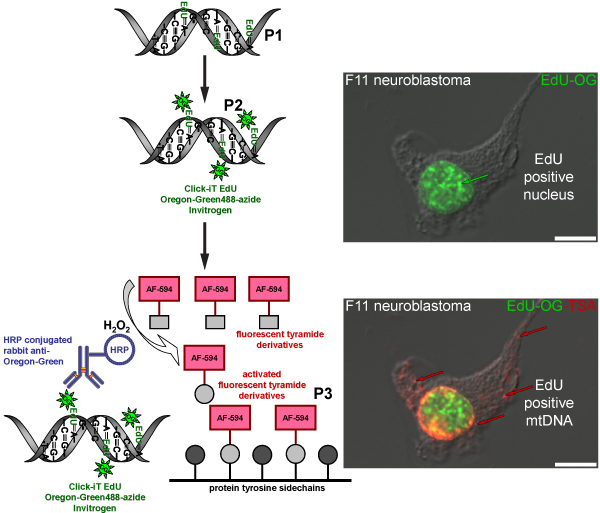
Figure 4. Schéma représentant la procédure à suivre pour l'étiquetage EdU l'ADNmt avec un signal rouge fluorescent. Le schéma représente le protocole en trois étapes pour l'étiquetage EdU l'ADNmt avec un signal rouge fluorescent. Mitotiquement actives F11 cellules de neuroblastome servir de contrôle positif et d'illustrer le modèle d'étiquetage des EdU qui a été incorporé dans l'ADN nucléaire et mitochondrial. La première étape (P1) est d'incorporer un analogue de la thymidine dans l'ADN mitochondrial nouvellement synthétisées par des cellules d'incubation en présence de Edu. La deuxième étape (P2) est basée sur la chimie de cliquer à l'étiquette EdU incorporé avec une Oregon Green-azoture. Signal vert est visible dans les noyaux des cellules qui reproduit leur ADN nucléaire. L'étape finale (P3) est d'amplifier l'Oregon Green-azoture de signal par incubation avec un anticorps de lapin HRP-conjugué contre Oregon Green suivie d'une incubation avec Alexa Fluor 594 tyramide marqué en présence de peroxyde d'hydrogène (H 2 O 2) pour visualiser signal rouge de l'ADNmt.
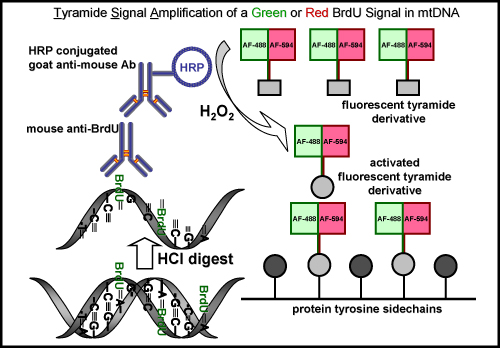
Figure 5. BrdU étiquetage et l'amplification du signal avec un signal tyramide vert ou rouge fluorescent dans l'ADNmt. Le schéma représente la procédure de marquage BrdU dans l'ADN mitochondrial nouvellement synthétisées avec soit un signal vert ou rouge fluorescent. Une première étape est nécessaire pour récupérer l'épitope BrdU soit par un acide (HCl) ou de l'enzyme digérer, ce qui n'est pas nécessaire pour l'étiquetage Edu. La prochaine étape est l'incubation avec une souris primaires d'anticorps anti-BrdU. Il est suivi par une incubation avec une peroxydase de raifort (HRP) de chèvre conjugué anticorps anti-souris. Enfin, le signal est amplifié avec un tyramide vert ou rouge marqué par fluorescence, en présence de peroxyde d'hydrogène (H 2 O 2) pour visualiser les signaux dans l'ADN mitochondrial.
Discussion
Nous avons développé un test sensible à l'étiquette ADNmt nouvellement synthétisés dans des cellules individuelles en utilisant une amplification du signal tyramide d'Edu. Un des plus gros problèmes lors de l'optimisation de ce protocole a été le résultats incohérents entre les lamelles. Des changements ont été apportés aux protocoles Invitrogen kit pour éviter de mélanger de petits volumes sur des lamelles individuelles et l'élaboration de solutions maître à utiliser pour toutes les lamelles. Les 75-80 uL utilisé pour chaque lamelle de verre de 12 mm circulaire est un volume idéal pour couvrir complètement la surface tout en fournissant suffisamment de solution pour donner des résultats cohérents entre les échantillons. Des temps d'incubation et de concentrations de réactifs ont été optimisés, mais des améliorations pourraient être vus avec des ajustements pour eux.
Le protocole est conçu pour fonctionner à chaque processus une fois. Cependant, certaines étapes ont été répétées avec de nouvelles solutions pour récupérer des échantillons qui ont échoué après la première tentative. En particulier, les étapes de réaction EdU clic (03/04 au 03/06) ont été répétés sans une augmentation significative de la fluorescence de fond. L'incubation d'anticorps anti-Oregon Green-HRP (04/01 au 04/03) et l'amplification tyramide (04/04 au 04/05) des mesures ont également été répété, mais le plus souvent traduit par un mauvais signal à bruit en raison de la fluorescence de fond accrue.
Les réactifs les plus sensibles sont les additifs Cliquez-iT Tampon Edu (Component G) et le lapin anti-Oregon Green-HRP anticorps (volet I) à partir du kit Cliquez-iT EdU Assay microplaques. L'additif Cliquez-iT Tampon EdU tourne progressivement au fil du temps jaune lorsqu'il est conservé à 4 ° C et entre 6-12 mois s'assombrit considérablement. Stockage de l'additif Cliquez-iT Tampon EdU à -20 ° C permettra d'atténuer ce problème. L'étiquetage et les étapes d'amplification tyramide meilleur travail quand le lapin anti-Oregon Green-HRP anticorps est utilisé dans les 4-6 mois de la reconstituer dans MilliQ dH 2 O.
L'étiquetage légère de l'ADNmt EdU permet des comparaisons directes avec d'autres marqueurs cellulaires 9-11 et améliore l'utilité de cette technique par rapport à d'autres analogues de la thymidine, tels que le 5-bromo-2-désoxyuridine (BrdU), ce qui nécessite un traitement sévère pour récupérer son épitope dans l'ADN. Notre laboratoire 11-12 et 13-15 autres ont utilisé avec succès BrdU pour étiqueter l'ADNmt. La technique de marquage BrdU est similaire à celui utilisé pour Edu, mais a quelques différences importantes (figure 5). Après l'étape de perméabilisation énumérés ci-dessus (3.1 à 3.2), l'épitope BrdU est récupéré avec une étape de dénaturation (2 HCl pendant 30 min à 37 ° C suivie de trois lavages en PBS 1X). La BrdU est ensuite marqué avec un anticorps primaire contre le BrdU (Vector Laboratories dilué à 1:50 dans une solution de 1% le blocage de la trousse de TSA et incubée une nuit à 4 ° C). Une étape anticorps secondaire est nécessaire pour amplifier le signal BrdU (chèvre anti-IgG de souris conjugué à la HRP de la TSA trousses # 2 et # 5, dilué à 1:100 dans une solution à 1% de blocage et incubées pendant 45 min à température ambiante) avant les étapes TSA (4.3 à 4.5 ci-dessus). Avoir deux analogues de la thymidine, Edu et BrdU, d'ADNmt étiquette est avantageux pour réaliser des expériences où l'ADNmt étiquette double peut être étiqueté de manière séquentielle impulsion étiquetage paradigmes 11.
Notre laboratoire est à l'aide de l'UDE et marquage au BrdU de l'ADNmt d'examiner la réglementation de la biogenèse mitochondriale dans le cadre de la neuropathie diabétique, une complication fréquente du diabète. Nous avons utilisé avec succès l'amplification du signal pour mesurer les changements dans l'ADN mitochondrial dans la biogenèse des neurones individuels 11-12. Cette technique sera utile dans d'autres expériences visant à explorer les mécanismes de réplication de l'ADNmt et le chiffre d'affaires ou pour identifier les médicaments qui inhibent la synthèse ADNmt. En outre, les principes de base des signaux de Edu et BrdU amplifiant peut être appliquée à d'autres études qui mesurent la réplication d'ADN ou de réparation.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par des subventions des National Institutes Health NS-DK-38849 et 076160, la Juvenile Diabetes Research Foundation Center pour l'étude de complications du diabète, le Programme de neurologie de recherche et de découverte et de l'A. Alfred Taubman Institut de recherche médicale à la Université du Michigan. Ce travail a utilisé le Morphologie et Core Image Analysis du Centre de recherche sur le diabète du Michigan et de la formation, financée par les Instituts nationaux de la santé Grant 5P60 DK-20572 de l'Institut national du diabète et des maladies digestives et rénales. Les auteurs remercient Scott T. Clarke de Molecular Probes / Invitrogen pour ses précieux conseils sur les différentes Cliquez-iT EdU étiquetage des kits et le don généreux de réactifs pour soutenir le développement initial de la technique d'amplification Edu.
matériels
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Fisher Scientific | 12-545-82 | |
| 245 mm x 245 mm BioAssay Dish | Corning | 431111 | |
| Parafilm M | Fisher Scientific | PM-996 | |
| paraformaldehye | Sigma-Aldrich | P6148 | |
| Triton X-100 | Sigma-Aldrich | T-8532 | |
| Phosphate buffered saline 10X solution | Fisher Scientific | BP399 | |
| Transfer Pipet | Fisher Scientific | 13-711-7M | |
| Hydrogen peroxide, 30% in water | Fisher Scientific | BP2633 | |
| Click-iT EdU Microplate Assay Kit | Invitrogen | C10214 | |
| TSA Kit #12, with HRP—goat anti-rabbit IgG and Alexa Fluor 488 tyramide | Invitrogen | T20922 | |
| TSA Kit #15, with HRP–goat anti-rabbit IgG and Alexa Fluor 594 tyramide | Invitrogen | T20925 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| Polyclonal rabbit Neurofilament antibody | Chemicon International | AB1981 | |
| Mouse monoclonal anti-BrdU antibody | Vector Laboratories | VP-B209 | |
| TSA Kit #2, with HRP—goat anti-mouse IgG and Alexa Fluor 488 tyramide | Invitrogen | T20912 | |
| TSA Kit #5, with HRP—goat anti-mouse IgG and Alexa Fluor 594 tyramide | Invitrogen | T20915 |
Références
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu. Rev. Cell Dev. Biol. 22, 79-99 (2006).
- Dimmer, K. S., Scorrano, L. (De)constructing mitochondria: what for. Physiology (Bethesda). 21, 233-241 (2006).
- Suen, D. F., Norris, K. L., Youle, R. J. Mitochondrial dynamics and apoptosis. Genes Dev. 22, 1577-1590 (2008).
- Clay Montier, L. L., Deng, J. J., Bai, Y. Number matters: control of mammalian mitochondrial DNA copy number. J. Genet. Genomics. 36 (3), 125-131 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U.S.A. 105, 2415-2420 (2008).
- Buck, S. B., Bradford, J., Gee, K. R., Agnew, B. J., Clarke, S. T., Salic, A. Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. 44, 927-929 (2008).
- Yu, Y., Arora, A., Min, W., Roifman, C. M., Grunebaum, E. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations. J Immunol Methods. 350 (1-2), 29-35 (2009).
- Heusden, J. V. a. n., Jong, P. d. e., Ramaekers, F., Bruwiere, H., Borgers, M., Smets, G. Fluorescein-labeled tyramide strongly enhances the detection of low bromodeoxyuridine incorporation levels. J. Histochem. Cytochem. 45 (2), 315-319 (1997).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. A novel method based on click chemistry, which overcomes limitations of cell cycle analysis by classical determination of BrdU incorporation, allowing multiplex antibody staining. Cytometry A. 73, 626-636 (2008).
- Kaiser, C. L., Kamien, A. J., Shah, P. A., Chapman, B. J., Cotanche, D. A. 5-Ethynyl-2'-deoxyuridine labeling detects proliferating cells in the regenerating avian cochlea. Laryngoscope. 119, 1770-1775 (2009).
- Lentz, S. I., Edwards, J. L., Backus, C., McLean, L. L., Haines, K. M., Feldman, E. L. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In. Vitro. J Histochem Cytochem. 58 (2), 207-218 (2010).
- Edwards, J. L., Quattrini, A., Lentz, S. I., Figueroa-Romero, C., Cerri, F., Backus, C., Hong, Y., Feldman, E. L. Diabetes regulates mitochondrial biogenesis and fission in mouse neurons. Diabetologia. 53 (1), 160-169 (2010).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J. Cell Biol. 135, 883-893 (1996).
- Magnusson, J., Orth, M., Lestienne, P., Taanman, J. W. Replication of mitochondrial DNA occurs throughout the mitochondria of cultured human cells. Exp. Cell. Res. 289, 133-142 (2003).
- Amiri, M., Hollenbeck, P. J. Mitochondrial biogenesis in the axons of vertebrate peripheral neurons. Dev. Neurobiol. 68, 1348-1361 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon