Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Test activité Protozoacidal du ligand-lytique peptides contre Gut Termite protozoaires In vitro (Culture protozoaires) et In vivo (Microinjection dans Termite Intestin postérieur)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons les procédures pour démontrer que les ligands se lient à la membrane de surface des ces protozoaires digérant la cellulose-dans l'intestin des termites de Formose souterraines en utilisant la microscopie fluorescente et que les ligands couplés avec des peptides lytiques tuer les protozoaires In vitro (Anaérobie de la culture de protozoaires) et In vivo (Injection dans l'intestin postérieur des termites).
Résumé
Nous développons une nouvelle approche de lutte contre les termites souterrains qui conduirait à réduire la dépendance à l'utilisation de pesticides chimiques. Les termites souterrains sont dépendants des protozoaires dans le hindguts des travailleurs à digérer efficacement le bois. Peptides lytiques ont été capables de tuer une variété de parasites protozoaires (Mutwiri et al. 2000) et aussi des protozoaires dans l'intestin des termites de Formose souterraines, Coptotermes formosanus (Husseneder et Collier 2009). Peptides lytiques sont partie du système immunitaire non spécifique des eucaryotes, et de détruire les membranes des microorganismes (Leuschner et Hansel 2004). La plupart des peptides lytiques ne sont pas susceptibles de nuire les eucaryotes supérieurs, parce qu'ils n'affectent pas les membranes cellulaires électriquement neutre contenant du cholestérol des eucaryotes supérieurs (Javadpour et al. 1996). L'action lytique peptide peuvent être ciblées sur des types cellulaires spécifiques par l'ajout d'un ligand. Par exemple, Hansel et al. (2007) a rapporté que les peptides lytiques conjugués avec des ligands des récepteurs des cellules du cancer de membrane peuvent être utilisées pour détruire les cellules cancéreuses du sein, tandis que les peptides lytiques seul ou conjugué avec des non-peptides spécifiques n'ont pas été efficaces. Peptides lytiques ont également été conjugué à des hormones humaines qui se lient à des récepteurs sur les cellules tumorales pour destruction ciblée de cellules cancéreuses de la prostate et des testicules (Leuschner et Hansel 2004).
Dans cet article nous présentons les techniques utilisées pour démontrer l'activité protozoacidal d'un peptide lytique (Hecate) couplé à un ligand qui se lie à heptapeptide la membrane de surface des protozoaires de l'intestin des termites de Formose souterraines. Ces techniques comprennent extirpation de l'intestin des travailleurs contre les termites, la culture anaérobie de l'intestin protozoaires (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), confirmation microscopique que le ligand marqué avec un colorant fluorescent se lie à l'intestin des termites et autres protozoaires vivant librement protozoaires, mais pas à des bactéries ou tissu intestinal. Nous démontrons également que le même ligand couplé à un peptide lytique tue efficacement l'intestin des termites protozoaires in vitro (culture de protozoaires) et in vivo (micro-injection dans l'intestin postérieur des travailleurs), mais il est moins bactéricide que le peptide lytique seul. La perte de protozoaires conduit à la mort des termites en moins de deux semaines.
Dans le futur, nous allons modifier génétiquement des micro-organismes qui peuvent survivre dans l'intestin postérieur des termites et la propagation à travers une colonie de termites comme «cheval de Troie» pour exprimer ligand-lytique des peptides qui allait tuer les protozoaires dans l'intestin des termites et ensuite tuer les termites de la colonie . Ligand-lytique peptides pourrait également être utile pour le développement de médicaments contre les parasites protozoaires.
Protocole
Expérience 1: Extraction de l'intestin des termites protozoaires dans des conditions anaérobies
- Utilisez une boîte de ventilateur (Laboratoires Cie) dans une boîte à gants de constamment circuler l'air à travers un déshydratant et le type catalyseur D Stak-Paks de contrôler l'humidité et les niveaux d'oxygène et d'éliminer les températures inégales. Remplissez la boîte à gants avec un flux continu d'azote de 20 à 30 min. Surveiller les niveaux d'oxygène avec un capteur d'oxygène (C-squared, Inc) pendant 1 h. Utilisez l'azote pour atteindre et maintenir des conditions anaérobies en cas de besoin.
- Préparer Trager U médias (Trager 1934) et ajuster le pH à 7,0. Barbotage du média filtrant stérilisés dans la boîte à gants avec un mélange d'hydrogène de 2,5%, de dioxyde de carbone de 5% et 92,5% d'azote pendant 1 h pour enlever les résidus de l'oxygène.
- Silaniser tous les matériaux, y compris des lames de microscope, des microtubes, des pipettes, verrerie etc utilisés dans les expériences utilisant Sigmacote pour empêcher l'adsorption des protozoaires ou des peptides aux surfaces (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / mediaLib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Depuis l'intestin des termites protozoaires sont des organismes anaérobies strictes qu'elles ne doivent pas être exposés à l'oxygène. Par conséquent, les étapes suivantes sont effectuées dans des conditions anaérobies dans une boîte à gants (voir 1.1). Avec une pince à plonger tout le corps d'un travailleur de termites dans l'éthanol à 70% et mélanger doucement en tournant pendant environ 10 s pour enlever les contaminants de surface.
- Retirez le travailleur de l'éthanol et laisser sécher sur un Kimwipe propre pour environ 20 s. Utiliser une solution stérile à pointe fine pince pour tenir le ventre des travailleurs et de saisir l'extrémité de l'abdomen avec une autre paire de pinces pour tirer doucement l'intestin vers le haut ou vers le bas dans un angle de 45 degrés. Si l'intestin est tiré à un angle de droites et avec trop de force, il est susceptible de se briser. Placer 10 tripes dans une goutte de 100 médias ul U Trager sur une lame de microscope.
- Pierce les tripes avec une paire de sondes stériles fines dissection pour libérer les protozoaires et doucement transférer le contenu de l'intestin avec une pipette 200 pi dans un tube à centrifuger 1 ml contenant 900 ul Trager U médias. Après prise en compte de sédimentation des fragments de paroi intestinale (5 s), le transfert de 900 pi de surnageant dans un nouveau tube.
- Transférer 10 ul de la culture de protozoaires une lame de microscope sigmacoted et vérifiez l'état des protozoaires sous un microscope à grossissement X 200.
- Préparer les cultures de contrôle de l'Tetrahymena pyriformis protozoaires aérobie, Amoeba sp. Euglena sp., Et la paramécie sp. (Carolina Biological Supply Company, Burlington, Caroline du Nord) ainsi que d'une culture de nuit de Escherichia coli dans les milieux de culture recommandé par le fournisseur.
Expérience 2: ligand Ajouter couplé avec un colorant fluorescent pour les protozoaires et les bactéries des cultures d'essai pour la liaison aux membranes de surface et les parois cellulaires
Nous avons déjà utilisé les bibliothèques phage display (New England Biolabs Inc, Ipswich, MA) pour identifier les 19 séquences heptapeptide qui se lient à des protozoaires (protocoles disponibles au http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). Un ligand avec une séquence peptidique (ALNLTLH) qui a montré des similitudes avec les glycoprotéines putatives connue de la membrane Trypanosoma brucei a été synthétisé et couplé à une sonde fluorescente C-terminale (EDANS, 5 - ((2-aminoéthyl) amino) naphtalène-1-sulfonique acide, Xmax = 341 nm, = 471 nm λem) via la synthèse de peptides état solide (SSPS) en utilisant la résine EDANS NovaTag (EMD Biosciences). Ici nous démontrons que le ligand se lie à la protozoaires, qui ont été isolées de l'intestin des termites et autres protozoaires vivant librement, mais pas pour les bactéries.
- Culture du protozoaires tels que décrits dans Exp. 1. Fixer les protozoaires avec le formaldéhyde 10% à 4 ° C pendant 12 h.
- Centrifuger la solution protozoaires (30 xg, 10 min), éliminer le surnageant et laver le culot contenant les protozoaires fixes deux fois dans 1ml Trager médias U. Re-suspendre le culot dans 1 ml Trager médias U. En outre, fixer d'autres protozoaires, et E. coli pour les contrôles.
- Incuber les micro-organismes fixés pour les 1-2 h avec une solution de ligand synthétisé couplé à la EDANS colorant fluorescent (préparé dans l'eau) à une concentration finale de 50 uM. Le ligand se dissout mieux dans l'eau que Trager U médias.
- Respecter les micro-organismes sous un microscope à fluorescence à 400 grossissement X à un maximum d'absorbance à 341 nm et une émission dans la région bleue à 471 nm.
Expérience 3: Test de l'activité protozoacidal du ligand couplé à un peptide lytique in vitro (culture de protozoaires)
Un conjugué de ligand et le peptide lytique Hécate (Mutwiri et al. 2000) a déjà été synthétisé à l'installation de protéines LSU.
- Silaniser matériaux et de préparer l'intestin des termites de la culture de protozoaires dans la boîte à gants anaérobies unes décrit dans Exp. 1.
- Préparer des cultures de micro-organismes aérobies de contrôle (par exemple, E. coli et les espèces vivant librement protozoaires T. pyriformis).
- Dans l'environnement anaérobie de la boîte à gants, une pipette 6 aliquotes de 198 ul de la culture de protozoaires dans 0,5 ml de tubes Eppendorf. Ajouter 2 ul d'une solution 100 uM de ligand peptide-lytique de la moitié des aliquotes (concentration finale 1 uM) de la culture l'intestin des termites protozoaires. Ajoutez 2 l d'eau à l'autre moitié des aliquotes (témoins).
- Sur la paillasse, préparer des aliquotes similaires de E. coli et de T. pyriformis avec 1 uM de peptide, lytique ligand-lytique peptide ou de l'eau.
- Après 1 h, le transfert 10 ul de chaque culture protozoaires aux diapositives. Comparer la survie des traités protozoaires à celle des témoins sous un microscope à grossissement X 200.
- Après 1 h, la plaque 100 ul d'env. Dilution 10 -4 de l'E. coli sur les cultures BHI et incuber à 37 ° C pendant la nuit. Comparer le nombre d'unités formant colonie sur les plaques.
Expérience 4: L'injection du ligand couplé à un colorant fluorescent dans l'intestin postérieur en termite
- Tirez aiguilles (modèle GD-1, 1 x 900 mm) en utilisant un Narishige PC-10 de verre extracteur micropipette avec un niveau de chaleur à deux étages (65 et 48) pour obtenir une taille de bout de 20-30 um. Confirmer la taille de la pointe en la mesurant au microscope en utilisant un micromètre.
- Remplir une aiguille avec ca. 30 ul de 50 uM de ligand fluorescent marqué en suspension dans l'eau en utilisant une seringue fixée. Remplir une autre aiguille avec de l'eau pour le contrôle. Attacher une micropipette (0,5 microlitres et 32 mm de longueur, Drummond Scientific Company) à un détenteur d'un micromanipulateur. Fixer une aiguille pour le titulaire du système d'injection dans un micromanipulateur secondes. Réglez les paramètres d'injection initiale à environ 1 s longueur d'impulsion et 10-12 psi d'injection. Avancer l'aiguille lentement dans la micropipette et injecter la solution en utilisant une pédale mécanique haute vitesse du système d'injection électronique avec une durée d'impulsion de contrôle attachée à un flux d'azote gazeux contrôlé, ce qui assure un volume constant est reproductible injecté. Après l'injection, retirez la micropipette et d'enregistrer la longueur de la solution injectée en utilisant un pied à coulisse. Calculer le volume injecté à partir des paramètres connus de la micropipette. Régler la pression d'azote gazeux et de la durée d'impulsion d'expulser 0,3 ul solution en une seule injection.
- Pressez la fin de l'abdomen des travailleurs contre les termites avec des pinces doux pour enlever toute présents excréments dans le rectum. Immobiliser des travailleurs contre les termites en les paralysant sur la glace pendant 5 min.
- Faire des récepteurs pour la tenue de travailleurs contre les termites en coupant 100 embouts de pipette ul en utilisant une lame de scalpel. Couper l'extrémité d'une longueur de 10 - 12 mm et l'utilisation en fonction de la taille de termites.
- Connectez le récepteur à l'micromanipulateur. Placer un ouvrier sur une boîte de Pétri sur sa face dorsale et aspirer la tête du premier travailleur dans le récepteur à l'aide d'une pompe d'aspiration d'azote pour que le terminus de la saillie à des travailleurs à partir du récepteur.
- Tenir le termite dans le récepteur, soigneusement avancer l'aiguille remplie à l'aide du micromanipulateur pour l'insérer dans l'anus des travailleurs. Injecter 0,3 ul de la solution (ligand fluorescent marqué ou de l'eau pour les contrôles).
- Placez les travailleurs injecté avec un ligand ou d'eau dans des boîtes de Petri séparées avec un papier filtre humide et les maintenir à 26 ± 2 ° C avec 78% HR
- Extirper tripes de l'termites injecté et de recueillir les protozoaires après 24 h comme indiqué ci-dessus dans Exp. 1. Fix et observer les protozoaires, comme indiqué dans Exp. 2.
Expérience 5: Test d'activité protozoacidal du ligand couplé à un peptide lytique in vivo (injection dans termites hindgut)
- Silaniser matériaux tels que décrits dans Exp. 1.
- Préparer une solution 500 uM du peptide ligand-lytiques dans l'eau.
- Suivez les étapes 3.1) à 3.4) pour préparer des aiguilles de verre, des récepteurs et des travailleurs contre les termites.
- Après les méthodes décrites dans 3.5) injectent 0,3 pi de solution de peptide ligand-lytique (traitement) ou de l'eau (contrôle) dans l'intestin postérieur de 20 travailleurs de termites.
- Tenir les termites pendant 24 h, tripes extirper plusieurs travailleurs et d'observer le contenu intestinal sous le microscope comme décrit dans 3.6). et 3.7).
- Dès la mort de protozoaires dans l'intestin des termites est confirmé, gardez restantes termites traités et les contrôles dans des boîtes de Petri avec du papier filtre humide et d'observer la mortalité journalière.
Les résultats représentatifs:
Expérience 1: Habituellement, l'intestin antérieur, moyen et postérieur sont obtenues en une seule pièce lorsque la procédure est suivie correctement (figure 1a). Les protozoaires résider dans la densité élevée dans les portions anaérobie de l'intestin postérieur et peut être libéré en perçant l'intestin postérieur avec une pince (1 figure 1b et 2). La plus grande protozoa espèces dans l'intestin des termites souterrains de Formose est le P. fusiforme grassii, ce qui est de 200 à 300 um de long et 150 um de large et peut être vu à l'œil nu. La plus grande espèce est la seconde forme de poire H. hartmanni (50-140 um de long et de 30 à 80 um de large). La plus petite espèce est la forme de cône S. leidyi (15-50 um de long et de 80 à 30 um de large;. Lai et al 1983). Les espèces protozoaires sont présentés dans la figure 2.
Dans des conditions optimales de culture des trois espèces de protozoaires isolés de l'intestin des termites souterrains Formose restera vivant et en bonne santé pendant au moins 72 h en anaérobie des médias Trager U (figure 3a). Cependant, si les conditions de culture ne sont pas optimales protozoaires mourra rapidement. S'il ya des résidus de l'oxygène dans les médias, le mouvement des protozoaires cessera immédiatement. Si la pression osmotique est trop élevée ou d'une membrane d'intégrité est compromise la membrane de surface du bulbe sera protozoaires et la rupture des cellules (figure 3B). Si la pression osmotique est trop faible ou les membranes sont compromis, les protozoaires se ratatiner et rétrécir (figure 3C).
Expérience 2: Nous avons confirmé que le ligand couplé à une sonde fluorescente liée à tous les trois espèces de protozoaires de l'intestin postérieur de Formose termites souterrains dans les densités détectable. La fixation du ligand se produit sur la surface de la cellule entière (figure 4). Des sites de liaison sont concentrés dans la région antérieure de la protozoaires sur le axostyle (une feuille de microtubules) et le noyau de P. grassii.
Nous avons observé une certaine autofluorescence irrégulière de particules de bois ingéré par les protozoaires. Toutefois, l'autofluorescence est habituellement facile à discerner, à partir liaison spécifique du ligand, car il n'ya pas l'autofluorescence de la surface, le axostyle et le noyau (figure 4).
Nous avons également détecté par fluorescence dans tous testés vivant librement aérobie espèces de protozoaires (figure 5), ce qui suggère que le ligand se lie à des structures génériques pour les protozoaires. Cependant, aucun ligand n'a été observée pour E. coli.
Expérience 3: Un uM de ligand-lytique peptide tué tous les trois espèces de protozoaires de l'intestin des termites souterrains travailleurs de Formose et le T. vivant librement pyriformis in vitro, en moins de 10 min, tandis que les contrôles est resté en vie. La figure 6 montre la perte progressive de l'intégrité des membranes de l'intestin des termites protozoaires traités avec le ligand peptide-lytique. Renflement des membranes et de la rupture, se ratatinent et meurent les protozoaires. Aucune différence n'a été observée dans le nombre de E. coli colonies entre les traitements de ligand peptide-lytique et l'eau. Peptide lytique sans ligand, cependant, réduit le nombre de E. colonies coli considérablement (figure 7). Ceci suggère que l'attachement du ligand à un certain degré protège les microorganismes non cibles de la lyse.
Expérience 4: Quand 0,3 ul 50 uM du ligand fluorescent marqué a été injecté dans l'intestin postérieur des travailleurs contre les termites, la liaison à P. grassii, S. leidyi et H. hartmanni a été confirmée par la microscopie par fluorescence similaire à Exp. 2 (figure 4). Tissu intestinal Termite n'a pas montré de fluorescence.
Expérience 5: Injection de 0,3 ul 500 pM ligand-lytique peptide tué tous les trois espèces de protozoaires dans l'intestin des termites souterrains Formose dans les 24h. Les termites sont décédés dans les 10 jours après la perte de leur protozoaires symbiotiques. Auparavant, Husseneder et Collier (2009) ont injecté la même concentration de peptide lytique dans les entrailles des termites. Sans le ligand fixé, il a fallu plus de temps jusqu'à ce que les protozoaires dans l'intestin (72 h) et les termites étaient morts (six semaines). Cela suggère que le ligand augmente l'efficacité des peptides lytiques protozoacidal, probablement en se liant les peptides lytiques à l'protozoaires.
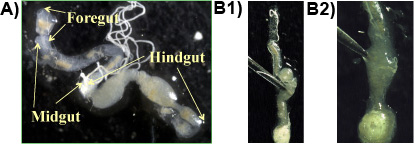
Figure 1. une gut Formose termites souterrains sur une diapositive montrant les principales sections de l'intestin (avant-, mi-, hindgut); b 1 & 2: Intestin postérieur est percé avec une pince pour libérer le contenu de l'intestin contenant des protozoaires.

Figure 2. Les trois espèces de protozoaires flagellés trouvés dans l'intestin postérieur des termites souterrains Formose: a) Pseudotrichonympha grassii, b) Holomastigotoides hartmanni, et c) Spirotrichonympha leidyi.

Figure 3. Les protozoaires dans la culture, une saine) protozoaires, b) les protozoaires avec des membranes bombées, c) flétri protozoaires.

Figure 4. Confirmation de la liaison du ligand couplé à une sonde fluorescente pour l'intestin des termitesprotozoaires (de haut en bas: P. grassii, H. hartmanni, S. leydi), traité avec le ligand fluorescent marqué et les témoins non traités (montrant autofluorescence).

Figure 5. Liaison du ligand à la vie libre protozoaires aérobie, a) de Tetrahymena, b) Amoeba, c) Euglena, et d) de la paramécie.
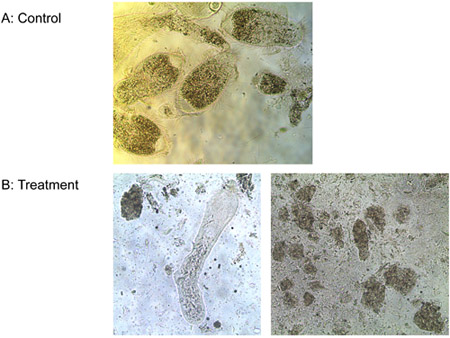
Figure 6. Traitement des protozoaires avec une eau) (contrôle) et b) 1 uM ligand peptide-lytique.
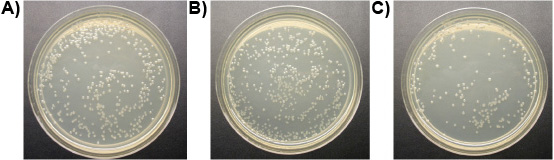
Figure 7. E. coli colonies sur des plaques (dilution 10 -4): a) traitées avec de l'eau (contrôle), b) traités avec 1 uM de peptide ligand-lytique, c) traités avec 1 uM de peptide lytique.
Access restricted. Please log in or start a trial to view this content.
Discussion
Ligand-lytique peptides ont été utilisés avec succès pour cibler efficacement et de détruire les cellules cancéreuses (Hansel et Leuschner 2004, Hansel et al. 2007). Basé sur ce concept, nous avons développé un ligand qui se lie à heptapeptide la surface de protozoaires dans l'intestin des termites souterrains de Formose et couplé à un peptide lytique dans le but de détruire ces n'oblige digérer la cellulose-symbiotes dans l'intestin des termites pour atteindre les termites contrôle (...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Nous remercions le Dr Allison Richard, ancien directeur de l'établissement peptide LSU pour la synthèse ligand fluorescent, le Centre de recherche en biotechnologie Interdisciplinaray, UF pour la synthèse peptidique ligand-lytique, et l'installation de microscope Socolovsky pour donner accès à des microscopes à fluorescence. Le financement a été fourni par le Programme de développement SERDP exploratoire pour demain (SEED) du ministère de la Défense, ministère de l'Énergie et de l'Environmental Protection Agency, le Programme de biotechnologie AgCenter équipe interdisciplinaire et l'État de Louisiane.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Références
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon