Method Article
L'imagerie in vivo chez la drosophile larves Intact au sub-cellulaire Résolution
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une méthode fiable pour l'anesthésie et l'imagerie de intactes Drosophila melanogaster. Nous avons utilisé les anesthésiques volatils desflurane pour permettre l'imagerie répétitive au sub-cellulaire de résolution et de ré-identification des structures pour un maximum de quelques jours 1.
Résumé
Des améliorations récentes dans l'imagerie optique, les fluorophores génétiquement codés et des outils génétiques permettant l'établissement efficace de lignées d'animaux transgéniques souhaités ont permis de processus biologiques à étudier dans le contexte d'une vie, et même dans certains cas se comporter, de l'organisme. Dans ce protocole, nous allons décrire comment anesthésier intacte larves de drosophile, en utilisant les anesthésiques volatils desflurane, pour suivre le développement et la plasticité synaptique des populations à une résolution sub-cellulaire 1-3. Alors que d'autres méthodes utiles pour anesthésier les larves de Drosophila melanogaster ont été décrits précédemment 4,5,6,7,8, le protocole présentés ici démontrent des améliorations significatives pour les raisons suivantes combinées principales caractéristiques: (1) Un très haut degré de l'anesthésie, même les battement de coeur est arrêté permettant la résolution latérale de 150 nm 1, (2) un taux de survie élevé des> 90% par cycle anesthésie, permettant l'enregistrement de plus de cinq points de temps sur une période de deux heures à plusieurs jours et ( 3) une sensibilité élevée qui nous permet dans 2 cas à étudier la dynamique des protéines exprimées à des niveaux physiologiques. Dans le détail, nous avons été en mesure de visualiser la sous-unité du récepteur du glutamate postsynaptique GluR-IIA exprimé via le promoteur endogène dans une écurie lignées transgéniques et la ligne de trappe exon FasII-GFP 1. (4) Contrairement aux autres méthodes 4,7 larves peuvent être imagées non seulement vivant, mais aussi intacte (c'est à dire non disséqué) permettant l'observation de se produire sur un nombre de jours 1. Les détails vidéo d'accompagnement de la fonction des différentes parties de la chambre de l'imagerie in vivo 2,3, le montage correct de la larve, la procédure de l'anesthésie, la manière de ré-identifier des postes spécifiques au sein d'une larve et l'élimination sûre des larves de l'imagerie Chambre.
Protocole
A) de l'Assemblée de la chambre de l'imagerie
- Sélectionnez une larve du stade choisi (par exemple au début 3 ème stade larvaire en laissant un intervalle d'observation d'environ 24 heures à 25 ° C jusqu'à errance scène).
- Rincer la larve à l'eau pour le nettoyer du milieu de culture et de la limande sécher.
- Enduire le centre de l'élément de fond de la chambre, dans la région pour faire face à la larve, avec un mince film d'huile sur les halocarbures.
- Mettez la larve avec la face ventrale face à l'objectif du microscope dans la chambre (permet jonction neuromusculaire (JNM) 26 et 27 à imager) (figure 1 AE).
- Placer l'entretoise en plastique sur la couche d'huile, avec les fentes d'air de la face vers le haut de grille (Figure 1). S'il vous plaît vérifier à cette étape: La hauteur de la cale est à peu près la moitié du diamètre des larves, la largeur de la fente doit être environ deux fois le diamètre de la larve.
- Placez la chambre d'imagerie sur le microscope
B) Anesthésie de la larve
- Relier les deux entrées de la chambre avec une anesthésie appropriée périphérique / vaporisateur.
S'il vous plaît vérifier à l'avance:
La concentration efficace de desflurane dans la salle de l'air ne devrait jamais dépasser celle spécifiée par les règlements de sécurité! Seul un très petit volume total de desflurane est nécessaire pour anesthésier les larves. L'application de 15% (v / v) d'une desflurane s'est avéré être un bon point de départ pour déterminer la concentration idéale pour être utilisée dans une expérience. Pour des raisons de sécurité nous suggérons que le vaporisateur ne devrait jamais contenir plus que nécessaire desflurane pour 2-4 heures de l'imagerie in vivo. - Immerger l'autre extrémité du tube fixé à la sortie de la chambre dans un verre d'eau, puis ouvrir les vannes de régulation du débit de l'anesthésique dans la chambre pendant environ cinq secondes.
S'il vous plaît vérifier à cette étape:
Ne bulles d'air montent dans l'eau? Si ce n'est pas la chambre est percé. - Fermer les vannes pendant environ trois secondes.
- Surveiller les mouvements résiduels de larves dans le microscope. Vérifiez la fois le rythme cardiaque et les mouvements musculaires. Si nécessaire soupapes s'ouvrent et se ferment comme décrit dans l'étape 8 et 9 jusqu'à ce que l'anesthésie de la larve est terminée, puis fermez tous les robinets et commencer l'imagerie.
S'il vous plaît vérifier à cette étape:
Mouvements musculaires résiduelles ou pouls indique que la larve n'est pas correctement anesthésié. Anesthésie complète est vitale pour des images haute résolution. La larve ne devrait normalement pas être anesthésiés pendant plus de 15-20 minutes à une heure donnée.
C) Imagerie
- Identifier la position correcte et l'image de la structure d'intérêt (figure 2-4).
D) La récupération d'une anesthésie
- Après l'imagerie est terminée laisser entrer l'air dans la chambre.
S'il vous plaît vérifier à cette étape:
Vérifiez les contractions musculaires et des battements de cœur de la larve par une lumière halogène transmis. Comme les muscles commencent traitance qu'il est sécuritaire d'enlever la larve de la chambre de l'imagerie. - Détachez la chambre de l'appareil anesthésie et de le retirer du microscope. Démonter la chambre avec soin et placez la larve dans un milieu de culture de volée écrasée.
- Rangez la vaisselle dans un incubateur à la température appropriée.
Séries E)
- Répétez la procédure jusqu'à 2-14 points de temps suffisantes ont été obtenues.
Alternative protocole:
Si la larve est à imager plus d'une fois dans un intervalle de 30 minutes il peut être pratique de le laisser dans la chambre d'imagerie jusqu'au point de temps anesthésie prochaine. Répétez la procédure jusqu'à 7-14 points de temps suffisantes ont été obtenues.
S'il vous plaît vérifier à cette étape:
La larve est de ne pas être conservé dans la chambre de l'imagerie depuis plus de deux heures à la fois, ni d'être anesthésiés pendant plus de 15-20 minutes à une heure.

La figure 1 de l'Assemblée de la chambre de l'imagerie. (A) Placer la larve et l'entretoise en plastique sur la couche d'huile. (B) Placez un 22 x 22 mm lamelle sur l'entretoise et insérez la bague de guidage en plexiglas dans la chambre, à côté (C) fixer la position de la larve avec l'anneau de métal et (D) à proximité de la chambre. (E) Maintenant, la chambre est prête à être montée sur le microscope.
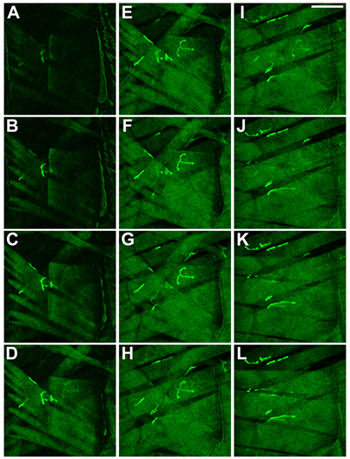
Figure 2 Corps-mur muscles de larves de drosophile. Muscles et NMJs ont été visualisées par l'expression d'une protéine de fusion GFP-CD8-Sh 8. Les muscles sont présentés comme observé lors de la focalisation à la face ventrale à travers la cuticule dans la larve. Dans (AC) le muscle le plus superficiel, 27 ans, est montré, dans (KL) les muscles les plus intérieurs, 6 et 7, sont représentés. Barre d'échelle: 100 um, Az entre deux tranches est de 2 um.

Figure 3 Identité de tégument muscles de larves de drosophile. L'identité des muscles en L3 drosophile larves, A3 segment, est montré. Muscles et NMJs ont été visualisées par l'expression d'une protéine de fusion GFP-CD8-Sh 8. Les muscles sont affichés comme observé lors de la focalisation à la face ventrale à travers la cuticule dans les larves. En AC le muscle le plus superficiel, 27 ans, est montré, dans KL les muscles les plus intérieurs, 6 et 7, sont représentés. Barre d'échelle: 100 um, Az entre deux tranches est de 2 um.
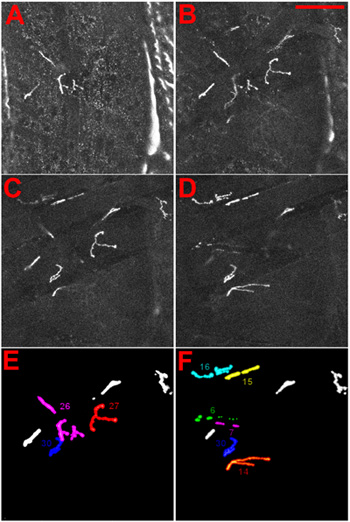
Figure 4 Identité des jonctions neuromusculaires des larves de drosophile. (AD) NMJs ont été visualisés par expression d'une protéine de fusion DGluRIIA-MRFP 1. Le NMJs sont présentés comme observé lors de la focalisation à la face ventrale à travers la cuticule dans la larve. Dans (AB) le plus superficiel JNM, 27 ans, est montré, dans le CD du NMJs plus intérieure, 6 et 7, sont représentés. Barre d'échelle: 100 um, Az entre deux tranches est de 5 um. (E) et (F) l'identité du superficiel (E) et plus intérieure (F) NMJs est donnée à titre de référence.
Discussion
La méthode présentée a été initialement développé pour étudier les synapses glutamatergiques sur les muscles de la paroi du corps de Drosophila melanogaster larves. La drosophile jonction neuromusculaire (JNM) est caractérisé par une architecture de cyto-stéréotypée des muscles et les neurones et est donc idéal pour l'imagerie in vivo. Cependant, le protocole décrit anesthésie n'est pas limité à l'imagerie de la JNM, la transparence des larves de drosophile facilite l'adaptation du protocole décrit pour étudier le développement des organes, la migration des cellules, le transport de fret axonale et sub-cellulaire de réorganisation au sein des cellules.
Déclarations de divulgation
Remerciements
Nous remercions Andreas Schönle, Max-Planck-Institut de chimie biophysique, l'Allemagne et David J. Sandstrom, National Institute of Mental Health, National Institutes of Health, Bethesda, MD, Etats-Unis pour des conseils techniques. Nous tenons à remercier Frank Kötting, European Neuroscience Institute, Göttingen pour la construction de la chambre de l'imagerie et l'appareil anesthésie. Ce travail a été soutenu par des subventions de l'Initiative d'Alzheimer Forschung à TMRYZ a été soutenue par une bourse du Conseil des bourses de Chine, le SBH par une bourse de la Graduate School pour les Neurosciences cellulaires et moléculaires, Université de Tübingen.
matériels
Réactifs:
- Desflurane (Suprane, Baxter, Unterschleißheim, Allemagne)
- D'huile sur les halocarbures (ex Voltalef H10S huile / Atofina, Puteaux, France)
- Fly milieu de culture
Equipement:
- Inversé microscope confocal
- Microscope binoculaire (par exemple Stemi 2000, Carl Zeiss, Jena, Allemagne)
- Petit pinceau comme utilisé pour trier les mouches
- Incubateur
- Personnalisé de chambre construite imagerie (Pour les dessins mécaniques voir réf. 3)
- Vaporisateur / anesthésie appareil (Pour plus de détails voir Réf. 3)
Références
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon