Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une plaque de microtitrage à 96 puits à base Méthode de formation suivi et les tests de sensibilité antifongique des Candida albicans Les biofilms
Dans cet article
Résumé
Nous décrivons une méthode simple, rapide et robuste pour la formation de Candida albicans Biofilms en utilisant des plaques de microtitration 96 puits et son utilité dans les tests de sensibilité antifongique de cellules au sein des biofilms.
Résumé
Candida albicans reste la cause la plus fréquente des infections fongiques chez une population en expansion des patients compromise et la candidose est maintenant le troisième plus fréquente d'infection dans les hôpitaux américains. Différentes manifestations de la candidose sont associés à la formation de biofilm, à la fois sur tissus de l'hôte et / ou des dispositifs médicaux (cathéters par exemple). La formation du biofilm porte négatives implications cliniques, comme les cellules dans le biofilm sont protégées par des réponses immunitaires de l'hôte et de l'action des antifongiques. Nous avons développé un modèle simple, rapide et robuste in vitro pour la formation de C. biofilms albicans aide de 96 puits de microtitration-plaques, qui peut également être utilisé pour tester la sensibilité aux antifongiques biofilm. La lecture de ce dosage est colorimétrique, basée sur la réduction du XTT (un sel de tétrazolium) par les cellules métaboliquement active biofilm fongique. Une expérience typique dure environ 24 h pour la formation de biofilms, avec un supplément de 24 h pour les tests de sensibilité aux antifongiques. En raison de sa simplicité et l'utilisation de matériel de laboratoire couramment disponibles et des équipements, cette technique démocratise la recherche biofilm et représente une étape importante vers la normalisation des tests de sensibilité aux antifongiques des biofilms fongiques.
Protocole
1. Préparation de C. albicans
C. albicans est un microorganisme 1/BSL1 des risques du Groupe. Rappelez-vous toujours à la bonne utilisation des techniques aseptiques / stériles pour travailler avec ce micro-organisme et de suivre les procédures institutionnelles pour l'élimination appropriée des matériaux biologiques dangereux.
- Préparer une culture de nuit de C. albicans dans YPD (levure-peptone dextrose) milieu liquide en inoculant une seule colonie de C. albicans dans 25 ml de YPD.
- Incuber la culture dans un agitateur orbital (environ 180 rpm) à 30 ° C pendant la nuit. C. La plupart des albicans souches augmentera à mesure que les cellules de levure dans ces conditions.
- Centrifuger les cultures de la nuit (environ 3000 rpm, 5-10 minutes), se laver les cellules deux fois avec du PBS stérile, et remettre le culot final dans environ 20-25 ml de milieu RPMI 1640 tamponné avec 165 mM d'acide morpholinepropanesulfonic à pH 7,0 et préchauffé à 37 ° C (à partir de maintenant sur ce milieu est appelé simplement "RPMI 1640").
- Compter les cellules en utilisant un hématimètre. Après le dépouillement, préparer une suspension de cellules à une densité finale de 1,0 x 10 6 cellules / ml dans du RPMI 1640.
Remarque: Parce que les cellules ont tendance à s'agréger, il est important de vortexer vigoureusement entre les lavages et avant le pipetage.
2. Configuration de la plaque de 96 puits de microtitration pour la formation du biofilm
- En utilisant une pipette multicanaux ajouter 100 uL de C. la suspension albicans dans les puits sélectionnés de la plaque de 96 puits de microtitration (-s). Ne pas ajouter des cellules à des puits dans la colonne 12, car ceux-ci servent de témoins négatifs.
- Recouvrir la plaque de microtitration entière avec son couvercle d'origine, joint avec du parafilm, place à l'intérieur d'un incubateur et incuber pendant 24 h à 37 ° C. La durée d'incubation peut être adapté à la conception spécifique expérimentale. Par exemple, il est possible d'examiner la cinétique de formation d'un biofilm sur une période de 24 - 48 heures par ensemencement des plaques multiples et le traitement de chaque plaque à différents moments (c. 2, 4, 8, 12, 24 et 48 h)
- Après la formation du biofilm, à l'aide d'une pipette multicanaux aspirer le support de soin que de ne pas toucher et perturber le biofilm qui se sont formés dans chacun des puits.
- En utilisant une pipette multicanaux plaques laver trois fois dans du PBS stérile (200 ul par puits). Sinon, utilisez une rondelle de microtitration automatisé assiette. Entre les lavages, et notamment après le dernier lavage, égouttez les plaques en position inversée en épongeant avec du papier absorbant pour enlever tout résidu de PBS. A ce point biofilms formés sur le fond des puits doit être clairement visible, même à l'œil nu et peut également être visualisés à l'aide d'un microscope inversé (figure 1). Les biofilms sont maintenant prêts à être traitées pour des dosages des tests de sensibilité antifongique.
(Si le but principal de l'expérience est d'évaluer l'étendue de la formation de biofilms, les plaques sont prêtes à être traitées en utilisant la méthode colorimétrique. Pour cela, le réactif XTT / ménadione (voir l'étape 3 ci-dessous) peuvent être ajoutés et la couleur résultante lus en utilisant un lecteur de plaque de microtitration).
3. Test de sensibilité aux antifongiques des biofilms
- Des solutions stock ou en poudre, préparer une solution de travail en milieu RPMI 1640 de chaque antifongiques à tester. Typiques des concentrations élevées sont 1024 pg / ml pour le fluconazole, et 16 pg / ml à la fois pour l'amphotéricine B et la caspofungine. D'autres concentrations peuvent être utilisées pour différents agents.
- En utilisant une pipette multicanaux, ajouter 200 ul de la forte concentration de travail des antifongiques dans les puits correspondants dans la colonne 1 de chaque plaque de microtitration contenant des biofilms fongiques.
- Ajouter 100 ul de RPMI 1640 à chacun des puits dans les colonnes 2 à 10.
- Ajouter 100 ul de RPMI 1640 aux puits dans la colonne 11.
- Retirer 100 uL d'agent antifongique dans les puits de la colonne 1 et l'ajouter au puits adjacents dans la colonne 2 (contenant déjà 100 ul de milieu).
- Mélangez le contenu bien par aspiration et refoulement d'effectuer une double dilution en série, et de supprimer les pointes.
- Répétez jusqu'à ce que le déplacement vers la droite des puits de la colonne 10, après quoi la finale du 100 volumes uL dans les puits de la colonne 10 après le mélange est jeté. De cette façon, une série de dilutions de votre agent (-s) d'intérêt ont été créés; de la plupart concentrées dans les puits de la colonne 1 de moins concentrées dans les puits de la colonne 10. Biofilms incontesté dans la colonne 11 servira de contrôles positifs, et les puits vides dans la colonne 12 servira de contrôles négatifs.
- Couvrir les plaques avec leur couvercle, joint avec du parafilm et incuber pendant 24 h -48 à 37 ° C.
- Après la période d'incubation, laver les assiettes que dans l'étape 2.4 avant (3 x PBS).
- En utilisant une pipette multicanaux ajouter 100 ul de XTT / ménadione solution à chaque puits contenant un biofilm pré-lavés ainsi que les puits de contrôle négatif pour la mesure de X de fondTT-colorimétrique niveaux.
- Le XTT est préparée comme une solution saturée à 0,5 g / L dans le lactate de Ringer stérile, PBS ou de solution saline, qui doit être stérilisée par filtration en utilisant un filtre de 0,22 um de taille des pores. La solution est sensible à la lumière XTT, donc il devrait être couvert avec du papier aluminium pendant la préparation. Une fois préparé et stérilisé par filtration, partie aliquote dans 10 mL volumes de travail, et conserver à -70 ° C. Protéger les tubes de la lumière en utilisant du papier d'aluminium. Décongelez uniquement comme de nombreux tubes comme nécessaire pour une expérience particulière, juste avant utilisation.
- Ménadione est préparée comme une solution à 10 mM dans l'acétone à 100%, répartie dans des petits volumes (environ 50 pi) et conservés à -70 ° C. Préparer la solution XTT / ménadione juste avant l'utilisation, en ajoutant 1 pl de la solution stock de ménadione dans un tube contenant 10 ml de la solution XTT décongelé.
- Couvrir les plaques dans du papier aluminium et laisser incuber dans l'obscurité pendant 2 h à 37 ° C.
- Découvrez les assiettes. En utilisant une pipette multicanaux retirer 80 ul du surnageant résultant de couleur de chaque puits et le transfert dans les puits correspondants d'une plaque de microtitration nouvelles.
- Lire la plaque (-s) dans un lecteur de microplaque à 490 nm.
- Calculer les concentrations minimales inhibitrices sessiles SMIC50 et SMIC80, qui sont les concentrations antifongiques au cours de laquelle une diminution de 50% ou 80% dans les lectures colorimétriques sont détectés en comparaison avec le contrôle des biofilms formés en l'absence de médicament antifongique (dans ce cas les valeurs de la colonne 11 , rappelez-vous aussi à soustraire des valeurs de contrôle négatif à partir de puits dans la colonne 12 contenant XTT seulement). Les résultats du SMIC peut être présenté comme un tableau (ie multiples contre des isolats antifongiques multiples) ou, alternativement, les résultats individuels pour chaque champignon d'isoler les uns contre les antifongiques peuvent être présentés sous forme de graphique en traçant la concentration d'inhibition pour cent par rapport antifongique.
Exemple: Après avoir soustrait les valeurs dans le contrôle négatif, la DO moyenne de biofilms formés de contrôle dans la colonne 11 est de 1,32. Le SMIC50 est la plus faible concentration antifongique conduisant à une réduction> 50% dans les lectures colorimétriques, dans ce cas moins de 1,32 x 50 / 100 = 0,66. De même, le SMIC80 est la plus faible concentration antifongique conduisant à une réduction> 80% dans les lectures colorimétriques, dans ce cas moins de 1,32 x 20/100 = 0.264.
4. Les résultats représentatifs
La figure 1 montre une microphotographie d'un C. albicans biofilm formé sur le fond d'un puits dans une plaque de microtitrage à 96 ainsi prises à l'aide d'un microscope inversé. La figure 2 montre XTT-colorimétrique des lectures (DO 490 valeurs) pour chacun des 11 biofilms d'un C. souche de type sauvage albicans formé dans chacune des huit lignes différentes de la même plaque de microtitration 96 puits. La figure 3 montre l'activité de l'amphotéricine B à des concentrations différentes contre C. albicans biofilms; flèches indiquent SMIC50 et SMIC80 valeurs.

La figure 1 (A). Panneau A montre une microphotographie prise avec une caméra reliée à un microscope inversé d'un C. albicans biofilm formé sur le fond du puits après aspiration du milieu RPMI et lavages successifs au PBS. (B) une micrographie d'un typique C. albicans biofilm visualisé par microscopie électronique à balayage. Les bars sont 100 um et 10 um pour les panneaux A et B respectivement.
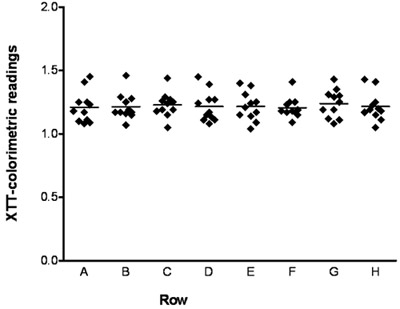
Figure 2. Formation de multiples équivalents C. albicans biofilms dans les plaques 96 puits de microtitration. lectures colorimétriques (DO 490 valeurs) à partir de réduction des dosages XTT des biofilms formés par un C. albicans type sauvage dans des puits de microplaques. Les valeurs sont indépendantes de 11 biofilms formés dans chacune des huit lignes différentes de la même plaque de microtitration 96 puits. Résultats pour les différentes lignes ont été comparés par une analyse de variance et en utilisant le test de Bartlett pour l'homogénéité des variances et des comparaisons multiples de Bonferroni du post-test. Aucune différence statistiquement significative n'a été notée en comparant toutes les paires de lignes à l'autre (p> 0,05).
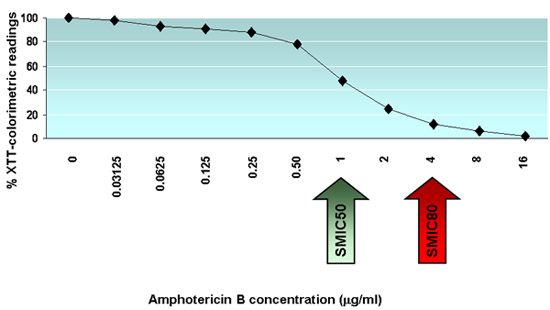
Figure 3. Les résultats typiques des tests de sensibilité antifongique contre C. albicans biofilms. graphique illustrant les résultats typiques de l'efficacité de différentes concentrations d'amphotéricine B contre les biofilms d'un C. souche de type sauvage albicans. Les valeurs sont exprimées en pour cent en moyenne des lectures colorimétriques pour XTT de réduction par rapport aux tests de contrôle de puits. SMIC50 et SMIC80 valeurs sont indiquées par des flèches.
Discussion
Nous décrivons ici un moyen simple, rapide, économique et hautement reproductibles 96 modèle bien microplaque pour la formation de biofilms à Candida couplée à une méthode colorimétrique qui mesure l'activité métabolique des cellules au sein du biofilm en utilisant XTT. Ce modèle bien 96 microplaque pour la formation de biofilms a été initialement développé pour C. albicans, mais peut être utilisé pour d'autres espèces de Candida. et facilement adaptable à d'autr...
Déclarations de divulgation
Remerciements
Biofilm liés travailler dans le laboratoire est financé par des subventions et numérotées R21DE017294 R21AI080930 de l'Institut national de recherche dentaire et craniofaciale et l'Institut national des maladies allergiques et infectieuses (pour JLL-R.). Le contenu est uniquement la responsabilité de leurs auteurs et ne représentent pas nécessairement les vues officielles de l'NIDCR, le NIAID ou du NIH.
matériels
| Name | Company | Catalog Number | Comments |
| Sabouraud-dextrose agar | BD Biosciences | 211584 | To prepare plates for fresh subcultures of fungal isolates |
| YPD: Yeast peptone dextrose | US Biological | Y2076 | Medium for propagation of overnight liquid cultures |
| RPMI-1640 without sodium bicarbonate supplemented with L-glutamine | Cellgro | 50-020-PB | Liquid medium for biofilm formation |
| Morpholinepropanesulfonic acid (MOPS) | Fisher Scientific | BP308 | To buffer RPMI 1640 |
| Phosphate buffered saline, PBS | Sigma-Aldrich | P4417 | Buffer for washes |
| XTT sodium salt | Sigma-Aldrich | X4251 | See above for preparation instructions |
| Ringer’s lactate | Hospira Inc. | NDC0409-7953-09 | For preparation of XTT solution |
| Menadione | Sigma-Aldrich | M5625 | Caution: hazardous by skin contact, inhalation or ingestion |
| Petri dishes | Fisher Scientific | 08-757-12 | |
| 15 ml conical centrifuge tubes | Corning | 430790 | |
| 50 ml conical centrifuge tubes | Corning | 430828 | |
| 96 well microtiter plates: Polystyrene, flat-bottomed, tissue culture treated | Corning | 3595 | |
| Multichannel pipette and tips | Eppendorf | ||
| Incubator | Any Supplier | ||
| Microtiter plate reader | Any Supplier |
Références
- Bachmann, S. P. In vitro activity of caspofungin against Candida albicans biofilms. Antimicrob Agents Chemother. 46, 3591-3596 (2002).
- Hawser, S. P., Norris, H., Jessup, C. J., Ghannoum, M. A. Comparison of a 2,3-bis(2-methoxy-4-nitro-5-sulfophenyl)-5-[(phenylamino)carbonyl]-2H-t etrazolium hydroxide (XTT) colorimetric method with the standardized National Committee for Clinical Laboratory Standards method of testing clinical yeast isolates for susceptibility to antifungal agents. J Clin Microbiol. 36, 1450-1452 (1998).
- Kuhn, D. M., Balkis, M., Chandra, J., Mukherjee, P. K., Ghannoum, M. A. Uses and limitations of the XTT assay in studies of Candida growth and metabolism. J Clin Microbiol. 41, 506-508 (2003).
- Kuhn, D. M., George, T., Chandra, J., Mukherjee, P. K., Ghannoum, M. A. Antifungal susceptibility of Candida biofilms: Unique efficacy of amphotericin B lipid formulations and echinocandins. Antimicrob. Agents Chemother. 46, 1773-1780 (2002).
- Nobile, C. J., Mitchell, A. P. C. albicans transcription factor Bcr1p: a regulator of cell-surface genes and biofilm formation. Current Biol. 15, 1150-1155 (2005).
- Ramage, G., Saville, S. P., Thomas, D. P., Lopez-Ribot, J. L. Candida biofilms: an update. Eukaryot Cell. 4, 633-638 (2005).
- Ramage, G., Vande Walle, K., Wickes, B. L., p, B. L., Lopez-Ribot, J. L. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms. Antimicrob Agents Chemother. 45, 2475-2479 (2001).
- Bachmann, S. P. Antifungal combinations against Candida albicans biofilms in vitro. Antimicrob Agents Chemother. 47, 3657-3659 (2003).
- Ramage, G., VandeWalle, K., Bachmann, S. P., Wickes, B. L., Lopez-Ribot, J. L. In vitro pharmacodynamic properties of three antifungal agents against preformed Candida albicans biofilms determined by time-kill studies. Antimicrob Agents Chemother. 46, 3634-3636 (2002).
- Ramage, G., VandeWalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Rev. Iberoam. Micol. 18, 163-170 (2001).
- Tellier, R., Krajden, M., Grigoriew, G. A., Campbell, I. Innovative endpoint determination system for antifungal susceptibility testing of yeasts. Antimicrob Agents Chemother. 36, 1619-1625 (1992).
- Nett, J., Andes, D. Candida albicans biofilm development, modeling a host-pathogen interaction. Curr Opin Microbiol. 9, 340-345 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon