Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Culture organotypique d'exprimant la GFP embryons de souris pour les images en temps réel d'excroissance des nerfs périphériques
Dans cet article
Résumé
Nous présentons une méthode pour préparer les tranches organotypiques d'embryons de souris mi-gestation pour la culture et de l'imagerie time-lapse d'excroissance des nerfs périphériques.
Résumé
Pour de nombreux usages, la culture de la souris ex vivo des embryons en tranches organotypiques est souhaitable. Par exemple, nous employons une lignée de souris transgéniques (tauGFP) dans lequel la version améliorée de la protéine fluorescente verte (EGFP) est exclusivement exprimé dans tous les neurones du système nerveux central en développement et périphérique 1, donnant la possibilité à la fois film de l'innervation du la patte avant et de manipuler ce processus avec des techniques pharmacologiques et génétiques 2. Le paramètre le plus critique dans la culture réussie des cultures tranche telle est la méthode par laquelle les tranches sont préparées. Après de nombreux essais sur une variété de méthodes, nous avons constaté qu'un vibratome est le meilleur dispositif possible de couper les embryons tels qu'ils systématiquement lieu à une culture qui démontre la viabilité sur une période de plusieurs jours, et surtout, se développe dans un âge de manière spécifique. Pour la mi-gestation d'embryons, ce qui inclut l'excroissance normale des nerfs rachidiens de la moelle épinière et les ganglions de la racine dorsale de leurs objectifs dans la périphérie et la détermination adéquate des tissus squelettiques et musculaires.
Dans ce travail, nous présentons une méthode pour le traitement des embryons entiers de jour embryonnaire (E) E10 à E12 dans 300 à 400 tranches micrométrique pour la culture dans une norme incubateur de culture tissulaire, ce qui peut être étudiée pour un maximum de deux jours après la préparation tranche. Critique pour le succès de cette approche est l'utilisation d'un vibratome de découper chaque embryon agarose embarqués. Elle est suivie par la culture des tranches sur les inserts de culture Millicell membrane placée sur un petit volume de milieu, résultant en une technique de culture de l'interface. Une litière avec une moyenne de 7 embryons produit régulièrement au moins 14 tranches (2-3 tranches de la région forelimb par embryon), qui varie légèrement en raison de l'âge des embryons ainsi que de l'épaisseur des tranches. Environ 80% des tranches de culture montrent prolongement nerveux, qui peut être mesurée througout les 2 période de culture. Les résultats représentatifs en utilisant la lignée de souris tauGFP sont démontrés.
Protocole
Partie 1: Préparation pour le tranchage et la culture.
- Préparer de 10 cm des plaques de culture tissulaire avec le tranchage (DMEM, 25% 1x HBSS, 25% de sérum de veau fœtal, 0,5% de glucose, 1 mM de glutamine, 2,5 mM d'HEPES, pH 7,3) et de 3 cm Millicell-CM de 0,4 um de la culture inserts membrane et garder à l'étuve à 37 ° C et 5% de CO 2.
- Chauffer jusqu'à 4% d'agarose à faible point de fusion dans du PBS dans le micro-ondes et le garder sur la plaque chauffante de sorte qu'il reste à environ 37 ° C.
- Remplir de 10 cm bactériologiques des boîtes de Petri avec du PBS (140 mM NaCl, 2,7 mM de KCl, 10 mM Na 2 HPO 4, 1.8mm KH 2 PO 4) et placer sur la glace.
- Mettre en place des dispositif de refroidissement microtome ou veiller à ce plateau de tampon et de refroidissement des éléments sont stockés dans le congélateur pour pré-refroidir.
Partie 2: intégration de l'embryon.
- Disséquer embryons dans l'utérus et les examiner avec un microscope inversé fluorescentes pour vérifier expression de la GFP.
- Embryons Placer sur une assiette inversée de 10 cm de Petri et les orienter en utilisant des bandes de papier Whatman pour enlever excessive PBS.
- Appliquer agarose sur l'embryon pour le fixer dans cette position. Laissez-agarose solidifier.
- Limite de la zone entourant l'embryon en le coupant avec une lame de rasoir.
- Tournez l'embryon embarqué sur son autre côté.
- Appliquer supplémentaires agarose sur des tissus embryonnaires afin de s'assurer que l'embryon est complètement noyé.
- Préparer bloc d'agarose avec des bords nets et monter sur vibratome Chuck utilisant Loctite 406, une colle spéciale similaires à "Krazy Glue".
Partie 3: Trancheuse procédure.
- Mettre en place le plateau de tampon prérefroidi et l'élément de refroidissement.
- Insérer le mandrin avec le tissu collé et ajoutez 1x HBSS (Ca 2 +-Mg 2 + sans HBSS, 10 mM HEPES pH du tampon 7,3, à 500 U / ml de pénicilline / streptomycine) jusqu'à couverts.
- Insérer et fixer une lame de microtome préalablement nettoyées (70% éthanol).
- Préparer 350 à 450 um tranches et le transfert de les utiliser raccourcie en verre Pipettes Pasteur en plaques de culture de tissus conservés sur la glace.
- En utilisant une paire de pinces, enlevez soigneusement agarose de chaque tranche et transfert à Millicell membranes culture. Environ 4 tranches peuvent être cultivées sur une membrane dans une plaque de 10 cm de culture de tissu rempli de 6 mL de milieu de culture.
- Incuber les tranches à 37 ° C et 5% de CO 2 (milieu de culture: DMEM, 25% 1x HBSS, 25% sérum de veau fœtal, 0,5% de glucose, 1 mM de glutamine, 2,5 mM d'HEPES, pH 7,3). Si on effectue imagerie time-lapse séries on devrait garder le volume de la constante de moyenne. Dans le cas de l'imagerie chronométré série pour un court laps de temps, il suffit de laisser le milieu tel qu'il est. Pour les périodes de culture plus des changements après 12-20 heures est recommandé.
Partie 4: prolongement d'imagerie du nerf spinal au microscope.
- Nerfs spinaux image plaçant une plaque de 10 cm de culture de tissus, contenant des membranes de la culture avec des tranches de Millicell, sous un microscope droit fluorescentes.
- Etiquette de l'orientation des membranes de la culture Millicell sur scène microscope pour positionner correctement le point lors de l'imagerie en temps prochain.
- Prolongement du nerf rachidien à l'aide d'images 4x (ouverture numérique [NA] 0,1), 10x (NA 0,3) ou 20x (NA 0,5) objectifs.
La figure 1 montre une série d'imagerie dépeignant l'excroissance du nerf spinal pendant 20 heures de culture avec des objectifs 4x et 10x.
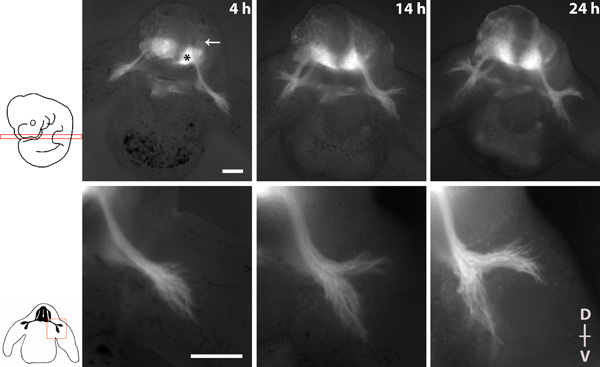
Figure 1 série d'imagerie d'excroissance du nerf spinal dans une tranche transversale d'un embryon homozygote tauGPF. * = Motoneurones de la moelle épinière ventrale, flèche = DRG. La dorsale (D)-ventral (V) l'axe de la tranche est indiquée. Barres d'échelle: 200 um.
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans une comparaison approfondie des méthodes pour préparer des cultures tranche embryonnaire des embryons de souris mi-gestation (E10 - E12), nous avons observé qu'un vibratome produit sans doute les résultats les plus fiables en ce qui concerne à la fois à la viabilité globale de la culture et la reproductibilité des les modèles de prolongement nerveux. En revanche, les tranches préparés en utilisant un hachoir de tissu McIlwain 3 s'est révélée être totalement non viables. Nous avions...
Access restricted. Please log in or start a trial to view this content.
Remerciements
Les auteurs reconnaissent la source d'origine de l'idée d'effectuer la culture à la tranche de 5 embryons de souris. Nous tenons à remercier Joachim Kirsch pour le soutien scientifique et généreux Anna Degen pour agir comme notre Gofer pendant le tournage. Ce travail a été financé par la Fondation allemande de recherche (Deutsche Forschungsgemeinschaft: Sonderforschungsbereich 488, Teilprojekt B7/B9) et l'Université de Heidelberg (Excellence Cluster réseaux cellulaires).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
Références
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon