Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie en temps réel des leucotriènes B 4 Cell Mediated et BLT1 Interactions avec β-arrestine
Dans cet article
Résumé
Ce document décrit la méthodologie pour déterminer la réponse chimiotactique des leucocytes à des ligands spécifiques et d'identifier les interactions entre les récepteurs de surface cellulaire et des protéines cytosoliques en utilisant des techniques d'imagerie cellulaire direct.
Résumé
Récepteurs couplés aux protéines G (RCPG) appartiennent à la famille de sept transmembranaire de protéines et de médiation de la transduction des signaux extracellulaires à des réponses intracellulaires. RCPG de contrôle diverses fonctions biologiques telles que le chimiotactisme, la libération de calcium intracellulaire, la régulation des gènes d'une manière dépendante du ligand via protéines G hétérotrimériques 1-2. Liaison du ligand induit une série de changements conformationnels conduisant à l'activation des protéines G hétérotrimériques qui modulent les niveaux de seconds messagers tels que l'adénosine monophosphate cyclique (AMPc), inositol triphosphate (IP3) et du glycérol diacyle (DG). Concomitante avec l'activation de la liaison d'un ligand du récepteur initie également une série d'événements afin d'atténuer le récepteur signalisation via la désensibilisation, la séquestration et / ou l'internalisation. Le processus de désensibilisation des RCPG se fait via la phosphorylation du récepteur par des kinases des récepteurs aux protéines G (GRK) et se fixer des β-arrestines 3. β-arrestines sont des protéines cytosoliques et la translocation de la membrane lors de l'activation de GPCR, la liaison aux récepteurs phosphorylés (la plupart des cas), il en facilitant 4-6 internalisation du récepteur.
Leucotriènes B 4 (LTB 4) est une molécule lipidique pro-inflammatoire dérivé de l'acide arachidonique et voie médie ses actions via les RCPG, LTB 4 récepteurs 1 (BLT1; un récepteur de haute affinité) et LTB 4 receptor 2 (BLT2; un récepteur à faible affinité ) 7-9. Le LTB 4-BLT1 voie a été montré pour être critique dans plusieurs maladies inflammatoires, notamment, l'asthme, l'arthrite et l'athérosclérose 10-17. Le présent document décrit les méthodologies développées pour surveiller LTB4 induite par la migration des leucocytes et les interactions des β-BLT1 avec arrestine et la translocation des récepteurs dans les cellules vivantes en utilisant des techniques d'imagerie microscopique 18-19.
La moelle osseuse des cellules dendritiques dérivées des souris C57BL / 6 ont été isolées et cultivées comme décrit précédemment 20-21. Ces cellules ont été testés en direct des méthodes d'imagerie cellulaire pour démontrer LTB 4 migration cellulaire induite. Le BLT1 humaine a été marqué avec la protéine fluorescente rouge (BLT1-DP) en C-terminal et β-arrestin1 tagués avec la protéine fluorescente verte (β-arr-GFP) et les plasmides transfectés dans les deux Rat basophiles Leukomia (RBL-2H3) des lignées cellulaires 18-19. La cinétique de l'interaction entre ces protéines et la localisation ont été surveillés à l'aide en direct vidéo-microscopie cellulaire. Les méthodologies dans le présent document décrit l'utilisation de techniques microscopiques pour étudier les réponses fonctionnelles de G récepteurs couplés aux protéines dans les cellules vivantes. Le présent document décrit également l'utilisation de logiciels Metamorph pour quantifier l'intensité de la fluorescence pour déterminer la cinétique de récepteurs et les interactions entre protéines cytosoliques.
Protocole
Méthodologie
Description du microscope
En direct des expériences d'imagerie cellulaire réalisée à l'aide de TE-FM épifluorescence système attaché à Nikon Eclipse TE300 microscope inversé. Le microscope équipé d'étape de chauffage. Une fraîche pression HQ numériques CCD N / B (Roper Scientific) caméra et LAMDA 10-2 filtre optique changeur (fabricant de l'appareil Sutter) est attaché à microscope. Longueurs d'onde d'excitation et d'émission sont contrôlés avec des roues de filtre et contrôlé par Lamba 10-2 contrôleur de roue à filtres, Sutter Instruments Co. Temps d'exposition de 500 ms devrait être suffisant pour voir DP ou GFP dans les cellules vivantes. Le contrôle du matériel et l'acquisition d'images sont contrôlés par le logiciel Metamorph. Le choix des filtres pour la présente étude sont, filtre fixe S480/20x, S525/40m et S565/25x, S620/60m pour la GFP et DP, respectivement; EGFP / DsRed dual dichroïque, technologie Chroma. Cette roue à filtres peut accueillir jusqu'à six ensembles de filtres. Microscope est attaché avec contrôleur étape préalable Proscan avec joystick. Tous ces attachements matériels peuvent être contrôlés par le logiciel Metamorph. Le microscope est également jointe avec Micromanipulateurs pour tenir le micropipettes.
A. Mesure des leucotriènes B 4 migration dirigée des cellules dendritiques
Utilisation de la mise en microscopie décrites ci-dessus, nous avons développé des méthodes pour la suite ligand migration dirigée des cellules dendritiques en temps réel. Deux micromanipulateurs (Narishige) sont attachés à la loupe. Le chimiotactisme de la moelle osseuse de souris des cellules dendritiques dérivées (BMDCs) vers LTB 4 gradient a été enregistré. Ici, nous décrivons les méthodes pour préparer le micro-pipettes utilisant des micro-pipette extracteur, le chargement du ligand dans les micro-pipette et la mise en place de l'expérience chimiotactisme sur la scène chauffée du microscope pour contrôler la migration directionnelle des cellules. Cette méthode peut être appliquée pour tester l'efficacité des chimiotactiques distinctes dans l'induction de la migration ainsi que l'effet des inhibiteurs de la chimiotaxie des cellules vivantes. L'isolement des BMDCs 21 de la souris a été décrit dans plusieurs publications dont JoVE 22.
1. Préparation de BMDCs
- Plate BMDCs (après culture pendant 10 jours) sur le plat lamelle Fluoro bas et leur permettre de croître pendant 16 heures d'avance sur l'expérience.
- Laver les cellules avec 3 mL de PBS 1X au moins 2 fois (en ajoutant 3 ml de PBS 1X à la plaque et l'aspiration de la sortie du tampon).
- Ajouter 2 mL de 1XPBS à l'assiette. Les cellules sont maintenant prêts pour l'expérience. Gardez les cellules de 37 ° C avant d'incubateur d'expérience.
Préparation du ligand chargés micro pipette:
- Fixer les tubes capillaires en verre (verre standard, 0,75 mm x 0,4 mm; 6 ", Cat # 625500, AM Systems, Inc) sur la verticale extracteur micropipette (Narishige International USA, Inc.)
- Maintenir la température à 52 ° C et laisser le verre pour faire fondre et séparer pour former des conseils tranchant.
- Fixer la pipette sur le support micro-pipette.
- Lisse les aspérités de la pipette à l'aide de micro Micro forger M-900 (Narishige International USA, Inc) en regardant sous le microscope.
- Préparer au moins 10-20 pipettes pour chaque expérience. Remarque: Les micropipettes peuvent également être achetés à partir d'instruments de précision du monde (TIP μ, T1801TW1F).
- Prenez concentration souhaitée (500 uL de 100 nM LTB 4 dans l'expérience actuelle) du ligand dans 1 ml effendorf tube et conserver la pointe de la pipette de micro dans la solution et permettre à la solution d'entrer dans la pipette de micro (remblayage).
- Prélever 1 ml de ligand et dans la seringue (1 cc de tuberculine seringue) lentement et remplissez le ligand à l'aide de micro-aiguilles Remplir (MF 28G-5, Instruments de précision mondiale) dans la pipette de micro, de haut.
- Fixez le tuyau, ce qui correspond étroitement à la pipette à la pipette et le tube de l'aiguille (21 G 11 / 2) attaché à seringue de 1 mL, qui est rempli avec le ligand.
- Maintenant, déplacez le ligand attentivement remplie de micro-pipette à la platine du microscope et de fixer sur des micro manipulateurs.
- Appliquer peu de pression de la seringue pour faire ligand sûr, c'est libérant lentement de la pointe.
- Amener le BMDCs plaqués immatures au microscope et de les garder sur la plaque chauffée (37 ° C) étape.
- Retirez le couvercle du plat fluorées.
- Concentrer les cellules en utilisant l'huile à immersion lentille d'objectif 60X.
- Soigneusement, faire tomber le ligand chargés pipette à l'aide «grossier manipulateur manuel MN-188NE 'à la proximité des cellules.
- Concentrer l'aide de la pipette »micromanipulateur hydraulique Beaux-MN-188 NE».
- Appliquer peu de pression de la seringue pour s'assurer que ligand est la libération dans le plat.
- Définissez les paramètres d'acquisition d'image à acquérir dans les brillantes déposée (exposition de 10 ms) dans toutes les 15 secondes pendant 2 heures en utilisant le logiciel Metamorph.
- Gardez surveillance toutes les 30 min pour la progression de migration vers le ligand.
- Si les cellules sont surpeuplées à l'extrémité de la pipette, changer l'emplacement de l'extrémité de la plaque pour continuer la migration de l'expérimentation.
B. Mesure GPCR (BLT1) et protéine cytosolique (β-arrestine) Interactions, la translocation dans les cellules vivantes
1. Préparation de constructions d'ADN plasmidique
Les détails de constructions d'ADN plasmidique ont été décrites dans Jala et al. (2005) 18.
2. La transfection de l'homme BLT1-DP et β-arrestines-GFP dans les cellules RBL-2H3
- Maintenir le Rat basophiles Leukomia (RBL-2H3) Cellules (60 à 70% de confluence) à 37 ° C dans une atmosphère humidifiée de 95% d'air, 5% de CO 2 en tant que cultures monocouches dans un milieu de croissance (DMEM supplémenté avec 15% de FBS, 2 mM de L-glutamine, 100 U / ml de pénicilline et 100 pg / mL de streptomycine) dans des flacons T75.
- Détacher les cellules de la boîte / flacons en utilisant 6 ml de trypsine-EDTA (0,05% de trypsine, 0,53 mM EDTA) et incubation pendant 5 min à 37 ° C dans une atmosphère humidifiée de 95% d'air, 5% de CO 2. Secouez doucement les flacons de surveiller l'ampleur de détachement des cellules.
- Ajouter 6 mL de milieu de croissance au flacon contenant 6 ml de trypsine-EDTA et recueillir les cellules en les mélangeant par pipetage de haut en bas plusieurs fois. Transférer les cellules dans des tubes de 15 ml Falcon.
- Compter les cellules en utilisant un hémocytomètre et prendre 4 x 10 6 cellules dans 15 tubes à centrifuger ml et centrifuger à 480g rpm pendant 3 minutes et de remettre en suspension dans 200 uL de médias de transfection (DMEM, 20% de FBS, HEPES 50 mM). Si vous prévoyez d'effectuer trois transfections, préparer les cellules et les médias transfection en conséquence par le nombre de cellules augmente et le volume du milieu de transfection.
- Préparer les plasmides transfectés à des concentrations d'au moins 1,5 ug / uL. Nous préparons l'ADN plasmidique en utilisant l'ADN plasmidique Maxi kit QIAGEN. Ajouter l'individu ou les deux ADN plasmide codant pour l'homme BLT1-DP (25 ug) et β-arrestin1-GFP (15 ug) de cuves d'électrophorèse stérile, (Bio-Rad # 16552088), qui a 0,4 cm écartement des électrodes.
- Prenez 200 ul de cellules en suspension au-dessus et de les placer dans des cuvettes contenant soit hBLT1-DP ou β-arrestin1-GFP ou les deux ensemble et les mélanger délicatement avec une pipette stérile mL.
- Laisser les cuvettes ci-dessus à température ambiante pendant 10 min.
- Électroporation dans les cellules Gene Pulser II avec une tension de 250 V et la capacité de 500 pF.
- Après électroporation laisser les cellules restent à température ambiante pendant 10 min.
- Prélever 1 ml de milieu de croissance régulière et le mélanger avec des cellules par électroporation dans les cuvettes.
- Distribuer 300 uL de ce mélange dans des boîtes de 35 mm de tissu de verre culture sur le fond (plat fluoro, Instruments de précision mondiale) contenant 2 mL de milieu de croissance régulière et incuber pendant 1 heure à 37 ° C dans une atmosphère humidifiée de 95% d'air, 5% de CO 2. Laisser les cellules adhèrent au fond du plat.
- Remplacez le support après 1 h d'incubation avec une croissance régulière des médias et leur permettre de croître à 37 ° C dans une atmosphère humidifiée de 95% d'air, 5% de CO 2 incubateur pendant 18-24 heures.
3. Imagerie de cellules vivantes
Acquisition d'images
- Après 18-24 heures, laver les cellules 2 ou 3 fois avec 2 ml d'eau tiède rouge de phénol contenant du RPMI sans HEPES 10 mM, pH 7,55 (Ajouter 2 mL de milieu chaud directement à l'assiette et les médias aspirer. Répétez 2 ou 3 fois). Ajouter 1,8 ml de phénol chaude RPMI rouges gratuite contenant 10 mM HEPES.
- Placer 30 mm plats en verre à fond la culture lamelle contenant cellules RBL-2H3, transfectées avec hBLT1-DP et β-arrestin1-GFP sur la platine du microscope chauffée (37 ° C).
- Recueillir les images à un grossissement de 600x cellulaire utilisant 60 x Objectif Nikon plan Apo 60X/1.4 lentilles numériques d'immersion d'ouverture d'huile (disponible dans notre système de microscope).
- Mettez une goutte d'huile sur la lentille 60 x objectif et de concentrer les cellules avec le champ lumineux régulier lumière transmise en touchant le fond de la plaque.
- Pour surveiller la fluorescence des protéines transfectées, passer de champ lumineux (lumière transmise) à la fluorescence de filtre (DP filtre, si vous voulez voir des récepteurs ou GFP, si vous voulez voir β-arrestin1).
- Choisissez la cellule brillant et sain, qui exprime hBLT1-DP sur la surface de la cellule en utilisant DP filtre et capturer l'image.
- Puis passage à la GFP de filtre et de s'assurer que β-arrestine-GFP exprimée dans le cytoplasme et capturer l'image. Puis pseudo couleur à la fois les images, avant que le temps écoulé capturer des images de cellules vivantes pour s'assurer que saigner à travers de la fluorescence n'est pas en prenant survenant entre DP et GFP.
- Une fois le choix de votre cellule fait, définissez les paramètres en fonction de votre objectif en utilisant un logiciel (Software Metamorph dans ce cas).
- Dans la démonstration actuelle, seize images bits sont acquises avec la venuemis en binning ra à 1 X 1 combiné avec l'objectif 60 du Plan X Nikon Apo 60X/1.4 lentilles numériques d'immersion d'ouverture de pétrole.
- Recueillir les images de fluorescence pour DP et fluorochromes GFP simultanément à 30 intervalle de temps sec (si les interactions translocation / sont trop rapides, on peut réduire les intervalles de temps) de ces roues en utilisant un filtre contrôlé par un logiciel Metamorph.
- Le temps d'exposition Appareil photo réglé à 1000 ms pour DP et GFP. (Réglez le temps d'exposition spécifique en fonction de l'intensité de fluorescence de DP et GFP).
- D'abord recueillir les images pendant 1 min sans ligand ajoutant, qui sert de point 0 fois.
- Ajoutez les 200 uL de ligand (en stock de 10 uM à une concentration finale de 1 uM) après 1 min sans déranger la plaque / ou position de la cellule.
- Les images de fluorescence sont recueillies pendant 60 min après l'ajout du ligand et stocké sous forme d'images TIFF avec l'ordre croissant des noms de fichiers.
- Tous ces fichiers peuvent être faites sous forme de fichiers individuels avec pile / combiné des images de fluorescence avec des timbres de temps en utilisant le logiciel.
Processus d'images et de quantification de la fluorescence des protéines et la localisation
- Acquérir les images avec support ordinaire (sans cellules) avec filtres DP et GFP fluorescentes et les enregistrer comme images de fond. Utilisez ces images pour soustraire à partir d'images données réelles obtenues ci-dessus.
- Préparer la pile d'images individuellement pour les images DDP et GFP.
- Sélectionner / définir les différentes régions (surface vs cytosolique) pour mesurer l'intensité de fluorescence de la DP et la GFP (BLT1 et β-arrestine translocation)
- Tracer les intensités de fluorescence selon le montant qu'il en fonction du temps. Ce graphique va fournir les informations sur la cinétique de la translocation de la molécule donnée.
Les résultats représentatifs
A. Mesure des leucotriènes B 4 migration dirigée des cellules dendritiques
La méthode décrite dans ce protocole a été utilisé pour déterminer la migration des cellules dendritiques vers leucotriène B 4 (figure 1 et vidéo ci-jointe 1) 21. Nous pouvons appliquer la même méthodologie pour déterminer la capacité chimiotactique de cellules à un ligand particulier dans les cellules vivantes.
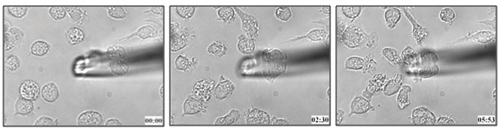
Figure 1. Moelle osseuse de la souris dérivées de migration des cellules dendritiques vers 100 nM LTB 4.
Vidéo 1. Direct la migration cellulaire des BMDCs vers LTB 4. Cliquez ici pour voir la vidéo .
B. Mesure GPCR (BLT1) et protéine cytosolique (β-arrestine) Interactions, la translocation dans les cellules vivantes
A l'issue de cette procédure, on peut obtenir les informations suivantes dans les événements signalisation des RCPG.
- La localisation des RCPG et protéines cytosoliques et le noyau (figure 2).
- Interaction ligand induit de la surface de GPCR (BLT1 dans ce cas) avec des protéines cytosoliques (β-arrestine dans ce cas) (figure 3).
- Cinétique de l'internalisation du récepteur et la β-arrestine translocation vers la membrane suivie d'une internalisation long avec des récepteurs (figure 4) (Jala et al. 2005) 18.
- On peut déterminer le statut de dépendance ligand activation du récepteur dans des cellules vivantes (ci-joint la vidéo 2) et de déterminer les motifs critiques ou processus impliqués dans l'activation du récepteur (Jala et al. 2005) 18.
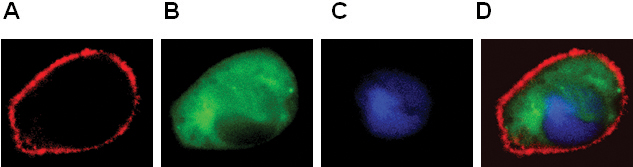
Figure 2. Expression de BLT1-DP (A), β-arrestine-GFP (B), pNuc-PCP (C) dans les cellules RBL-2H3. Image couleur combinée montré dans le panneau D.
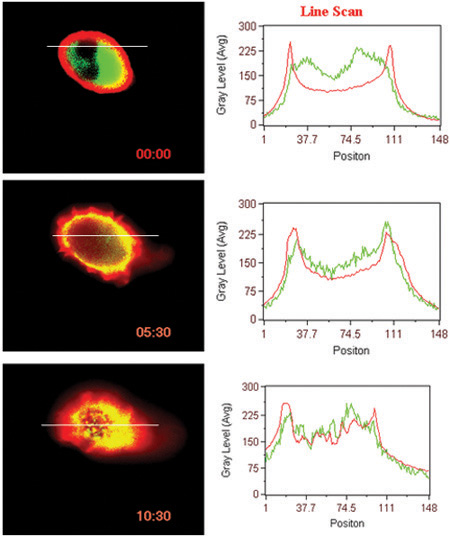
Figure 3. Translocation induite Ligand des récepteurs β-arrestine et. Ligne de balayage des intensités de fluorescence dans les cellules sont représentées.
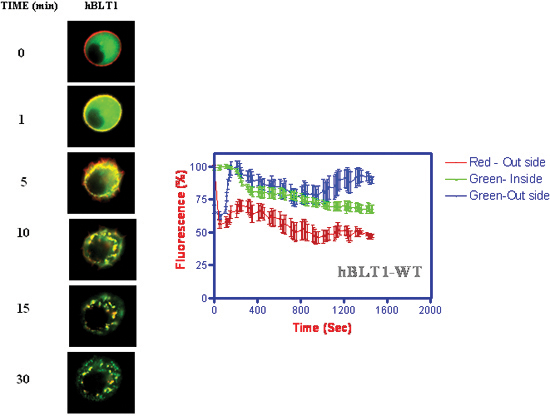
Figure 4. Cinétique de l'internalisation du récepteur et la β-arrestine translocation lors de l'addition de 1 uM LTB 4. Les intensités de fluorescence ont été mesurées en fonction du temps à la membrane et les lieux cytosolique de la cellule.
Vidéo 2 d'imagerie en direct de cellules exprimant BLT1-DP et β-arrestine-GFP à l'addition de 1 uM LTB 4. Cliquez ici pour visionner la vidéo
Discussion
Imagerie des cellules vivantes est un outil puissant pour démontrer les fonctions et les interactions des protéines spécifiques comme ils se produisent en temps réel. Les méthodes décrites dans ce manuscrit montrent clairement que LTB 4 peut induire une migration rapide des cellules dendritiques. Ces méthodes, non seulement d'élargir les aspects de LTB 4 fonction des types cellulaires variés, ils permettent des méthodes similaires pour être appliquée à une variété d'autres ch...
Déclarations de divulgation
Remerciements
La recherche est soutenue par National Institutes of Health subventions AI-52381, CA138623 et le Kentucky Lung Cancer Research Board et l'appui institutionnel de James Graham Brown Cancer Center.
matériels
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
Références
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon