Method Article
Nucléofection et de la culture primaire de neurones embryonnaires de souris hippocampe et cortex
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit les étapes nécessaires à disséquer, transfecter par électroporation et de neurones de souris de la culture de l'hippocampe et du cortex. Cultures à court terme peut être utilisé pour des études d'excroissance axonale et d'orientation, tout en cultures à long terme peut être utilisé pour des études de la synaptogenèse et l'analyse des épines dendritiques.
Résumé
Neurones de l'hippocampe et le cortex ont été largement utilisées pour étudier le système nerveux central (SNC) la polarisation des neurones, l'axone / dendrite excroissance, et la formation des synapses et la fonction. Un avantage de la culture de ces neurones est qu'ils polarisent facilement, formant des axones et des dendrites distinctifs, sur un substrat en deux dimensions à des densités très faibles. Cette propriété rend extrêmement utile pour déterminer de nombreux aspects du développement neuronal. Par ailleurs, en fournissant conditionné glial pour ces neurones, ils continueront à se développer, formant connexions synaptiques fonctionnelles et survivre pendant plusieurs mois en culture. Dans ce protocole, nous présentons une technique de disséquer, de culture et de transfecter des neurones embryonnaires de souris de l'hippocampe et du cortex. La transfection est réalisée par électroporation ADN dans les neurones avant l'étalement via nucléofection. Ce protocole a l'avantage d'exprimer des protéines de fusion par fluorescence marqués au début de développement (~ 4-8h après le placage) pour étudier la dynamique et la fonction des protéines au cours excroissance axonale polarisation, et la ramification. Nous avons également découvert que cette transfection unique avant plaquage maintient marqués par fluorescence expression des protéines de fusion à des niveaux appropriés pour l'imagerie pendant toute la durée du neurone (> 2 mois en culture). Ainsi, cette méthodologie est utile pour étudier la localisation des protéines et la fonction à travers le développement du SNC avec peu ou pas de perturbations de la fonction neuronale.
Protocole
1. Préparation des Lamelles et Chambers
- Préparation des lamelles propres et des chambres est indispensable pour les cultures en bonne santé. Raccourcis doit pas être pris à n'importe quel de ces étapes.
- Lavez les lamelles (rond de 12mm ou 22mm, verre allemand - Caroline adjoint Marque) pendant la nuit dans l'acide nitrique concentré (HNO3) dans un bocal en verre dédié ou bécher.
- Retirez les lamelles de l'acide nitrique et laver abondamment (5-7x) dans de l'eau déminéralisée.
- Séparer les lamelles et sec dans une hotte à flux laminaire ou enceinte de biosécurité. Une fois sèches, les stériliser avec une lumière UV pendant 30 minutes. Placez des lamelles stérilisés dans une des boîtes de Pétri stériles pour le stockage. Si les neurones plaquage sur des lamelles de 12mm de placer directement des lamelles dans un plat stériles 35mm et passer à la section 2.
- Chambres d'imagerie sont construits en perçant un trou de 15mm dans le fond de boîtes de Pétri de 35mm (supprimer tous les bavures) et attacher le couvre-nettoyées avec un mélange 3:1 de paraffine et de vaseline.
- Faire fondre la paraffine / vaseline mélange dans un tube conique dans un bain d'eau bouillante. Utilisez un petit pinceau et enduire la face inférieure de la vaisselle autour du trou de 15mm. Veillez à garder en remuant la paraffine / vaseline mélange comme il se séparera. Cela se traduit généralement dans des chambres collées ensemble avec une concentration plus élevée de gelée de pétrole, qui va devenir visqueux quand les plats sont placés dans l'incubateur, ce qui entraîne un détachement lamelle. La paraffine restante / gelée de pétrole peut être conservé à température ambiante.
- Placer le plat à l'envers sur un plateau plat et placer la lamelle sur le trou. Chauffer au four à 80 ° C jusqu'à ce que le mélange de paraffine est fondue (~ 10 minutes). Retirez les plats sur une surface plane et laissez le jeu mélange de paraffine.
- Tournez les plats plus et stériliser la fois l'intérieur des couvertures et le fond des chambres avec la lumière UV.
- Manteau des lamelles de verre ou de régions de chambres avec 1.0mg/mL Poly-D-lysine (30 kDa) en tampon borate (borate de sodium 0,1 M, pH 8,5) pendant une heure. Rincez 3-5 fois avec de grandes quantités d'eau de qualité culture de tissus déminéralisée. Assurez-vous d'enlever toute trace de tampon borate. Sec et l'utiliser immédiatement ou stocker des chambres / lamelles pour une utilisation ultérieure. Nous utilisons généralement des lamelles de nettoyer en un mois de préparation.
2. Préparation de la dissection neuronale et milieu de culture
- Préparer le milieu de dissection (DM) en ajoutant des quantités appropriées d'HBSS 10x et 100x HEPES à l'eau de qualité culture de tissus. Conserver à 4 ° C. Restez sur la glace lors de la dissection.
- La veille de la dissection de préparer le milieu d'étalement (PM) et un milieu sans sérum (SFM). PM se compose de milieu Neurobasal, B27 supplément, 2 mM de glutamine, glucose 0,3%, 37,5 mM de NaCl et 5% de sérum fœtal bovin (FBS). GDF se compose de milieu Neurobasal, B27 supplément, 2 mM de glutamine, glucose 0,3% et 37,5 mM de NaCl.
- Faire juste assez pour la dissection et de stocker dans une culture tissulaire pendant la nuit avec le bouchon incubateur légèrement entrouverte afin que la température et la teneur en CO 2 de l'équilibre les moyennes. Nous ajoutons de glucose supplémentaires et augmenter l'osmolalité à environ 310mOsm avec NaCl. Nous retrouvons les cultures réussissent mieux à une osmolalité plus physiologique (osmolalité Neurobasal est généralement de 205 245mOsm).
3. Préparation gliales corticales couche nourricière pour les cultures à long terme
- Si à long terme, les cultures doivent être préparés, d'effectuer cette partie de deux à trois semaines du protocole avant de continuer avec les dissections corticales ou hippocampiques.
- Préparer le milieu gliales (GM) avec du MEM, le glucose 0,3%, pénicilline / streptomycine et du sérum de cheval 10%.
- Euthanasier souriceaux P1-P3 par refroidissement sur de la glace pendant 5 minutes. Retirez chaque chiot de la glace et de pulvérisation avec de l'éthanol à 70%. Vite décapiter avec des ciseaux. Retirer l'ensemble du cerveau dans un plat contenant froide DM (étape 2.1).
- Retirez les deux hémisphères cérébraux et des méninges. D'accise du néocortex et de supprimer d'un nouveau plat contenant aucun média. Préparer cortex de 4 cerveaux total.
- Émincer le cortex avec un chiffon propre, lame de rasoir stérile aussi fine que possible et éliminer les tissus hachés avec une pipette en plastique à un tube conique de 50 ml contenant 12 ml de froid DM. Ajouter la trypsine et la DNase à des concentrations finales de 0,25% (1,5 ml) et 0,1% (1,5 ml), respectivement. Incuber dans un bain d'eau à 37 ° C pendant 10 minutes en remuant par intermittence.
- Retirez le tube contenant le tissu cortical et bien nettoyer avec de l'éthanol à 70% avant la mise en culture de tissus de la hotte. Tissus corticaux Pipet haut et en bas avec une pipette de 10 ml environ 10-15 fois, ou jusqu'à ce que la plupart des morceaux de disparaître.
- Retour le tube à 37 ° C dans un bain d'eau pendant 10 minutes avec intermittente tourbillonnant.
- Bien nettoyer le tube avec de l'éthanol 70% et le ramener à la hotte de culture de tissus. Déposer le tissu cortical de haut en bas avec un 5 mL pipette environ 10-15 fois, ou jusqu'à ce que les morceaux de disparaître.
- Ajouter 15 ml d'eau tiède GM et centrifuger à 200xg (1000rpm) pendant 10 minutes.
- Rejeter le surnageant, resuspendre le culot cellulaire dans 20 ml de frais de GM et compter avec un hématimètre. Planche 5-7.5x10 6 cellules dans 15 ml de GM par 75cm 2 flacon.
- Après un jour et tous les 2-3 jours suivants dans la culture, de déloger les cellules non adhérentes par frapper dans le ballon contre votre main. Retirez le support ainsi que toutes les cellules délogées et remplacer par 15 ml de frais de GM.
- Glia peuvent être récoltées après 1-2 semaines de croissance dans les flacons, quand ils sont environ 70-100% de confluence. Pour préparer des lamelles individuelles revêtu de cellules gliales, l'acide nitrique lieu 6 nettoyé et stérilisé 25mm lamelles rondes dans un plat de 10cm, et la place 3 points du mélange 03:01 de paraffine / vaseline sur chaque lamelle dans un schéma triangulaire avec un petit pinceau . Traiter plats ouverte avec la lumière UV pendant 30 minutes. Enduire les lamelles avec 0,1 mg / ml de poly-D-lysine (30 kDa) dans un tampon borate pour une heure, puis laver abondamment (3-5x) avec de l'eau des tissus de qualité stériles culture déminéralisée et laissez sécher.
- Retirer la fiole contenant gliales de l'incubateur, jetez le support et rincer avec 5 ml de pré-chauffé trypsine / EDTA. Retirer la solution de trypsine / EDTA de la fiole et la pipette 3 ml de frais préchauffé trypsine / EDTA dans le ballon. Incuber le ballon pendant 1 minute à 37 ° C avant d'ajouter 5 ml de GM à arrêter le traitement à la trypsine.
- Retirez la glie du ballon par pipetage répété 10-15 fois, puis de transférer les médias à un tube conique 15 ml. Centrifuger à 200xg (1000rpm) pendant 8 minutes. Enlever le surnageant et ajouter 10 ml de GM, les cellules comptent, et la plaque de 5x10 5 cellules dans 12,5 ml de GM par plat 10cm contenant les lamelles.
- Bourse du support avec des produits frais pré-chauffé GM tous les 2-3 jours. Le jour avant la dissection neurone, retirez le GM et le remplacer par l'AFD (section 2.2). Utilisez cette GDF gliales conditionné à l'étape où les inondations 4,12 cultures corticales ou hippocampiques.
4. Dissection corticale et / ou l'hippocampe et l'électroporation
- Retirer des quantités appropriées de solutions nucléofection (Lonza), combiner et se réchauffer à température ambiante avant de commencer la dissection. Depuis solution nucléofection a une durée de vie limitée lorsqu'elles sont combinées, nous ne combinent la quantité nécessaire pour chaque préparation (100 ul par transfection).
- Euthanasier une souris enceinte à E15.5 avec du CO 2 (jour de la fiche est E 0,5) et enlever l'utérus à une boîte de Pétri de 10 cm. Retirez les foetus et les décapitent en froid DM (section 2.1).
- Enlever le cerveau entier dans un plat à part du froid et de DM avec une aiguille de tungstène courbé, enlever les deux neocortices. Retirez les méninges avec microforceps et placez-le dans les cortex nouveau plat de froid DM. Avec une paire de ciseaux iris ou Wecker petits, retirez le cortex ou l'hippocampe et le placer dans un tube Eppendorf de 1,5 ml remplie de 1,0 ml de froid DM. Gardez ce tube sur la glace.
- Après dissection tous les corticales ou hippocampes, ajouter 110 ul de trypsine de 2,5% au tube Eppendorf contenant le tube de tissu et placer dans un incubateur à 37 ° C pendant 20 minutes.
- Retirez le cortex surnageant et laver ou hippocampes avec 1,0 mL PM (article 2.2) en retournant doucement le tube Eppendorf. Répétez le laver deux fois, en laissant 1 mL de PM dans le tube.
- Triturer les morceaux 15 fois avec une pipette P1000, et éliminer les cellules surnageant / à un nouveau 15 ml tube conique contenant 4 ml de PM, laissant toute morceaux qui restent dans le tube Eppendorf.
- Spin le tube de 15 ml à 20xg (350rpm) pendant 7 minutes avec le frein off. Jeter le surnageant et ajouter 100 ul de prémélange, la solution de nucléofection température ambiante (Lonza) pour chaque transfection. Triturer 5 fois avec un léger mouvement de haut en bas de la pipette P1000.
- Retirer 100 pl de la solution de nucléofection / cellule mélange à chaque nouveau tube Eppendorf et ajoutez la quantité appropriée d'ADN. Pour les cultures à long terme que nous utilisons généralement 1-2μg d'ADN par transfection. Cependant, cette étiquette seule une petite proportion <10% des neurones dans la culture. Nous utilisons généralement 5-10 pg d'ADN par transfection si vous voulez une plus grande efficacité de transfection pour la culture à court terme. Nous avons utilisé jusqu'à un total de 40μg d'ADN quand transfection avec deux plasmides différents. Les plasmides sont stockées dans un tampon TE à 1 pg / mL.
- Ajouter suspension cellulaire / ADN à la cuve (Lonza) et électroporation des cellules dans le Nucleofector (Lonza), en utilisant le programme O-005 (SNC souris neurones).
- En travaillant rapidement, ajouter 500 ul de PM préchauffé et équilibrée dans la cuvette et retirez solution / cellules dans un nouveau tube Eppendorf de 1,5 ml. Ajouter PM suffisante pour ramener le volume de chaque transfection à 1,0 mL. Compter les cellules avec un hémocytomètre et la plaque au 3-5x10 3 cellules / cm 2 pour les cultures jeunes, ou 5-10x10 3 cellules / cm 2 pour les cultures à long terme.
- Pour cultures de courte durée, d'une inondation des boîtes de culture 35mm avec 2,0 mL de réchauffé, CO 2-GDF équilibrée après une heure de placage. Si vous utilisez des lamelles, nous supprimons la moitié de la PM et le remplacer par l'AFD, puis répéter deux fois plus. Soit les inondations les chambres d'imagerie ou de laver les résultats des lamelles dans une très faible teneur sérique (<0,5%). Cultures à court terme n'ont pas besoin d'être cultivée avec une couche nourricière gliales et n'ont pas besoin d'être ré-alimentés.
- Pour cultures à long terme, nous supprimons une lamelle glie couverts contenant trois points de paraffine / vaseline et l'inverser sur le trou de 15mm dans le plat de 35mm, une heure après plaquage initial. Deux millilitres de l'AFD conditionnée par le plat gliales est alors ajouté à la chambre d'imagerie. Pour nourrir les cultures à long terme, nous enlevons un tiers de la SFM tous les 2-3 jours et de le remplacer avec des produits frais, pré-chauffé et le CO 2-GDF équilibrée.
5. Les résultats représentatifs:
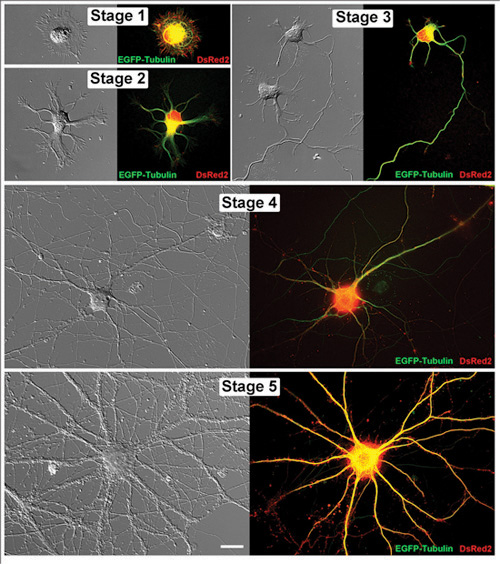
Figure 1. Vivre dans les neurones de l'hippocampe stades successifs de développement. Images appariées de représentant vivant neurones de l'hippocampe sont montrés à la fois comme une image de contraste interférentiel différentiel et une micrographie correspondante fluorescentes. Chacune de ces cellules a été transfectées avec EGFP-tubuline et DsRed2 dans des vecteurs pCAX. Les neurones ont été imagées à des jours suivants in vitro (DIV): Étape 1 (1div), Stade 2 (1div), Phase 3 (2DIV), étape 4 (11DIV) et l'étape 5 (32DIV). La barre d'échelle est 20μm.
Discussion
Ce protocole de culture embryonnaire, les neurones de souris de l'hippocampe et du cortex a été développé comme une modification du protocole de banquier, qui utilise le rat neurones 1,2. Nous avons utilisé ce protocole pour la souris et les neurones en culture de hamster ainsi 3,4,5,6,7. Ce protocole fonctionne aussi bien pour les neurones de l'hippocampe et du néocortex fois et est similaire à un protocole publié par Meberg et Miller 8. Généralement, nous utilisons neurones de l'hippocampe à long terme de culture, car ils sont bien caractérisés et un système modèle plus établies. Par ailleurs, ils sont susceptibles de contenir une population plus homogène de neurones que néocortex. Cependant, les neurones du néocortex cultivés en utilisant ce protocole aussi survivre et de se différencier de façon similaire (données non publiées). Nous utilisons régulièrement neurones de l'hippocampe et le néocortex pour la culture à court terme. Dissection du néocortex se traduit également dans les neurones beaucoup plus élevés (1.5x10 6 neurones par paire de cortex) que la dissection hippocampique (2.5x10 5 neurones par paire de hippocampes), ce qui en fait un meilleur choix du matériau pour Western blot, par exemple.
Comme pour toute culture primaire, il est essentiel de minimiser le temps que cela prend de la mort de l'animal au bordé de cellules. Elle prendra généralement 10 à 20 dissections de devenir toujours rapide à la dissection et le placage. Aussi, lorsque vous travaillez avec le Nucleofector Lonza, il est essentiel de travailler rapidement pendant la procédure d'électroporation, comme la viabilité des neurones diminue rapidement si elles sont laissées dans la mémoire tampon nucléofection.
La plupart de nos images est réalisée avec un total de microscopie par fluorescence réflectance interne (TIRFM). Ce type de microscopie est seulement capable de l'imagerie plusieurs centaines de nanomètres au-delà des lamelle. Par conséquent, les zones des neurones qui nous avons souvent l'image, le cône de croissance axonal et des épines dendritiques, ont besoin d'être collée directement sur la lamelle. Ainsi, nous utilisons des cultures à faible densité qui nécessitent l'alimentation gliales pour la culture à long terme. Nous avons utilisé des cultures de densité plus élevée (> 2x10 4 cellules / cm 2), sans couches nourricières gliales, à long terme des cultures et a constaté qu'ils survivent très bien avec une alimentation peu. Cependant, les épines dendritiques de ces neurones sont souvent trop éloignés du substrat à l'image de TIRFM, même si elles peuvent être facilement détectés par microscopie à champ large ou de microscopie confocale.
Dans la plupart de nos études, nous transfecter des neurones, avant le placage, et ont imagé protéines marqués à la fluorescence pour un maximum de trois mois en culture. Cette expression à long terme des protéines marqués à la fluorescence nous donne confiance qu'en utilisant de faibles concentrations de l'ADN (1-2μg) nous ne produisons pas des artefacts surexpression dans les neurones. Cependant, cette procédure peut également être utilisé pour étudier la surexpression de protéines, si de grandes quantités d'ADN sont utilisées (10-20 pg). Les plasmides que nous utilisons pour transfecter des neurones contiennent habituellement des protéines de fusion EGFP ou mCherry, bien que nous avons aussi l'étiquette du cytoplasme neuronal avec DsRed2 ou EGFP seul. Cette technique d'électroporation fonctionne bien avec un certain nombre de vecteurs. Nous préférons les plasmides qui contiennent un promoteur β-actine avec un enhancer du CMV et de β-globine queue poly-A (ou pCAGGS pCAX plasmides) 9, en raison des niveaux relativement élevés d'expression, et le fait qu'ils sont bien tolérés par les neurones dans les deux cultures à court et à long terme. Généralement, les protéines commencent à exprimer au sein d'environ 4 heures de placage et atteindre un niveau suffisant pour l'imagerie dans les 10-24h 10. Nous avons utilisé avec succès CMV promoteur axée plasmides à court terme, les cultures, mais ils ont constaté qu'ils peuvent causer des niveaux élevés de surexpression qui tuent les neurones à long terme de la culture. Néanmoins, nous avons constaté que le conditionnement des cultures gliales faible densité contribue à la survie des neurones transfectées avec des plasmides promoteur CMV-conduit, par rapport à une densité plus élevée (non-gliales nourris) des cultures.
Déclarations de divulgation
Remerciements
Toutes les procédures ont été approuvées par l'Université du Wisconsin Comité de protection des animaux et ont été en conformité avec les directives du NIH. Nous remercions le Dr Katherine Kalil pour l'utilisation généreuse de son dispositif de Nucleofector. Nous remercions également les membres du laboratoire de la Dent de commentaires sur le protocole. Ce travail a été soutenu par des subventions du NIH R01-NS064014, Dana Foundation et la Fondation de Whitehall EWD
Christopher Viesselmann, Jason et Derek Ballweg Lumbard contribué également à ce document.
matériels
* La plupart des réactifs que nous conserver à -80 ° C peuvent être stockés à -20 ° C ainsi. Leur stockage à -80 ° C allonge leur durée de vie et les résultats dans les cultures un peu plus cohérent.
Références
- Goslin, K., Asmussen, H., Banker, G. Chapter 13. Culturing Nerve Cells. Goslin, K., Banker, G. , The MIT Press. 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. Hollenbeck, P. J., Bamburg, J. R. , Academic Press. Volume 71 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon