Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un écran à haut débit pour la bioprospection minière activité cellulase à partir des bibliothèques métagénomique
Dans cet article
Résumé
Ce protocole décrit un écran haut débit pour l'activité cellulolytique d'une banque métagénomique exprimé dans Escherichia coli. L'écran est la solution basée et hautement automatisé et utilise un pot de chimie dans des microplaques 384 puits avec la lecture finale comme une mesure d'absorbance.
Résumé
La cellulose, la source la plus abondante de carbone organique sur la planète, possède une vaste applications industrielles avec un accent croissant sur la production de biocarburants 1. Les méthodes chimiques de modifier ou de dégrader la cellulose exigent généralement les acides forts et des températures élevées. En tant que tel, les méthodes enzymatiques sont devenus importants dans le processus de bioconversion. Alors que l'identification des cellulases actifs à partir d'isolats bactériens et fongiques a été quelque peu efficaces, la grande majorité des microbes dans la nature résister à la culture en laboratoire. Génomique environnementale, aussi connu comme des approches métagénomique, de dépistage ont un grand potentiel pour combler le fossé de culture dans la recherche d'enzymes de bioconversion roman. Approches de dépistage métagénomique ont réussi à récupérer les cellulases roman d'environnements aussi variés que les sols 2, 3 buffles du rumen et l'intestin postérieur des termites 4 en utilisant des plaques d'agar carboxyméthylcellulose (CMC) tachés avec le Congo colorant rouge (basé sur la méthode de Teather et Wood 5). Cependant, la méthode MCC est limité dans le débit, n'est pas quantitatif et manifeste un signal faible à 6 bruit. D'autres méthodes ont été signalés, mais 7,8 chacun utiliser une plaque de gélose de base de test, qui est indésirable pour criblage à haut débit des grandes banques génomiques d'insertion. Nous présentons ici une solution à base d'écran pour l'activité cellulase en utilisant un dinitrophénol chromogène (DNP)-cellobioside substrat 9. Notre bibliothèque a été cloné dans le contrôle pCC1 copie fosmide pour augmenter la sensibilité du dosage par induction du nombre de copies 10. La méthode utilise un pot de chimie en microplaques 384 puits avec la lecture finale fournie comme une mesure d'absorbance. Cette lecture est quantitative, sensible et automatisé avec un débit allant jusqu'à 384 plaques 100X-même par jour en utilisant un gestionnaire de liquide et de lecteur de plaque avec le système d'empilage ci-joint.
Protocole
Avant de commencer ce protocole, vous aurez besoin de votre banque métagénomique stockées dans un format de 384 plaque de bien. Dans notre étude, nous avons utilisé le vecteur pCC1 exemplaire de contrôle fosmide en combinaison avec le phage T1 résistant TransforMax EPI300-T1 R E. cellules coli comme hôte bibliothèque et stockées dans nos assiettes à -80 ° C 11.
1. La réplication des plaques banque métagénomique
- Décongeler les plaques contenant votre bibliothèque à 37 ° C pendant environ 20 minutes, ou jusqu'à ce que tous les puits sont décongelés.
- Utilisez la fonction de la lumière UV sur la stérilisation qPix2 pour stériliser le robot pendant 15 minutes.
- Préparer le bouillon LB avec chloramphénicol à une concentration finale de 12.5ug/mL et arabinose au 100ug/mL dans un flacon de réactif 500 ml. Chaque plaque va utiliser environ 20 ml, ainsi que faire un 50mL supplémentaires pour permettre volume mort.
- Mettre en place l'qFill3 que les instructions du fabricant avec la bouteille des médias attachés à la tubulure par l'intermédiaire du tube stérile. Il programme pour le montant approprié des médias, et le mettre pour remplir un volume 45uL dans chaque puits.
- Purger l'air du tube et le collecteur à l'aide de la fonction de purge du robot jusqu'à ce média est visible provenant de chaque broche du collecteur.
- Remplissez le nombre désiré de plaques avec les médias LB utilisant le qFill3. Chaque plaque dure environ 20 secondes pour remplir.
- Charger les plaques de bibliothèque et les plaques de frais dans les zones appropriées du robot qPix2. Remplissez les bains de nettoyage avec les réactifs appropriés; 2% Micro90 dans le bain à l'arrière, autoclavés eau distillée dans la salle de bain moyenne, 80% d'éthanol dans le bain avant.
- Utilisez la fonction "Réplication" programme de la qPix2. Dans le logiciel, sélectionnez la tête appropriée, le nombre et les types de plaques de source et de destination des plaques. Également mis en place la tête pour nettoyer entre les réplications, habituellement 6 cycles dans chaque salle de bain est suffisant. Capacité de la machine est de 10 plaques à la fois, et cela prend environ 15 minutes pour se répliquer eux tous avec une tête de 384 broches (ou environ 50 minutes avec une tête de 96 broches).
Note: Il ya une option "Incorporer Source" ou "Stir Destination". Il est recommandé de ne pas utiliser ces options comme des problèmes ont déjà eu lieu avec nos robots de les utiliser. - Une fois les plaques sont répliqués, poussent les plaques à 37 ° C pendant 24 heures dans une boîte de l'humidité. Parce que nous sommes induisant un nombre élevé de copies du fosmide avec addition d'arabinose, les clones ont tendance à croître plus lentement que les non-induite clones. Retour des plaques bibliothèque à -80 ° C.
Remarque: Incubation dans une boîte de l'humidité assure l'évaporation des médias ne se produit pas dans les puits sur le bord des plaques, en gardant un environnement uniforme pour tous les puits. - Nettoyer le robot qFill3 d'abord qu'il purge avec de l'eau (~ 50 ml) puis 80% d'éthanol (~ 50 ml). Démonter les composants, et nettoyer et autoclaver la bouteille, couvercle, et le tube enveloppé dans du papier aluminium.
2. Mesurer la croissance de E. Clones coli
- Retirer des plaques de 37 ° C incubateur. Retirer et réserver les couvercles et les plaques de placer sur la plate-forme de chargement fourni avec le magazine l'RapidStak, jusqu'à un maximum de 25 plaques.
Remarque: La plaque au bas de la pile sera la première à être lu. Assurez-vous de garder une trace de l'ordre des planches, comme le logiciel n'enregistre pas présent. - Retirer un magazine de la Stak rapide, s'assurer qu'elle est vide, et le pousser sur la pile de plaques d'être lu. Prenez par la poignée, et les plaques doivent tous être chargé dans le magasin. Chargez le chargeur dans le RapidStak.
Remarque: Le magazine a une petite vis dans le coin dénotant quel coin du puits A1 des plaques devrait aller. Le magazine ne montez dans le RapidStak dans un sens. - Ouvrez le programme RE SkanIt sur l'ordinateur connecté à la machine. Sélectionnez "New Session" et un nom approprié. Choisissez "Corning à fond plat de 384 puits assiette» comme le type de plaque.
- Dans la «disposition de la plaque», sélectionnez le "Magicien" bouton, et il choisir d'ajouter 384 inconnues dans votre assiette.
- Dans le «Protocole», sélectionnez la "boucle bien" option et entrez pour 384 puits. Une «boucle bien" icône apparaîtra dans le flux d'arbre sur le côté gauche de l'écran. Sélectionnez l'icône et cliquez pour ajouter "Mesure photométrique». Réglez-le à lire à 600nm.
- Enregistrer votre protocole avec un nom unique, et fermer le programme RE SkanIt.
- Sur l'ordinateur, ouvrez le programme PolaraRS.
- Sur la page principale, il y aura tableau énumérant les instruments connectés à l'appareil RapidStak. Le VarioSkan devrait être mis sur le côté gauche de ce tableau. Sous le titre VarioSkan, il y aura deux liens: «RunSession» et «Incuber". Cliquez sur le "RunSession" option.
- Une nouvelle fenêtre, la fenêtre d'analyse, apparaît avec un organigramme dans le milieu. Sélectionnez le "RunSession" item (il devrait être présent seul élément). Sur le côté droit de l'écran un menu déroulantapparaîtra. Trouvez le nom de votre RE SkanIt sauvé lancer dans ce menu.
Note: Il semble y avoir aucun ordre rationnel de ce menu. Il n'est pas alphabétique, ou par date d'ajout, ou liés à l'emplacement sur l'ordinateur que le protocole est sauvé. Cela signifie que vous devez regarder à travers tous les protocoles avant de trouver votre propre, qui est une douleur. - Une fois que vous avez sélectionné votre protocole, dans le coin supérieur droit cliquez sur "Exécuter ce test".
- Une boîte apparaît, vous demandant de désigner quel magazine à utiliser comme source, et qui chargeur est vide. La zone inférieure de l'écran correspond à la revue avant. [Facultatif: Il vous demande d'entrer le nombre de plaques chargées de déterminer une estimation de la quantité de temps qu'il faudra. Cette estimation est normalement loin.]
- Veiller à la fois l'RapidStak et le VarioSkan sont allumés, et appuyez sur "OK".
- Le RapidStak se charge automatiquement vos assiettes dans le lecteur de plaque, permettant de mesurer en continu les plaques. Pour lire 25 plaques prend environ 50 minutes.
Remarque: Il est recommandé d'observer la première plaque de chargement dans le VarioSkan pour assurer le bon alignement des machines. Si le RapidStak ne charge pas le lecteur de plaque correctement, utilisez la "Pause ce test" bouton dans le coin en haut à droite de la fenêtre PolaraRS. - Une fois la lecture se fait VarioSkan toutes les assiettes, retirez le chargeur complet et le placer sur la plate-forme de chargement magazine. Soulevez le rectangle extérieur de la plateforme, et le magazine doit glisser, laissant les plaques debout dans une pile au milieu. Remplacer les couvercles sur les plaques appropriées.
3. Ajout de l'Assay Mix à chaque plaque
- Préparer le mélange de dosage en utilisant premade stock de 10x de mélange de lyse (10% de Triton X-100, 100mm RIS, 10mM EDTA) dans un tampon d'acétate de potassium 50 mM à pH 5,5. Préparer un stock de jusqu'à 75mg/mL DNP-cellobioside substrat dans le DMSO, en s'assurant que le substrat soit complètement dissous. Ajouter la solution stock de DNP-cellobioside de mélanger test à une concentration finale de 0.1mg/mL. Chaque plaque va utiliser environ 20 ml de la solution, ainsi que faire un 50mL supplémentaires pour permettre volume mort.
Remarque: DNP-cellobioside n'est pas soluble dans l'eau, donc la dissolution dans le DMSO augmente la solubilité. La présence de DMSO dans la solution d'analyse finale n'a pas d'effets observables. - Mettre en place l'qFill3 que les instructions du fabricant avec la bouteille des médias attachés à la tubulure par l'intermédiaire du tube stérile. Il programme pour le montant approprié des médias, et le mettre pour remplir un volume 45uL dans chaque puits.
- Purger l'air du tube et le collecteur à l'aide de la fonction de purge du robot jusqu'à ce média est visible provenant de chaque broche du collecteur.
- Ajouter le mélange de dosage de chaque plaque à l'aide de la qFill3. Chaque plaque dure environ 20 secondes pour remplir.
- Une fois mélange de dosage est ajoutée, incuber les plaques à 37 ° C dans une boîte d'humidité pour les 12-16 heures.
Remarque: Plus-incubation des plaques fois le mélange d'essai est ajouté provoquera l'évaporation dans les puits extérieur de la plaque, ce qui donne des lectures d'absorbance supérieur vu pour les puits à l'intérieur. Cela peut être compensé par une incubation des plaques dans une chambre humide.
4. Absorbance des Clones Assayed
- Retirer des plaques de 37 ° C incubateur. Retirer et réserver les couvercles et les plaques de placer sur la plate-forme de chargement fourni avec le magazine l'RapidStak, jusqu'à un maximum de 25 plaques.
Remarque: La plaque au bas de la pile sera la première à être lu. Assurez-vous de garder une trace de l'ordre des planches, comme le logiciel n'enregistre pas présent. - Retirer un magazine de la Stak rapide, s'assurer qu'elle est vide, et le pousser sur la pile de plaques d'être lu. Prenez par la poignée, et les plaques doivent tous être chargé dans le magasin. Chargez le chargeur dans le RapidStak.
Remarque: Le magazine a une petite vis dans le coin dénotant quel coin du puits A1 des plaques devrait aller. Le magazine ne montez dans le RapidStak dans un sens. - Ouvrez le programme RE SkanIt sur l'ordinateur connecté à la machine. Sélectionnez "New Session" et un nom approprié. Choisissez "Corning à fond plat de 384 puits assiette» comme le type de plaque.
- Dans la «disposition de la plaque», sélectionnez le "Magicien" bouton, et il choisir d'ajouter 384 inconnues dans votre assiette.
- Dans le «Protocole», sélectionnez la "boucle bien" option et entrez pour 384 puits. Une «boucle bien" icône apparaîtra dans le flux d'arbre sur le côté gauche de l'écran. Sélectionnez l'icône et cliquez pour ajouter "Mesure photométrique». Réglez-le à lire à 400nm.
- Enregistrer votre protocole avec un nom unique, et fermer le programme RE SkanIt.
- Sur l'ordinateur, ouvrez le programme PolaraRS.
- Sur la page principale, il y aura tableau énumérant les instruments connectés à l'appareil RapidStak. Le VarioSkan devrait être mis sur le côté gauche de ce tableau. Sous le titre VarioSkan, il y aura deux liens: «RunSession" et "Incubate ". Cliquez sur le" RunSession "option.
- Une nouvelle fenêtre, la fenêtre d'analyse, apparaît avec un organigramme dans le milieu. Sélectionnez le "RunSession" item (il devrait être présent seul élément). Sur le côté droit de l'écran un menu déroulant apparaîtra. Trouvez le nom de votre RE SkanIt sauvé lancer dans ce menu.
- Une fois que vous avez sélectionné votre protocole, dans le coin supérieur droit cliquez sur "Exécuter ce test".
- Une boîte apparaît, vous demandant de désigner quel magazine à utiliser comme source, et qui chargeur est vide. La zone inférieure de l'écran correspond à la revue avant. [Facultatif: Il vous demande d'entrer le nombre de plaques chargées de déterminer une estimation de la quantité de temps qu'il faudra. Cette estimation est normalement loin.]
- Veiller à la fois l'RapidStak et le VarioSkan sont allumés, et appuyez sur "OK"
- Le RapidStak se charge automatiquement vos assiettes dans le lecteur de plaque, permettant de mesurer en continu les plaques.
Remarque: Il est recommandé d'observer la première plaque de chargement dans le VarioSkan pour assurer le bon alignement des machines. Si le RapidStak ne charge pas le lecteur de plaque correctement, utilisez la "Pause ce test" bouton dans le coin en haut à droite de la fenêtre PolaraRS. - Une fois la lecture se fait VarioSkan toutes les assiettes, retirez le chargeur complet et le placer sur la plate-forme de chargement magazine. Soulevez le rectangle extérieur de la plateforme, et le magazine doit glisser, laissant les plaques debout dans une pile au milieu. Les plaques peuvent être éliminés en fonction de vos procédures de laboratoire.
- Pour exporter les résultats d'absorbance, ouvrez le logiciel RE SkanIt, et choisissez "Ouvrir un fichier existant".
- Sélectionnez le répertoire où vous avez enregistré votre session, cliquez sur le icône «+» pour développer la liste et sous le titre rubrique sera options étiqueté «Container 1» à «Conteneur N» selon le nombre de plaques. Sélectionnez la première plaque d'être analysés.
- Dans la barre de menu en haut de la page, sélectionnez "Data Processing> Rapport / Export"
- Choisissez les options souhaitées pour l'exportation.
Note: Je typiquement sélectionnez «disposition de la plaque» et «photométrique» les données pour l'exportation. - Cliquez sur «Afficher le rapport" puis sur "Fichier> Enregistrer". Choisissez le répertoire désiré. Le format de sortie est une feuille de calcul Microsoft Excel
5. Les résultats représentatifs
Un exemple de lectures d'absorbance d'une seule plaque de 384 puits contenant un clone positif est montré dans la figure 2. Les clones positifs montrent une nette augmentation de l'absorbance par rapport à ceux n'exprimant pas le activité cellulase. Les différences de temps de dosage, l'emplacement ainsi sur la plaque, ou la concentration DNP (peut être introduite par filtrage non dissous DNP) peut affecter les lectures d'absorbance absolue. Lectures d'absorbance relative, tels que la différence d'absorbance supérieure à la moyenne plaque ou moyenne colonne, sont une méthode plus robuste d'identification des clones positifs cellulase.
Suite à l'identification des clones positifs de la bibliothèque de plaques, il est recommandé de reproduire tous les clones positifs dans une nouvelle plaque pour le dépistage secondaire. Ceci élimine les effets découlant de l'emplacement ainsi la plaque ou la variation et permet la comparaison directe entre plusieurs clones positifs.

Figure 1. Organigramme de l'analyse à haut débit pour une banque métagénomique clonée dans E. coli et conservés à -80 ° C.
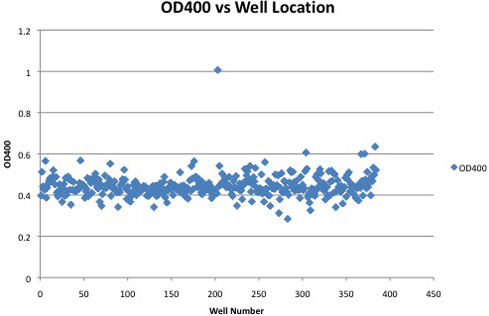
Figure 2. Lectures d'absorbance d'une plaque de 384 puits contenant un clone positif. Clones positifs cellulase peuvent être identifiés par l'absorbance sensiblement augmenté au cours des clones négatifs.
Discussion
Un écran à haut débit pour la détection rapide de l'activité cellulolytique partir d'une bibliothèque génomique insérez métagénomique grandes ADN exprimée dans E. coli est décrite dans ce protocole. Cette méthode est une amélioration par rapport au dosage de CMC / rouge Congo couramment utilisé dans la littérature. C'est une solution basée, et permet pour un pot de dépistage chimie en plaques 384 puits, avec la sortie finale lectures d'absorbance à partir d'un lecteur de p...
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier le Dr Steve Withers et Hong-Ming Chen pour fournir des DNP-cellobioside substrat.
matériels
| Name | Company | Catalog Number | Comments |
| qPix2 | Genetix | With 384-pin gridding head | |
| qFill3 | Genetix | With 384-well manifold | |
| Varioskan | Thermo Fisher Scientific, Inc. | ||
| RapidStak | Thermo Fisher Scientific, Inc. | Connected to Varioskan | |
| Micro90 Detergent | Cole-Parmer | 18100-00 | Diluted to 2% in water |
| Ethanol | Major Lab Supplier | Diluted to 80% in water | |
| Chloramphenicol | Sigma-Aldrich | C0378 | 12.5mg/mL in ethanol |
| LB broth, Miller | Fisher Scientific | BP1426-2 | 25g/L, autoclaved |
| 384-well flat bottom plates | Corning | 3680 | |
| L-(+)-Arabinose | Sigma-Aldrich | A3256 | 100mg/mL in water |
| Potassium Acetate | Fisher Scientific | P171 | 50mM in water, autoclaved, adjusted to pH 5.5 with HCl |
| Triton X-100 | Fisher Scientific | BP151 | |
| Trizma hydrochloride | Sigma-Aldrich | T3253 | In TE buffer solution, 100mM |
| EDTA disodium salt | Sigma-Aldrich | E5134 | In TE buffer solution, 10mM |
| 2,4-dinitrophenyl cellobioside | Provided by Dr. Steve Withers, UBC | ||
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 |
Références
- Rubin, E. M. Genomics of cellulosic biofuels. Nature. 454, 841-845 (2008).
- Voget, S., Steele, H. L., Streit, W. R. Characterization of a metagenome derived halotolerant cellulase. J. Biotechnol. 126, 26-36 (2006).
- Duan, C. J. Isolation and partial characterization of novel genes encoding acidic cellulases from metagenomes of buffalo rumens. J. Appl. Microbiol. 107, 245-256 (2009).
- Zhang, Y. H. P. Outlook for cellulase improvement: Screening and selection strategies. Biotech. Advances. 24, 452-481 (2006).
- Teather, R. M., Wood, P. J. Use of congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl. And Environ. Microbiol. 43, 777-780 (1982).
- Sharrock, K. R. Cellulase assay methods: a review. J. Biochem and Biophys Methods. 17, 81-106 (1988).
- Kasana, R. C., Salwan, R., Dhar, H., Dutt, S., Gulati, A. A rapid and easy method for detection of microbial cellulases on agar plates using Gram's Iodine. Curr. Microbiology. 57, 503-507 (2008).
- Huang, J. S., Tang, J. Sensitive assay for cellulase and dextranase. Anal. Biochem. 73, 369-377 (1976).
- Tull, D., Withers, S. G. Mechanisms of cellulases and xylanases: A detailed kinetic study of the exo-beta-1,4-glycanase from Cellulomonas fimi. Biochemistry. 33, 6363-6370 (1994).
- Martinez, A., Bradley, A. S., Waldbauer, J. R., Summons, R. E., DeLong, E. F. Proteorhodopsin photosystem gene expression enables photophosphorylation in a heterologous host. PNAS. 104, 5590-5595 (2007).
- Taupp, M., Lee, S., Hawley, A., Yang, J., Hallam, S. J. Large Insert Environmental Genomic Library Production. J Vis Exp. , (2009).
- Martinez, A., Tyson, G. W., DeLong, E. F. Widespread known and novel phosphonate utilization pathways in marine bacteria revealed by functional screening and metagenomic analyses. Environ Microbiol. 12, 222-238 (2010).
- Wild, J., Hradecna, Z., Szybalski, W. Conditionally amplifiable BACs: Switching from single-copy to high-copy vectors and genomic clones. Genome Research. 12, 1434-1444 (2002).
- Johnson, E. A. Sacchirification of complex cellulosic substrates by the cellulase system from Clostridium thermocellum. Appl Environ Microbiology. 43, 1125-1132 (1982).
- Stutzenberger, F. J. Cellulase Production by Thermomonospora curvata isolated from municipal solid waste compost. Appl Environ Microbiol. 22, 147-152 (1971).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon