Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test organotypique à haute résolution imagerie time-lapse de la migration neuronale dans le cerveau postnatal
Dans cet article
Résumé
Ce protocole décrit une analyse organotypique optimisé pour le cerveau postnatal et à haute résolution imagerie time-lapse de la migration des neuroblastes dans le flux rostrale migrateurs.
Résumé
Neurogenèse dans le cerveau postnatal dépend du maintien de trois événements biologiques: la prolifération des cellules progénitrices, la migration des neuroblastes, ainsi que la différenciation et l'intégration de nouveaux neurones dans les circuits neuronaux existants. Pour neurogenèse postnatale dans les bulbes olfactifs, ces événements sont séparés dans les trois domaines anatomiquement distincts: la prolifération se produit essentiellement dans la zone sous épendymaire (ZES) des ventricules latéraux, la migration des neuroblastes parcourir à travers le flux migratoire rostral (RMS), et de nouveaux neurones se différencier et intégrer dans les bulbes olfactifs (OB). Les trois domaines servent de plateformes idéales pour étudier les mécanismes cellulaires, moléculaires et physiologiques qui régulent chacun des événements biologiques distinctement. Ce document décrit un essai organotypique optimisé pour les tissus du cerveau après la naissance, dans lequel les conditions extracellulaires imitent l'environnement in vivo pour la migration des neuroblastes. Nous montrons que notre test fournit pour le mouvement uniforme, orienté et rapide des neuroblastes dans le RMS. Ce test sera très approprié pour l'étude de la régulation des cellules autonomes et non autonomes de la migration neuronale en utilisant des approches inter-greffe de la souris sur les différents fonds génétiques.
Protocole
I. Procédures
Les techniques suivantes doivent être effectuées dans des conditions stériles, dans une hotte à flux laminaire, en utilisant des outils stérilisés.
Préparation de plats à fond de verre pour les tranches organotypiques
- Plats doit être préparé en milieu stérile et en utilisant des outils stérilisés.
- Une baisse de 150μL de milieu tranche (voir recettes) est placé dans le centre de la partie en verre-fond du plat avec soin pour éviter les bulles d'air dans le milieu.
- Avec une seringue jetable équipé d'une aiguille de calibre 23 Gauge, des taches multiples de colle (caoutchouc Ciment - Elmer, le chat # E904) sont placés sur les franges carrés adjacent à la lamelle circulaire qui occupe le centre de la boîte de culture, tout en laissant un côté non collé pour l'échange de fluide (figure 1). Le type de liste de colle n'est pas toxique pour les tranches ou les cellules comme appliquée dans ce protocole. Des précautions doivent être prises pour éviter de placer toute la colle sur la lamelle de verre, car cela empiéter sur l'imagerie et obstruer des tranches ultérieures. Une membrane Nucleopore (diamètre 25mm, la taille des pores 8.0μm - Whatman, cat # 110614) est placé sur le dessus de la lamelle de verre, en utilisant les points de colle pour le fixer en place. Cela devrait être fait à l'aide d'une pince micro, tout en s'assurant que les bulles d'air ne sont pas coincés entre la lamelle de verre et la membrane.
- Ajouter une tranche moyenne mL au-dessus de la membrane. Les plats sont placés dans un incubateur pendant 30 minutes et ensuite sur la glace, jusqu'au moment de servir.
Extraction de début des cerveaux postnatale
Les meilleurs résultats sont obtenus lorsque les tranches sont préparées à partir de jeunes souris postnatale (P1-P10).
- Les chiots sont en phase terminale anesthésiés (overdose) par isofluorane ou d'autres méthodes approuvées. La tête peut être pulvérisé avec 70% d'éthanol pour augmenter la stérilité, suivis par décapitation rapide en utilisant des ciseaux pointus.
- La tête est stabilisée par serrage la mandibule avec une pince micro. La peau est excisé longitudinalement à partir du cou à la gueule. Le crâne est coupé longitudinalement et en avant à partir de la grande citerne, en faisant une médiane et deux coupes latérales (une de chaque côté - la figure 2A). Des précautions doivent être prises pour minimiser le contact avec les tissus corticaux sous-jacente que les volets crâniens sont retirés loin du cerveau.
- Pour améliorer la stabilité du tissu pendant la coupe vibratome, les faces latérales plus du cerveau sont enlevés en faisant deux coupes sagittales. La partie caudale du cerveau est également supprimé en faisant une coupe à la base rostrale du cervelet (figure 2B).
- Les deux hémisphères sont séparés par faire une coupe en douceur le long de la fissure médiane, et les deux hémisphères sont soigneusement évidé du crâne et placé, face médiale vers le bas, dans un moule enrobage (fig. 2C-D).
Sectionnement du cerveau d'hôte
- Les deux hémisphères dans le moule intégration sont immédiatement couverts de fondu 3% à faible point de fusion du gel d'agarose ADN-grade (Fisher, le chat # BP1360-100) dissous dans du tampon de préparation des tissus qui est maintenue à 37 ° C (voir les recettes). Après 2 minutes de stabilisation sur une surface plane horizontale pour assurer même un durcissement de l'agarose, les moules sont placés sur la glace pour terminer le réglage.
- Une fois le gel contenant les hémisphères est réglé, il est retiré du moule et parés, laissant 2-3mm de gel dans le tissu cérébral.
- Le gel intégré tissu est ensuite monté sur la platine de l'vibratome, avec la face médiale en place, et fixé avec une colle cyanoacrylate (colle Krazy ou équivalent). Des précautions doivent être prises pour appliquer seulement des quantités minimes de colle, car trop auront des effets toxiques sur les cellules tranches et de migration. Trop de colle sur les côtés du bloc sera aussi entraver la coupe, causant des dommages potentiels dans le tissu.
- Le disque est installé dans le tiroir éprouvette remplie de vibratome glacée milieu de préparation des tissus.
- Le tissu est sectionné à l'épaisseur 150μm, avec la vitesse vibratome mis sur une gamme lente à moyenne (dépend du vibratome utilisés, et doit donc être déterminée indépendamment pour des résultats optimaux). Dans nos mains, la fréquence de vibration est optimale lorsqu'il est réglé au maximum. Les tranches qui suivent, peut être jeté.
- Dès que le RMS contenant des tranches sont libérés de la lame (le RMS est visible à l'œil nu comme un gris en forme de U s'étendant de la structure de la ZES à l'OB), ils sont soigneusement taquiné la sortie du moule de gel, et raflé en utilisant une petite spatule plate. Les tranches sont placées sur la membrane Nucleopore des plats à fond de verre contenant du milieu de tranche (figure 3A-B). Un type précoce du cerveau de souris postnatale donnera environ 2-3 sections RMS par hémisphère lorsqu'il est coupé à 150 um. Il est essentiel que la manipulation des tranches est réduit au minimum car ils sont très fragiles. Les plats avec les tranches sont ensuite transférés dans un incubateur.
Le cerveau des donateurssectionnement et la transplantation RMS
- Les cerveaux des donateurs (les cerveaux expriment des reporters fluorescents dans la migration des neuroblastes) sont sectionnés à une épaisseur de 250μm et les tranches sont collectées dans tampon glacé de préparation des tissus.
- Les tranches sont immédiatement placés sous un microscope à dissection avec la capacité à épifluorescence, et le RMS est doucement microdisséquées, en utilisant une pince micro. Une pince est utilisée pour stabiliser la tranche alors que l'autre est utilisé pour faire de petites coupures autour du RMS jusqu'à ce qu'il soit libéré de la tranche. L'excision RMS est ensuite coupée en petits explants (environ 200 à 500 um de diamètre) avant la transplantation.
- À fond de verre plats contenant des tranches d'hôte positionnés sur les filtres Nucleopore sont retirés de l'incubateur et placées sous la loupe binoculaire. En utilisant la lumière visible, le RMS est clairement identifié et une petite incision est faite dans le segment initial de la RMS.
- En utilisant une pipette équipée d'un pourboire de 20 uL, un seul donateur RMS explant est transféré sur le site incisé dans le RMS hôte. L'explant est doucement poussé dans l'incision pour établir le contact entre les deux tissus. Pour assurer ce contact est stable, les explants sont poussés légèrement entre la tranche et la membrane Nucleopore.
- Une fois toutes les tranches d'hôte avec le RMS sont transplantés, les plats sont retournés à la couveuse pendant au moins 1 heure pour permettre de régler les sections sur la membrane. Neuroblastes devrait commencer à migrer de l'explant dans l'hôte RMS après environ 1-2 heures.
Imagerie time-lapse de la migration neuronale
- Les plats à fond de verre sont transférés de l'incubateur de la chambre de incubées sur le microscope (figure 3C). Neuroblastes fluorescentes peuvent être imagées à intervalles allant de 0 à 10 minutes selon le type d'analyse désirée. Par exemple, nous l'image dynamique du cytosquelette au cours du cycle migratoire des neuroblastes individu par l'établissement de nos intervalles inférieurs ou égaux à 2,5 minutes. Toutefois, la dynamique des populations tels que l'orientation et la vitesse de migration sont plus capturées à intervalles allant de 5 à 10 minutes. Le choix des objectifs est très variable selon la marque du microscope. Pour un microscope confocal Nikon C1, nous constatons que l'objectif 20x à sec (Nikon Fluor Pan, NA 0,75, 0,35 DEO) est le plus approprié pour nos analyses. Pour de meilleurs résultats sur ce système confocal, le sténopé est ouvert à une taille moyenne (60μm de diamètre). Pour le comportement migratoire le plus approprié, l'imagerie est confiné aux cellules profondément dans l'épaisseur de la RMS, au moins 20 um loin de l'une des deux surfaces de coupe de la tranche. Puissance du laser doit être optimisé de sorte qu'il est à un minimum, mais que les détails de neuroblastes individuelles restent visibles.
- Une fois l'imagerie est terminée tranches peut être fixé par le froid de la glace, et fraîchement préparés paraformaldéhyde à 4%, immunocolorés, et montées sur des lames pour l'imagerie supplémentaires. Puisque nous n'avons pas nos membranes manteau avec un substrats adhérente comme la laminine, les tranches généralement flotter loin de la membrane une fois qu'ils sont plongés dans les tampons coloration. Les articles sont imagés, tout en maintenant leurs 150 micron d'épaisseur. Il est également possible de congeler et de geler les tranches et l'utilisation d'un cryostat d'obtenir des sections plus minces tranches de l'original. Toutefois, cela se traduira par augmentation de l'incidence des artefacts de coloration ainsi que altérer l'intégrité des tissus.
II. Matériaux / équipement
Préparation de plats à fond de verre pour les tranches organotypiques
- Petites seringues (1 ml)
- 23 aiguilles de calibre
- Nucleopore Track-Etch membrane - 25mm de diamètre, la taille des pores 8.0μm - Whatman, cat # 110614
- Plats à fond de verre de la culture - 35mm boîte de Petri, 14mm micropuits, n ° 1.5 lamelle - MatTech, cat # P35G-1.5-14-C
- Caoutchouc Ciment - Elmer, le chat # E904
- Milieu de base Eagle - Gibco, # cat 21010
- Hepes 1M (pH 7,4)
- 1M D-glucose
- 100 mM CaCl 2
- 100 mM MgSO 4
- 1M NaHCO 3
- dH 2 O
- 200 mM de L-glutamine
- Pénicilline-streptomycine
L'extraction du cerveau et enrobage
- Anesthésique (isofluorane, etc)
- Four micro-ondes
- Faible fusion Agarose - Fisher, le chat # BP1360-100
- Krazy Glue - # cat KG585
- Peel-A-Way Moules Embedding jetables (R-40) - 22mmx40mm rectangulaire, 20mm de profondeur - Polysciences, cat # 18646C
Sectionnement du cerveau et de la transplantation RMS
- Vibratome - Leica VT1000S et tous les composants d'accessoires pour la préparation des tranches
- 10X Hank Balanced Salt Solution - Gibco, # cat 14185
- Pince Microdissecting # 5 - Roboz, chat # RS-4976
- Microspatule - Fisher, le chat # 21-401-15
- Stéréomicroscope
Imagerie time-lapse detranches organotypiques
- Incubateur humidifié, 5% de CO 2
- Microscope inversé équipé d'incubateur de chambre et à longue distance des objectifs de travail (NA de 0,6 ou supérieur)
III. Recettes
Solution tampon pour la dissection des tissus et préparation de tranches (tampon de préparation des tissus)
| Solution mère | Volume | Concetration finale |
| HBSS 10X | 50 ml | 1X |
| Hepes 1M (pH 7,4) | 1,25 mL | 2,5 mM |
| 1M D-glucose | 15 ml | 30 mM |
| 1M CaCl 2 | 0,5 ml | 1mM |
| 1M MgSO 4 | 0,5 ml | 1mM |
| 1M NaHCO 3 | 2 ml | 4 mM |
| dH 2 O | 430,75 ml |
Stériliser par filtration avec un filtre de 0,2 um et stocker à 4 ° C.
Le milieu de culture pour les tranches organotypiques, la transplantation de tissus et d'imagerie (moyennes tranche)
| Solution mère | Volume | Concentration finale |
| Medium base de Eagle | 35 ml | |
| Tampons de préparation des tissus | 12,9 ml | |
| 1M D-glucose | 1,35 ml | 20 mM |
| 200 mM de L-glutamine | 0,25 mL | 1mM |
| Pénicilline-streptomycine | 0,5 ml | 100units / ml de pénicilline et 0,1 mg / mL de streptomycine |
Stériliser par filtration avec un filtre de 0,2 um et stocker à 4 ° C.
Préparation de bas point de fusion du gel d'agarose point de
Faible point de fusion d'agarose est dilué dans un tampon de préparation des tissus à 0,3 g / ml dans un tube conique de 50 ml (voir recettes). Le tube est au micro-ondes par incréments de 5-10 secondes à haute puissance. Nombre d'incréments dépend du volume total; pour 10 ml, trois tranches (10-8-5 secondes chacun) devraient suffire. Le capuchon du tube est soigneusement dévissée entre les incréments de chauffage pour relâcher la pression de l'air et éviter l'explosion du tube. Précautions doivent être prises comme le contenu du tube sera très chaud. Une fois que l'agarose est complètement dissous, le tube est maintenu dans un bain d'eau à 37 ° C pendant au moins 5 minutes pour permettre à la température se stabilise avant de l'utiliser. Une exposition prolongée à la température ambiante va durcir le gel. Bien que ceci doit être évité autant que possible, le gel durci peut être réchauffé et refondu pour une utilisation immédiate dans les 24 heures de préparation initiale.
L'immunohistochimie sur des tranches organotypiques
Suite à l'imagerie sur le microscope confocal, des tranches peut être fixé une nuit à 4 ° C avec du formaldéhyde 4% dans du PBS. Les articles sont ensuite bloquées pendant une nuit à 4 ° C, dans du sérum de chèvre 10% avec 1% de Triton X (Sigma, Cat. # S26-36-23) dans le PBS suivie par une nuit d'incubation avec des anticorps primaires à 4 ° C. Anticorps de chèvre marqués à la fluorescence secondaire sont utilisés pour la visualisation (tous 1:1000 dilué, 1 heure d'incubation à température ambiante). Tranches marquées sont soigneusement lavés 5-6 fois avec PBS glacé avant le montage sur lames de verre et de lamelles.
IV. Les résultats représentatifs
Notre protocole de culture organotypique tranche a été soigneusement testé et optimisé sur ces dernières années que pour la cohérence dans le modèle de migration et d'orientation. L'analyse des cellules d'émigrer à partir d'explants obtenus à partir des souris dans lesquelles l'expression de la protéine fluorescente rouge, TD-tomate, est induite sous le promoteur nestine (nestine-Td tomate), révèle la migration très orientée et rapide de tdTomato + neuroblastes dans le RMS hôte ( Figure 4A). Fort grossissement time-lapse analyse illustre excellente résolution de toute la longueur d'une migration des neuroblastes lors d'une séance d'imagerie de 20 minutes (figure 4B).
Tranches avec des bailleurs de fonds Td-tomate + cellules ont été fixées et immunocolorées pour les différents composants cellulaires dans le RMS. GFAP + astrocytes et CD31 + vaisseaux sanguins ont été révélées par immunohistochimie fluorescente (figure 5A). L'analyse fort grossissement des tranches colorées pour l'actine du cytosquelette des protéines et la tubuline révèlent non uniforme expression de ces composants par une cellule au milieu de la migration (figure 5B).
Les anticorps utilisés dans leces exemples: lapin anti-DP (Abcam, 1:250), de lapin anti-GFAP (Dako, 1:1000), de rat anti-CD31 (BD Pharmigen, 1:100), de souris anti-actine (Santa Cruz, 1: 500), de lapin anti-tubuline (Sigma, 1:1000), de chèvre anti-souris Cy3 (Chemicon, 1:1000), de chèvre anti-lapin AlexaFluor 647 (Invitrogen, 1:1000), de chèvre anti-rat AlexaFluor 488 (Invitrogen , 1:1000), de chèvre anti-lapin AlexaFluor 488 (Invitrogen, 1:1000).
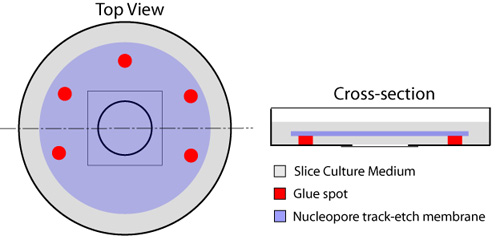
Figure 1. Préparation du fond de verre plats pour les tranches organotypiques. Taches multiples de colle sont placés autour de la circulaire à fond de verre composante du plat (en rouge), laissant un côté ouvert pour l'échange de milieu du dessous du filtre. Une baisse de 150μL de milieu tranche est placé dans le centre de la lamelle de verre. Une membrane Nucleopore (bleu) est alors appliqué, côté brillant vers le bas, tout en veillant à ce qu'aucune bulle d'air emprisonnées entre la lamelle de verre et la membrane. Un millilitre de milieu de tranche (gris) est étalée sur le dessus de la membrane, et les plats sont incubées à 37 ° C avant utilisation.
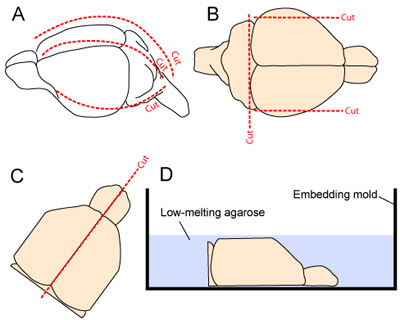
Figure 2. L'extraction du cerveau et de la préparation pour la coupe. (A) Le crâne est exposé par incision du cuir chevelu, du cou au museau (ligne pointillée le long de la ligne médiane). Le crâne est ensuite coupé longitudinalement et en avant à partir de la grande citerne, en faisant une médiane et deux coupes latérales (une de chaque côté; 2A). (B) les aspects latéraux plus du cortex et la partie caudale du SNC sont réséquée afin d'améliorer la stabilité du tissu pendant la coupe vibratome. (CD) Les deux hémisphères sont ensuite séparés et placés face médiale dans un moule intégration avant l'application du gel d'agarose 3% dissous dans du tampon de préparation des tissus.
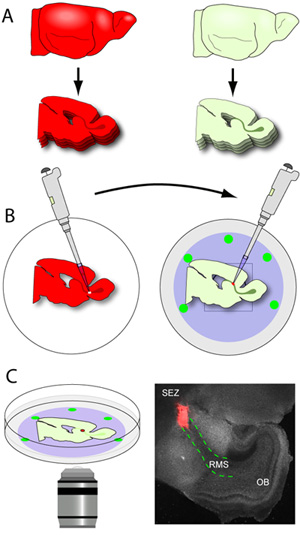
Figure 3. Sectionnement du cerveau et de la Croix-transplantation. (A) Le tissu hôte est sectionnée au niveau de l'épaisseur 150μm, et les sections contenant RMS sont soigneusement positionnés à plat sur la membrane Nucleopore de froid à fond de verre plats. (B) les cerveaux des donateurs (les cerveaux expriment des reporters fluorescents dans le RMS) sont sectionnés au épaisseur de 250μm, et les tranches sont collectées dans tampon glacé de préparation des tissus. Le RMS donneur est microdisséquées et les couper en petits explants. En utilisant une pipette équipée d'un pourboire de 20 uL, individuels explants RMS sont transférés vers un site incisé dans le RMS hôte. (C) Après 1-2 heures d'incubation, les plats sont transférés à un stade incubée sur un microscope confocal et de la migration est capturé utilisant imagerie time-lapse. La microphotographie est un représentant de faible grossissement de l'image d'une tranche typique (gris) mis en place 1 heure après la transplantation (explant rouge de tdTomato + RMS d'une souris donneuse, le rouge des lignes en pointillé le RMS dans la tranche d'hôte).
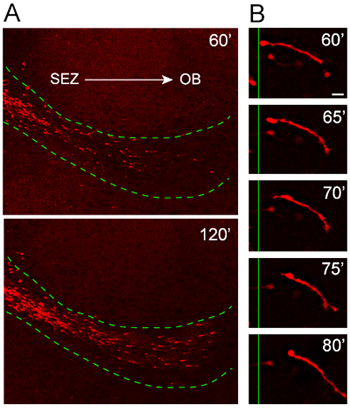
Figure 4. La migration des neuroblastes à partir d'explants dans le RMS hôte. (A) nestine tdTomato + neuroblastes (rouge) migrent à partir des explants dans l'hôte (ligne pointillée verte) RMS 1 heure après la transplantation. tdTomato + cellules envahissant le RMS de l'hôte tranches organotypiques déplacer d'une manière très orientée et rapide loin de la ZES et vers l'OB. (B) Le cycle migratoire peut être observée dans de forte puissance time-lapse images d'un neuroblaste sur environ une période de 20 minutes. Barre d'échelle = 10 um.
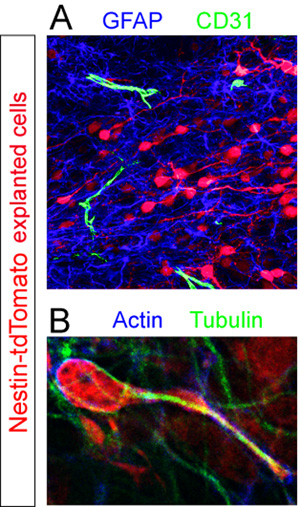
Figure 5. L'évaluation immunohistochimique des tranches organotypiques. Neuroblastes explantés (rouge) ont été fixés dans le milieu de la migration 12 heures après la transplantation. (A) Fluorescent coloration immunohistochimique de la tranche révèle une piscine dense de la GFAP + astrocytes (en bleu) et éparses CD31 + des vaisseaux sanguins (vert) dans le RMS de la tranche d'hôte (B). Le cytosquelette d'une cellule isolée tdTomato + migration (rouge) dans un RMS hôte est révélé par la co-immunomarquage utilisant des anticorps contre l'actine (en bleu) et la tubuline (vert).
Discussion
La migration neuronale dans le RMS est une composante essentielle de la neurogenèse postnatale dans les bulbes olfactifs 1. La migration à travers le RMS se produit dans un plan tangentiel à la surface du cerveau. Neuroblastes migrent tangentiellement sont distinctes de la migration des cellules radialement basés sur la localisation de leur source progénitrices, ainsi que le sort de leurs divergences produits finis neuronale 1, 2, 3. La population est relativement pure de cellules migrent tang...
Déclarations de divulgation
Remerciements
Nous tenons à remercier Dan McWhorter pour raconter le protocole dans la vidéo. Ce travail est soutenu par des subventions du NIH 5R01NS062182, une subvention de la Fédération américaine pour la recherche sur le vieillissement, et les fonds institutionnels attribué à HTG.
Références
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon