Method Article
La ventilation à pression contrôlée pour induire lésion pulmonaire aiguë chez la souris
Dans cet article
Résumé
Un modèle murin de blessure ventilateur pulmonaire induite est un outil important pour étudier une lésion pulmonaire aiguë In vivo. Ici, nous rapportons une applicables faciles In situ Modèle pour les lésions pulmonaires aiguës à haute pression de ventilation mécanique pour provoquer l'échec aigu du poumon.
Résumé
Les modèles murins sont largement utilisées pour étudier les lésions aiguës de systèmes différents organes (1-34). Lésion pulmonaire aiguë (ALI), qui se produit avec une ventilation mécanique prolongée, contribue à la morbidité et la mortalité des maladies graves, et des études sur de nouvelles cibles génétiques ou pharmacologiques sont des zones d'intense investigation (1-3, 5, 8, 26, 30, 33 -36). ALI est défini par la survenue aiguë de la maladie, ce qui conduit à la non-cardiaques œdème pulmonaire et une insuffisance pulmonaire ultérieure de l'échange de gaz (36). Nous avons développé un modèle murin de l'ALI en utilisant une ventilation à pression contrôlée pour induire des lésions pulmonaires induites par un ventilateur (2). A cet effet, des souris C57BL / 6 sont anesthésiés et une trachéotomie est effectuée suivie par l'induction de l'ALI par ventilation mécanique. Les souris sont ventilés dans un cadre à la pression contrôlée avec une pression inspiratoire de pointe de 45 mbar plus de 1 - 3 heures. Comme paramètres de résultats, un oedème pulmonaire (humide à sec ratio), la teneur en fluide broncho-albumine, fluide broncho-pulmonaire et le contenu myéloperoxydase des tissus et des échanges gazeux pulmonaires sont évaluées (2). En utilisant cette technique nous avons pu montrer qu'il induit une inflammation pulmonaire aiguë suffisante et permet de distinguer entre les différents groupes de traitement ou de génotypes (1-3, 5). Par conséquent, cette technique peut être utile pour les chercheurs qui poursuivent des mécanismes moléculaires impliqués dans ALI utilisant une approche génétique chez la souris avec le gène ciblé suppression.
Protocole
Remarques générales:
Toutes les opérations doivent être effectuées sous un microscope droit dissection (Olympus, SZX10 avec Postes Crank Z-Axis avec STU2 perche Stand) et en utilisant un coagulateur chirurgical (11). Les groupes expérimentaux doivent correspondre le mieux possible dans l'âge et le poids pour assurer la comparabilité des résultats. L'administration de la température, la pression sanguine, l'anesthésie et le liquide doit être stable tout au long.
1. L'anesthésie et la préparation trachée
- Utilisez des souris C57BL / 6 qui sont au moins 10 semaines et avoir un corps de 22-25 g. Induire une anesthésie à l'aide de pentobarbital de sodium à une dose de 70 mg / kg de poids corporel ip (6). Maintenir une anesthésie d'environ de 10 mg / kg / h de pentobarbital de sodium. Soyez prudent avec le surdosage car cela pourrait considérablement baisser la pression artérielle. Re-dosage du pentobarbital - même après-heures peut conduire à une augmentation sévère du taux plasmatique.
- Après l'induction anesthésique, souris sécurisé en décubitus dorsal avec les membres supérieurs et inférieurs attachés à la table à l'aide d'un ruban et une suture attachée aux chevilles. Faites de même pour la tête en utilisant les dents. Retenue suffisant est important pour une intubation réussie et une chirurgie bien contrôlé. Avant la chirurgie, la couverture de la souris avec de l'huile minérale pour réduire le risque d'allergie poils de souris. Afin de s'assurer que la température du corps reste stable couvrir la souris avec une pellicule de la nourriture disponible dans le commerce.
- Souris sur une table chauffée à température contrôlée (RT, Effenberg, Munich, Allemagne) avec une sonde thermomètre rectal attachés au contrôleur de rétroaction thermique pour maintenir la température corporelle à 37 ° C.
- Exposer la trachée chirurgicalement. Disséquer faces latérales et dorsale de la trachée du tissu conjonctif et placer deux 3,0 suture de soie chirurgicale (Harvard Apparatus, USA) à chaque 10 cm de long au-dessous de la trachée. Les sutures doivent être d'environ 1 cm d'intervalle.
- Soigneusement inciser la trachée 3 - 4 mm en dessous du larynx entre les deux cartilages circulaire en utilisant une paire de ciseaux McPherson Vannas (8 cm, lame droite; Instruments de précision Mondiale, USA). Veillez à ne pas provoquer une hémorragie, car cela pourrait confondre les paramètres de résultats.
- Effectuer une intubation trachéale avec un polyéthylène émoussée canules (Insyte 22g, Beckton Dickinson, USA). Insérez l'extrémité de la canule de polyéthylène dans un angle 85 degrés dans la trachée. Puis inclinez le canules il est donc en ligne avec la lumière trachéale. Lentement l'avance le tube plus bas de la trachée jusqu'au bout des canules a disparu dans l'ouverture du thorax. Fixer le tube dans cette position avec la suture de soie deux chirurgicale placé dorsale de la trachée (voir 1.4).
2. Technique des lésions pulmonaires induites par un ventilateur
- Connecter le tube d'un ventilateur. Pour induire des lésions pulmonaires, nous utilisons une technique de ventilation à pression contrôlée en utilisant un servo 900 C de Siemens (DRE vétérinaire, USA). Les animaux seront ventilés en utilisant pic de pression inspiratoire de 45 mbar, la fréquence de 80 cycles / min et une pression expiratoire positive de 0-3 mbar avec une FiO 2 = 1,0. L'inspiration ratio d'expiration doit être de 1:1. Malgré le fait que le servo 900 C est construit comme un ventilateur pour les humains, son utilisation dans un cadre ventilateur à pression contrôlée excellents ouvrages pour la ventilation de la souris.
- Moniteur de fréquence cardiaque avec un ECG (par exemple, Hewlett Packard, B blingen, Allemagne). Assurez-vous que la fréquence cardiaque ne chute pas en dessous de 400. On devrait voir un changement de l'axe du cœur vers la droite, lorsque la ventilation mécanique est instituée comme un signe d'augmentation de la pression artérielle pulmonaire suite à une augmentation de la pression intrathoracique. Si la souris se développe une bradycardie, vérifiez la température et la dose d'anesthésique / concentration. Xylacin / kétamine anesthésie induit un cœur plein cœur de 250 / min et n'est donc pas recommandé.
- Appliquer une réhydratation correcte. Une infusion avec une solution saline normale 0,1 ml / heure par l'intermédiaire d'un cathéter artériel ou veineux doit être effectuée avant la ventilation pour assurer le dépôt veineuse suffisante. En raison des pressions de ventilation élevées le retour veineux vers le cœur est altérée, ce qui pourrait conduire à une baisse critique de la pression artérielle moyenne. En outre, un bolus salins de 500 ul pourrait être donnée ip avant la chirurgie.
- Placer un cathéter dans l'artère carotide pour l'enregistrement continu de la pression artérielle (27). Fixer le bras au corps avant de commencer la dissection de l'artère. L'artère carotide est exposé via dissection des muscles paratrachéal. Suite à une exposition plus loin et d'éviter soigneusement tout traumatisme tissulaire (notamment du nerf vagal), un cathéter est introduit dans le vaisseau en utilisant deux points de suture et une petite pince (37). Cela permettra d'exposer un segment plus long de l'artère. Placez une ligature à l'extrémité de l'artère carotide. Attacher une grande pince à l'extrémité de la suture d'obtenir ème tension ou fixere de suture à la table avec du ruban. Placez un autre fil de suture autour de l'artère et de disséquer l'artère à la fin distale. Ici, place une petite pince. Utilisez des ciseaux pour couper les micro une petite ouverture en diagonale dans l'artère. Tenir l'ouverture avec une pince fine (Dumont, WPI) et de faire progresser le cathéter bonne taille avec vos mains / forceps. Faites un noeud à votre deuxième suture et sécuriser l'artère. Desserrer le collier et de faire avancer le cathéter supplémentaire. Fixez le cathéter avec plusieurs noeuds et ruban adhésif. Alternativement, le cathéter dans l'artère carotide peut être lieu à la fin de l'expérience pour recueillir des échantillons de sang artériel pour analyse des gaz sanguins.
3. Récupération des échantillons de tissus
Après 3 heures de ventilation mécanique, les échantillons sont prélevés pour évaluer l'étendue des lésions pulmonaires. Nous recommandons la collecte du liquide de lavage brochnoalveolar (BAL), le sang artériel et les tissus pulmonaires.
- Obtenir le liquide de LBA à la fin de l'expérience. Après l'approfondissement de l'anesthésie, rincer la sonde trachéale avec 1 ml de phosphate saline tamponnée (PBS). Le liquide doit rester dans la trachée / poumon pendant trois secondes avant qu'il ne soit reprise par la seringue connectée. Le BAL est enfichable congelés dans l'azote liquide et conservés à -80 ° C pour analyse ultérieure. Soyez conscient que le volume récupéré pourrait être sensiblement inférieure à 1 ml.
- Effectuer une analyse des gaz du sang à la fin de l'expérience. Pour ce faire, une incision doit être faite juste en dessous du sternum. Tenez le sternum avec une pince et l'étendue de l'incision le long de la cage thoracique. Ensuite, le diaphragme est incisé sur les bords et est découpé dans les côtes. Maintenant, il ya une vue imprenable sur l'ouverture inférieure du thorax. Soulevez le sternum avec une pince et d'ouvrir le thorax par des coupures longues sur le côté droit et gauche (comme latéral que possible) afin que la paroi thoracique antérieure complète est monté-pupilles. Cela devrait être fait, alors que l'animal est encore expérimentale ventilés mécaniquement. Le ventricule gauche est percé en utilisant une aiguille de 27 G ½ et l'analyse du sang artériel est réalisée en utilisant le système i-STAT (Abbott, USA). Si l'analyse du sang artériel de gaz doit être effectuée, un BAL ne peut être obtenu, puisque ce sera un facteur de confusion important pour les résultats.
- Alternativement à la méthode ci-dessus, des échantillons de sang artériel peut être collectées via le cathéter dans l'artère carotide. Cependant cela doit être fait avant la BAL est obtenu.
- D'accise dans les poumons en bloc en tirant sur le cœur et couper la trachée. Avoir un morceau de tissu prêt à absorber le sang, de sorte que le site chirurgical est visible. Tirez sur le coeur dans le sens de l'abdomen et soigneusement couper le long de la colonne vertébrale de mobiliser tous les organes thoraciques. Coupez l'aorte, enlever les organes thoraciques et les placer sur une table propre chirurgicale.
- Coupez le cœur et le vaisseau principal de l'échantillon de tissu. Assurez-vous qu'il n'ya pas de tissu thymique encore attaché au poumon. Séparez les poumons avec un ciseau et le placer dans des tubes individuels et snap-gel. Conserver à -80 ° C pour analyse ultérieure.
4. Mesure des lésions pulmonaires
Nous vous recommandons d'utiliser les paramètres résultats suivants pour évaluer l'étendue des lésions pulmonaires: Effectuer une albumine ELISA (Bethyl Laboratories, USA) et un myéloperoxydase (MPO) ELISA (Hycult biotechnologie, USA) pour évaluer l'ampleur du dysfonctionnement de la barrière et le montant des maladies inflammatoires cellules dans le liquide de LBA. Effectuer une MPO ELISA également former le tissu pulmonaire. Si humides à sèches ratio est d'être mesurée, nous n'obtenons pas le liquide de LBA et de la circulation pulmonaire n'est pas rincé (voir 3.3). Mesurer le poids des poumons après l'excision. Puis poumons sont lyophilisés pendant 48 h et le tissu pulmonaire est à nouveau mesurée. Puis le rapport humides à sec est mesuré en mg d'eau par mg de tissu sec (5).
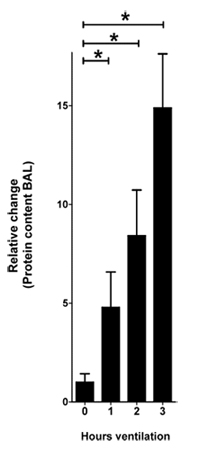
Figure 1. Teneur en protéines dans la BAL en réponse à l'IVL. Des souris ont été anesthésiés avec du pentobarbital, la ventilation mécanique a été institué et les souris ont été ventilés en utilisant la pression contrôlée par les paramètres (pression inspiratoire de 45 mbar, positive en fin d'exspiratory pression 3 mbar, 100% d'inspiration concentration en oxygène). Après 0, 1 heure, 2 et 3 de la ventilation BAL a été récoltée et la teneur en protéines a été quantifiée en utilisant un dosage acide bicinchoninique (test BCA). La variation relative de la teneur en protéines est montré normalisée à 0 heures de ventilation (n = 4 par groupe, * indique p <0,05 par rapport au témoin, moyenne ± SEM)
Discussion
La présente étude décrit une technique d'effectuer une lésion pulmonaire ventilation induite chez la souris. Ce modèle démontre blessures hautement reproductible grâce à la ventilation à haute pression. Les enquêteurs qui considèrent l'étude des lésions aiguës du poumon chez les souris peuvent bénéficier de ce modèle.
Déclarations de divulgation
Remerciements
Les études actuelles sont soutenues par National Heart, Lung, and Blood Institute Grant R01-HL0921, R01-DK083385 et R01HL098294 à HK Eltzschig, le 1K08HL102267-01 à T. Eckle, et la Fondation pour l'éducation d'anesthésie et de subventions de recherche à T. Eckle et HK Eltzschig, et l'American Heart Association à T. Grant Eckle et HK Eltzschig et Deutsche Forschungsgemeinschaft bourse de recherche (DFG) à M. Koeppen.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Pentobarbital sodique (Fatal Plus) | Ls Vortech pharmaceutique, Ltd, | VPL 9372 | 4mg/mL dans une solution saline |
| Insyte 22 G | Beckton Dickinson | n / a | |
| Suture, soie 4,0 | Harvard Apparatus | 517698 | |
| Suture, Prolène 8.0 | Ethicon, USA | M8739 | réutilisables |
| Siemens 900 ° C | DRE vétérinaire, USA | # 336 | rénové |
| microscope à dissection (SZX10) | Olympus | n / a | considère la distance de travail généreuse |
| Tableau de chauffage | Rt, Effenberger, Allemagne | n / a | fournisseur de la seule et unique |
| Dispositif de pression artérielle | Sens Cyber, Inc | BPM02 | |
| STAT-je | Abbott | n / a |
Références
- Eckle, T., Faigle, M., Grenz, A., Laucher, S., Thompson, L. F., Eltzschig, H. K. A2B adenosine receptor dampens hypoxia-induced vascular leak. Blood. 111, 2024-2035 (2008).
- Eckle, T., Fullbier, L. G. r. e. n. z., A, ., Eltzschig, H. K. Usefulness of pressure-controlled ventilation at high inspiratory pressures to induce acute lung injury in mice. Am J Physiol Lung Cell Mol Physiol. 295, 718-724 (2008).
- Eckle, T., Fullbier, L., Wehrmann, M., Khoury, J., Mittelbronn, M., Ibla, J., Rosenberger, P., Eltzschig, H. K. Identification of ectonucleotidases CD39 and CD73 in innate protection during acute lung injury. J Immunol. 178, 8127-8137 (2007).
- Eckle, T., Grenz, A., Kohler, D., Redel, A., Falk, M., Rolauffs, B., Osswald, H., Kehl, F., Eltzschig, H. K. Systematic evaluation of a novel model for cardiac ischemic preconditioning in mice. Am J Physiol Heart Circ Physiol. 291, 2533-2540 (2006).
- Eckle, T., Grenz, A., Laucher, S., Eltzschig, H. K. A2B adenosine receptor signaling attenuates acute lung injury by enhancing alveolar fluid clearance in mice. J Clin Invest. 118, 3301-3315 (2008).
- Eckle, T., Krahn, T., Grenz, A., Kohler, D., Mittelbronn, M., Ledent, C., Jacobson, M. A., Osswald, H., Thompson, L. F., Unertl, K., Eltzschig, H. K. Cardioprotection by ecto-5'-nucleotidase (CD73) and A2B adenosine receptors. Circulation. 115, 1581-1590 (2007).
- Eltzschig, H. K. Adenosine: an old drug newly discovered. Anesthesiology. 111, 904-915 (2009).
- Eltzschig, H. K., Eckle, T., Mager, A., Kuper, N., Karcher, C., Weissmuller, T., Boengler, K., Schulz, R., Robson, S. C., Colgan, S. P. ATP release from activated neutrophils occurs via connexin 43 and modulates adenosine-dependent endothelial cell function. Circ Res. 99, 1100-1108 (2006).
- Eltzschig, H. K., Ibla, J. C., Furuta, G. T., Leonard, M. O., Jacobson, K. A., Enjyoji, K., Robson, S. C., Colgan, S. P. Coordinated adenine nucleotide phosphohydrolysis and nucleoside signaling in posthypoxic endothelium: role of ectonucleotidases and adenosine A2B receptors. J Exp Med. 198, 783-796 (2003).
- Eltzschig, H. K., Kohler, D., Eckle, T., Kong, T., Robson, S. C., Colgan, S. P. Central role of Sp1-regulated CD39 in hypoxia/ischemia protection. Blood. 113, 224-232 (2009).
- Frick, J. S., MacManus, C. F., Scully, M., Glover, L. E., Eltzschig, H. K., Colgan, S. P. Contribution of adenosine A2B receptors to inflammatory parameters of experimental colitis. J Immunol. 182, 4957-4964 (2009).
- Grenz, A., Eckle, T., Zhang, H., Huang, D. Y., Wehrmann, M., Kohle, C., Unertl, K., Osswald, H., Eltzschig, H. K. Use of a hanging-weight system for isolated renal artery occlusion during ischemic preconditioning in mice. Am J Physiol Renal Physiol. 292, 475-485 (2007).
- Grenz, A., Osswald, H., Eckle, T., Yang, D., Zhang, H., Tran, Z. V., Klingel, K., Ravid, K., Eltzschig, H. K. The Reno-Vascular A2B Adenosine Receptor Protects the Kidney from Ischemia. PLoS Medicine. 5, e137-e137 (2008).
- Grenz, A., Zhang, H., Eckle, T., Mittelbronn, M., Wehrmann, M., Kohle, C., Kloor, D., Thompson, L. F., Osswald, H., Eltzschig, H. K. Protective role of ecto-5'-nucleotidase (CD73) in renal ischemia. J Am Soc Nephrol. 18, 833-845 (2007).
- Grenz, A., Zhang, H., Hermes, M., Eckle, T., Klingel, K., Huang, D. Y., Muller, C. E., Robson, S. C., Osswald, H., Eltzschig, H. K. Contribution of E-NTPDase1 (CD39) to renal protection from ischemia-reperfusion injury. FASEB J. 21, 2863-2873 (2007).
- Grenz, A., Zhang, H., Weingart, J., von Wietersheim, S., Eckle, T., Schnermann, J. B., Kohle, C., Kloor, D., Gleiter, C. H., Vallon, V., Eltzschig, H. K., Osswald, H. Lack of effect of extracellular adenosine generation and signalling on renal erythropoietin secretion during hypoxia. Am J Physiol Renal Physiol. , (2007).
- Haeberle, H. A., Durrstein, C., Rosenberger, P., Hosakote, Y. M., Kuhlicke, J., Kempf, V. A., Garofalo, R. P., Eltzschig, H. K. Oxygen-independent stabilization of hypoxia inducible factor (HIF)-1 during RSV infection. PLoS ONE. 3, e3352-e3352 (2008).
- Hart, M. L., Gorzolla, I. C., Schittenhelm, J., Robson, S. C., Eltzschig, H. K. SP1-dependent induction of CD39 facilitates hepatic ischemic preconditioning. J Immunol. 184, 4017-4024 (2010).
- Hart, M. L., Henn, M., Kohler, D., Kloor, D., Mittelbronn, M., Gorzolla, I. C., Stahl, G. L., Eltzschig, H. K. Role of extracellular nucleotide phosphohydrolysis in intestinal ischemia-reperfusion injury. FASEB J. 22, 2784-2797 (2008).
- Hart, M. L., Jacobi, B., Schittenhelm, J., Henn, M., Eltzschig, H. K. Cutting Edge: A2B Adenosine receptor signaling provides potent protection during intestinal ischemia/reperfusion injury. J Immunol. 182, 3965-3968 (2009).
- Hart, M. L., Kohler, D., Eckle, T., Kloor, D., Stahl, G. L., Eltzschig, H. K. Direct treatment of mouse or human blood with soluble 5'-nucleotidase inhibits platelet aggregation. Arterioscler Thromb Vasc Biol. 28, 1477-1483 (2008).
- Hart, M. L., Much, C., Gorzolla, I. C., Schittenhelm, J., Kloor, D., Stahl, G. L., Eltzschig, H. K. Extracellular adenosine production by ecto-5'-nucleotidase protects during murine hepatic ischemic preconditioning. Gastroenterology. 135, 1739-1750 (2008).
- Hart, M. L., Much, C., Kohler, D., Schittenhelm, J., Gorzolla, I. C., Stahl, G. L., Eltzschig, H. K. Use of a hanging-weight system for liver ischemic preconditioning in mice. Am J Physiol Gastrointest Liver Physiol. 294, 1431-1440 (2008).
- Hartmann, H., Eltzschig, H. K., Wurz, H., Hantke, K., Rakin, A., Yazdi, A. S., Matteoli, G., Bohn, E., Autenrieth, I. B., Karhausen, J., Neumann, D., Colgan, S. P., Kempf, V. A. Hypoxia-independent activation of HIF-1 by enterobacteriaceae and their siderophores. Gastroenterology. 134, 756-767 (2008).
- Heinzelmann, F., Jendrossek, V., Lauber, K., Nowak, K., Eldh, T., Boras, R., Handrick, R., Henkel, M., Martin, C., Uhlig, S., Kohler, D., Eltzschig, H. K., Wehrmann, M., Budach, W., Belka, C. Irradiation-induced pneumonitis mediated by the CD95/CD95-ligand system. J Natl Cancer Inst. 98, 1248-1251 (2006).
- Koeppen, M., Eckle, T., Eltzschig, H. K. Selective deletion of the A1 adenosine receptor abolishes heart-rate slowing effects of intravascular adenosine in vivo. PLoS One. 4, e6784-e6784 (2009).
- Kohler, D., Eckle, T., Faigle, M., Grenz, A., Mittelbronn, M., Laucher, S., Hart, M. L., Robson, S. C., Muller, C. E., Eltzschig, H. K. CD39/ectonucleoside triphosphate diphosphohydrolase 1 provides myocardial protection during cardiac ischemia/reperfusion injury. Circulation. 116, 1784-1794 (2007).
- Kuhlicke, J., Frick, J. S., Morote-Garcia, J. C., Rosenberger, P., Eltzschig, H. K. Hypoxia Inducible Factor (HIF)-1 Coordinates Induction of Toll-Like Receptors TLR2 and TLR6 during Hypoxia. PLoS ONE. 2, e1364-e1364 (2007).
- Morote-Garcia, J. C., Rosenberger, P., Kuhlicke, J., Eltzschig, H. K. HIF-1-dependent repression of adenosine kinase attenuates hypoxia-induced vascular leak. Blood. 111, 5571-5580 (2008).
- Morote-Garcia, J. C., Rosenberger, P., Nivillac, N. M., Coe, I. R., Eltzschig, H. K. Hypoxia-inducible factor-dependent repression of equilibrative nucleoside transporter 2 attenuates mucosal inflammation during intestinal hypoxia. Gastroenterology. 136, 607-618 (2009).
- Reutershan, J., Vollmer, I., Stark, S., Wagner, R., Ngamsri, K. C., Eltzschig, H. K. Adenosine and inflammation: CD39 and CD73 are critical mediators in LPS-induced PMN trafficking into the lungs. FASEB J. 23, 473-482 (2009).
- Schingnitz, U., Hartmann, K., Macmanus, C. F., Eckle, T., Zug, S., Colgan, S. P., Eltzschig, H. K. Signaling through the A2B adenosine receptor dampens endotoxin-induced acute lung injury. J Immunol. 184, 5271-5279 (2010).
- Thompson, L. F., Eltzschig, H. K., Ibla, J. C., Van De Wiele, C. J., Resta, R., Morote-Garcia, J. C., Colgan, S. P. Crucial role for ecto-5'-nucleotidase (CD73) in vascular leakage during hypoxia. J. Exp. Med. 200, 1395-1405 (2004).
- Aherne, C. M., Kewley, E. M., Eltzschig, H. K. The resurgence of A2B adenosine receptor signaling. Biochim Biophys Acta. , (2010).
- Eckle, T., Koeppen, M., Eltzschig, H. K. Role of extracellular adenosine in acute lung injury. Physiology (Bethesda). 24, 298-306 (2009).
- Koeppen, M., Feil, R., Siegl, D., Feil, S., Hofmann, F., Pohl, U., de Wit, C. cGMP-dependent protein kinase mediates NO- but not acetylcholine-induced dilations in resistance vessels in vivo. Hypertension. 44, 952-955 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon