Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dissection et la coloration des Drosophile Ovaires larvaires
Dans cet article
Résumé
Comment les niches et les cellules souches forment pendant le développement est une question importante avec des implications pratiques. Dans le Drosophile, les cellules germinales souches et leurs niches somatiques se forment pendant le développement larvaire. Cette vidéo montre comment disséquer, aux taches et monter les gonades femelles de la fin du troisième stade larvaire (LL3) Drosophile.
Résumé
De nombreux organes dépendent de cellules souches pour leur développement au cours de l'embryogenèse et pour l'entretien ou la réparation pendant la vie adulte. Comprendre comment les cellules souches forme, et comment ils interagissent avec leur environnement est donc crucial pour comprendre le développement, l'homéostasie et la maladie. L'ovaire de la mouche des fruits Drosophila melanogaster a servi de modèle influent pour l'interaction des cellules germinales souches (CSS) avec leurs cellules de soutien somatiques (de niche) 1, 2. L'endroit connu de la niche et le CSS, couplée à la capacité de les manipuler génétiquement, a permis aux chercheurs d'élucider une variété d'interactions entre cellules souches et leurs niches 3-12.
Malgré la richesse de l'information sur l'entretien des mécanismes de contrôle de la CGC et de la différenciation, on sait relativement peu sur la façon dont les CSS et leurs niches somatiques forment pendant le développement. Environ 18 créneaux somatiques, dont les filaments cellulaires comprennent des composants du terminal et cellules de la coiffe (Figure 1), la forme au cours du troisième stade larvaire 13-17. CSS proviennent des cellules germinales primordiales (PGC). PGC prolifèrent au premiers stades larvaires, mais après la formation de la niche un sous-groupe de PGC devient CSS 7, 16, 18, 19. Ensemble, les cellules somatiques de niche et les CSS font une unité fonctionnelle qui produit des oeufs durant toute la vie de l'organisme.
Beaucoup de questions concernant la formation de l'unité de la CGC restent sans réponse. Des procédés tels que la coordination entre les cellules précurseurs des niches et des précurseurs de cellules souches, ou la génération de l'asymétrie dans les PGC à mesure qu'ils deviennent les CSS, peut être mieux étudié dans la larve. Cependant, une étude méthodique de développement de l'ovaire larvaire est difficile physiquement. Premièrement, les ovaires des larves sont petites. Même à la fin de stades larvaires, ils ne sont que 100 microns de diamètre. En outre, les ovaires sont transparentes et sont intégrés dans un corps blanc de graisse. Nous décrivons ici un protocole étape par étape pour isoler les ovaires de la fin du troisième stade larvaire (LL3) larves de drosophile, suivie d'une coloration avec des anticorps fluorescents. Nous offrons des solutions techniques aux problèmes tels que la localisation des ovaires, la coloration et le lavage des tissus qui ne coulent pas, et faire en sorte que les anticorps pénètrent dans les tissus. Ce protocole peut être appliqué à des stades antérieurs de larves et de testicules larvaires ainsi.
Protocole
1. La ponte des oeufs
- Cinq jours avant la dissection: permettre femelles fécondées à pondre des oeufs pendant 2-4 heures sur les aliments frais complété avec de la levure. Pour obtenir des larves synchronisée et bien développé, il est important de ne pas avoir surpeuplées cultivés (environ 30 œufs / flacon 25mm). Typiquement, 7-16 femelles sont utilisées par flacon, en fonction de la façon dont ils pondent.
2. Sélection des larves
- Préparer un plat en verre de 9 ainsi disséquer remplie de milieu de Ringer (NaCl 128mm, 2 mM de KCl, CaCl 2 1,8 mm, 4mm MgCl2, 35.5mm sucrose, 5 mM pH Hepes 6,9).
- Préparer les crépines de cellules dans une plaque de six puits contenant du milieu de Ringer et le placer sur la glace. Sinon, nous utilisons des moules spécialement équipé d'un filet de nylon.
- Choisissez les larves chronométrée des murs flacon à l'aide fines pinces biologiques (forceps) et les placer dans le contenant de Ringer plat dissection.
- Transfert d'une larve femelle pour un bien propre. On distingue les mâles des femelles de par leurs gonades. Testicules des mâles sont facilement identifiés comme grands cercles transparents intégré dans le tiers postérieur du corps gras. Ovaires Femme, situé à la même partie de la graisse du corps, peut être identifiée comme une beaucoup plus petite, claire, de sphères rondes.
3. Dissection de la larve
- Tenez la larve bas juste derrière le cerveau avec une pince et retirer la tête avec une deuxième paire de pinces.
- Placez la partie restante postérieure sur la face dorsale, avec la trachée vers le bas.
- Tenez la larve par les stigmates postérieurs avec une paire de pinces et de le pousser vers l'intérieur lentement tandis que l'autre paire est coulissant la cuticule arrière jusqu'à environ la moitié de la graisse du corps larvaire sort.
- Maintenez fermement l'extrémité postérieure et l'utilisation de l'autre paire de pinces pour tenir vaguement la cuticule. Doucement et lentement s'éloigner de l'extrémité postérieure de telle sorte que la cuticule et la diapositive intestin attachés à l'écart. A la fin de ce processus, la graisse du corps doit être complètement séparée de l'intestin et la cuticule. Débranchez l'intestin de la partie antérieure du corps gras. Pour rendre la coloration et de montage plus facile, il est important que la graisse du corps reste intact.
- Mouiller une pipette pâturages soigneusement avec un milieu de Ringer, de préférence à partir d'un puits contenant des larves disséquées. Cette aide de la pipette poil et empêche le corps gras de coller à lui. Utilisez la pipette pour transférer les pâturages de la graisse du corps dans le milieu de la sonnerie de la glace froide dans la passoire cellule.
4. Fixation et une coloration
Toutes les étapes sont réalisées à température ambiante, sauf pour l'incubation avec l'anticorps d'abord, à 4 ° C.
- Incuber la graisse du corps dans du formol à 5% en milieu de Ringer. pendant 20 minutes avec une agitation douce.
- Laver pendant 5 minutes avec 1% PBT (1% de Triton X-100 dans du PBS). Répétez cette étape pour 10 minutes et une troisième fois pendant 45 minutes. 1% de Triton X-100 est nécessaire pour perforer l'ovaire larvaire et permettent des anticorps pour le pénétrer.
- Bloc avec PBTB 0,3% (0,3% de Triton X-100 et 1% de BSA dans du PBS) pendant 1 heure avec agitation douce
- Incuber avec l'anticorps désiré 1 er dilué dans PBTB 0,3% pendant la nuit à 4 ° C avec agitation douce. Cette étape est généralement effectuée dans des tubes de 0,2 ml sur un rouleau.
- Transfert de graisse du corps Retour à crépines cellule.
- Lavez 3 fois, 30 minutes chacune, avec PBTB 0,3% avec une légère agitation.
- Bloc avec PBTB 0,3% supplémenté avec 5% d'âne sérum normal pendant 1 heure avec agitation douce.
- Incuber avec un anticorps secondaire approprié dilué (selon les spécifications du constructeur) dans la solution de blocage (0,3% PBTB supplémentés avec du sérum d'âne 5% de la normale chez 0,3% PBT) pendant 2 heures avec agitation douce. Si l'anticorps est fluorescent, incuber dans l'obscurité partir de ce point. Cette étape est généralement effectuée dans des tubes de 0,2 ml sur un rouleau.
- Lavez 3 fois pendant 30 minutes chacun avec 0,3% PBT avec agitation douce.
5. Montage
- Transférer la graisse du corps dans un tube propre Eppendorf. Très soigneusement enlever tous les liquides loin et couvrir immédiatement avec les médias Vectashield montage. Nous utilisons régulièrement depuis Vectashield il ne durcit pas alors que les ovaires sont séparés du corps de graisse.
Les échantillons peuvent être stockés dans les médias de montage à 4 ° C jusqu'à une semaine. - Coupez l'extrémité d'une pointe de pipette et de l'utiliser pour transférer soigneusement le corps gras avec un volume minimal de supports de montage (environ 30 ul d'une lamelle de 30mm) sur une lame de microscope.
- Utilisez deux détenteurs de nickel broches plaquées, tenant 0,1 mm de diamètre broches d'étaler la graisse corporelle. Les ovaires sont situés au tiers postérieur du corps gras. La graisse du corps qui les entoure est habituellement la forme d'une «fleur». Cela permet d'identifier l'emplacement des ovaires. Disséquer les «fleurs» du reste du corps gras et jetez celui-ci.
- Retirez la graisse du corps Surroinancement la gonade en croisant les deux broches attentivement autour de lui. Placez la gonade isolé sur la lame de suite à partir du résidu de graisse corporelle.
- Couvrir avec une lamelle et scellez avec du vernis à ongles.
- Visualisez directement en utilisant un microscope confocal. Les échantillons peuvent être conservés à 4 ° C pendant au maximum trois semaines.
6. Les résultats représentatifs
Nous avons utilisé le protocole ci-dessus pour suivre la mise en place de plusieurs lignées de cellules somatiques dans l'ovaire, y compris les CSS et leurs niches somatiques. A cet effet, nous utilisons des anticorps spécifiques et des marqueurs pour distinguer les différents types de cellules dans la gonade en développement. Ici, nous montrons un exemple de deux ovaires LL3 colorés avec différentes combinaisons d'anticorps. Figure 1A souligne filaments terminaux et les cellules de la PAC (en vert), qui forment ensemble les cellules somatiques de la niche. Figure 1B, montre les cellules entremêlées (CI, magenta), qui contacter directement les cellules germinales (bleu).
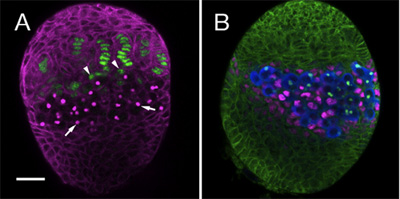
Figure 1. LL3 ovaires. (A) anticorps monoclonal 1B1 (magenta) expose les cellules somatiques et les taches de la fusome, une organelle intracellulaire dans les PGC (flèches). Le piège enhancer hh-lacZ (anti β-galactosidase, vert) est exprimée en filaments terminaux. A la base des cellules somatiques bouchon filaments (flèches) peuvent être observées. (B) d'anticorps 1B1 (vert) décrit toutes les cellules somatiques dans l'ovaire. Anti-Vasa (bleu) toutes les étiquettes PGC. PGC contacter directement les cellules entremêlées (CI, anti-embouteillages, magenta). Bar (A et B) est de 20 um.
Discussion
Cette vidéo montre un isolement et de protocole de coloration des ovaires fin du troisième stade larvaire. Pour effectuer ce protocole régulièrement et de manière fiable, une attention devrait être accordée aux points suivants:
- Pour les larves synchronisée et bien développé, le surpeuplement doit être évitée.
- Pour éviter la perte des ovaires petits translucides, assurez-vous de disséquer le corps gras intacte. Cela aidera également à localiser les ovaires au stade de montage, en p...
Déclarations de divulgation
Remerciements
IM est soutenu par la Marie Curie réintégration subvention. Ce travail a été soutenu par le Fonds ne Israel Science Grant. 1146-1108, par le Helen et Martin Kimmel Institut de recherche de cellules souches à l'Institut Weizmann des Sciences et de la Fondation de bienfaisance Leir.
matériels
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
Références
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon