Method Article
Ion Beam ciblée de fraisage et de microscopie électronique à balayage du tissu cérébral
Dans cet article
Résumé
Ce protocole décrit comment le tissu cérébral de résine intégrés peuvent être préparés et imagée dans les trois dimensions dans le faisceau d'ions focalisé, microscope électronique à balayage.
Résumé
Ce protocole décrit comment échantillons biologiques, comme les tissus du cerveau, peut être imagée en trois dimensions à l'aide du microscope ions porté par faisceau d'électrons / balayage (FIB / SEM). Les échantillons sont fixés avec des aldéhydes, taché métaux lourds utilisant le tétroxyde d'osmium et de l'acétate d'uranyle. Elles sont ensuite déshydratées avec de l'alcool et infiltré avec de la résine, qui est ensuite durci. En utilisant un microscope optique et ultramicrotome avec des couteaux de verre, un petit bloc contenant l'intérêt région proche de la surface est faite. Le bloc est ensuite placé à l'intérieur du FIB / SEM, et le faisceau d'ions utilisées pour environ moulin à une face verticale sur un côté du bloc, à proximité de cette région. En utilisant les électrons rétrodiffusés à l'image des structures sous-jacentes, un petit visage est ensuite broyé avec un faisceau d'ions plus fine et la surface examinée de plus près afin de déterminer la zone exacte du visage à imager et broyé. Les paramètres du microscope sont alors définies de sorte que le visage est à plusieurs reprises broyé et imagée afin que les images de série sont collectées grâce à un volume du bloc. La pile de l'image contient généralement voxels isotropes ayant des dimensions aussi petites nm 4 une dans chaque direction. Cette qualité d'image dans n'importe quel plan d'imagerie permet à l'utilisateur d'analyser ultrastructure cellulaire à n'importe quel angle dans la pile d'images.
Protocole
1. Fixation des échantillons et résine d'enrobage
- Des échantillons de tissus frais et les cellules sont fixés pour au moins 2 heures dans du paraformaldéhyde à 2%, et 2,5% de glutaraldéhyde dans du tampon phosphate 0,1 M à un pH de 7,4. La taille de l'échantillon ne doit pas dépasser 0,150 mm d'épaisseur pour permettre une pénétration adéquate ou fixateur, et ne doit pas être laissé dans le correctif pour plus de 12 heures.
- Placer les échantillons dans des flacons de 20ml à scintillation en verre et rincez-les trois fois, 5 minutes chacun, dans 0,1 M de tampon cacodylate.
- Colorer à 1,5% (p / v) de potassium tétroxyde d'osmium ferrocyanure et 1% (p / v) dans 0,1 M de tampon cacodylate (0,1 M, pH 7,4) pendant 30 minutes.
- Tache avec du tétroxyde d'osmium 1,0% (p / v) en tampon cacodylate 0,1 M pendant 30 minutes.
- Rincer une fois avec de l'eau distillée double pour 3 minutes.
- Colorer à 1% (p / v) d'acétate d'uranyle dans l'eau bidistillée pour 30 minutes.
- Rincer les sections pendant 5 minutes dans de l'eau bidistillée, puis se déshydrater en série graduée d'alcool, à 2 min de chaque changement (1 x 50%, 1 x 70%, 1 x 90%, 1 x 95%, 2 x 100%).
- Intégrer dans des concentrations croissantes de résine mélangée à l'éthanol Durcupan, à 30 minutes chaque changement, à partir de Durcupan 50% dans l'éthanol, puis suivi par: 70%, 90%, 95%, puis à 100%.
- Remplacez-le par Durcupan frais et agiter doucement pendant 4 heures.
- Sections Place, en utilisant des bâtons cocktail de bois, sur des microscopes lames de verre recouvertes avec l'agent de la moisissure se séparer, et le placer dans le four à 65 ° C pendant 24 heures.
2. Préparation de l'échantillon pour le FIB / SEM
- Séparez la couche de résine, contenant les échantillons, de l'entre deux lames de microscope en verre et se laver soigneusement pour enlever toute moisissure agent de séparation.
- En utilisant un microscope à lumière transmise avec les objectifs de faible puissance, ou loupe binoculaire avec éclairage transmis, pour identifier la région d'intérêt dans la tranche de la résine.
- Coupez un petit (3 mm x 3 mm) carrés autour de la région d'intérêt en utilisant une lame de rasoir et coller ce au sommet du bloc de résine vierge avec de la colle acrylique (figure 1). Attendez 5 minutes pour que la colle durcisse, puis passez à l'étape suivante.
- Fixer le bloc dans le titulaire de la ulramicrotome et, en utilisant le stéréomicroscope attachés, bordure autour de la région d'intérêt avec une lame de rasoir jusqu'à ce que seul une petite pyramide de vestiges matériels.
- D'autres garnitures du bloc, en utilisant un couteau dans le verre fixe ultramicrotome, de sorte que la région d'intérêt peut être situé précisément en ce qui concerne les dimensions de la surface du bloc (figure 1). Couper un bord du bloc, à proximité de la région d'intérêt, de sorte qu'une étape perpendiculaire est coupé à travers l'échantillon (figure 1 et 2). Cette étape constitue la face d'imagerie (figure 2).
- Retirez le bloc de la ultramicrotome et de photographier la région d'intérêt au sein du bloc, en utilisant un microscope à lumière transmise.
- Couper le bloc coupé loin du talon de résine restante. Ceci est fait en utilisant scie de bijoutier et assure que seul un petit bloc est placé à l'intérieur du FIB / SEM. La hauteur totale de ce bloc ne doit pas être supérieur à 5 mm.
- Collez le bloc d'aluminium avec un talon pâte de carbone assurant que le côté à numériser est sur le bord extérieur (figure 1).
- Après la colle séchée, recouvrir le bloc avec une fine couche d'or (> 20 nm; système d'évaporation sous vide Cressington).
3. Imagerie dans la FIB / SEM
- A un faible grossissement, et en utilisant l'imagerie d'électrons secondaires (5 kV, 0,5 NAMP), orienter le bloc de sorte que la région choisie d'intérêt et le côté du bloc à imager est confronté l'opérateur (figure 2 c, d).
- Orientez le bloc afin que le visage à imager est parallèle à la poutre de fraisage. Cela signifie que faisceau d'électrons est orienté à 54 ° par rapport à cette face (figure 2 b).
- En utilisant un faisceau d'ions actuel de 13 à 27 à 30 kV Namps retirer une bande étroite de résine de l'avant de la région à imager.
- Passer en mode d'imagerie rétrodiffusée pour voir la face fraisée qui recouvre la région d'intérêt.
- Utilisation de la microscopie optique d'image de référence (prise à l'étape 16) et l'image du visage fraisé localiser la région exacte sur le bloc pour être broyé et imagées (Figure 2).
- Dépôt d'une couche protectrice (environ 1 micron d'épaisseur) de carbone (ou en métal), en utilisant le système d'injection de gaz du microscope, sur la surface du bloc, au-dessus de la région d'intérêt (figure 2).
- L'utilisation d'un courant de 700 picoAmps, moulin finement la région du bloc dans lequel les images finales seront prises.
- Laisser le faisceau mouture complètement moulin à ce visage image jusqu'à pas d'artefacts de fraisage peut être vu sur le visage. Un moulin complet du visage est vérifiée en observant les changements dans chaque image subséquentes à travers le champ de vision. Fraisage inadéquat peut également considéré comme des stries blanches ou «rideaux» figurant Vertically dans l'image.
- Laisser le microscope pendant au moins 2 heures pour tout changement thermique pour dissiper. Cela réduit le risque que la face du bloc va dériver pendant l'imagerie, aboutissant à des images alignées.
- Sélectionnez les paramètres de microscope pour l'imagerie du visage en série. Assurez-vous que le faisceau d'électrons a une tension qui est assez bas pour l'image seule une très faible profondeur de matériel dans la face du bloc. Cela devrait également être beaucoup moins profonde que l'épaisseur de la face pour être enlevé. Les paramètres typiques de l'imagerie sont des tensions entre 1,2 à 2,0 kV avec des tailles de pixels compris entre 4 - 20 nm. Le pixel habitent besoin de temps pour être maintenu autour de 10 μsecs sorte que le temps total à l'usine sur le visage et l'acquisition d'une image est maintenue en dessous de 2 minutes (figure 3).
4. Secrets de la réussite
Étape 1) s'assurer que les échantillons ne sont pas plus épais que 150 microns. Cela permettra une pénétration adéquate des taches différentes et de la résine dans le matériau. Ceci peut être réalisé en sectionnant les échantillons avec un vibratome immédiatement après la fixation. Cette épaisseur est appropriée pour le tissu cérébral. D'autres tissus doivent être testés pour garantir une fixation adéquate et la coloration.
Étape 3) Les échantillons doivent être distribuée gratuitement dans toute la solution, et non groupées dans une partie du flacon tout ce fixateur secondaire est introduit. Cela permettra d'assurer une pénétration maximale de l'échantillon et à réduire l'échantillon devient déformée lors de ce processus de fixation. Ceci est réalisé en remuant doucement les échantillons dans le flacon immédiatement après que la solution est ajoutée.
Étape 15) Assurez-vous que la région d'intérêt est située immédiatement au-dessous (<30 microns) de la surface du bloc. Cela permettra de réduire la quantité de mouture par le faisceau d'ions pendant la phase d'acquisition d'image.
Etape 22) Le temps de balayage du faisceau d'ions doit être adequte pour s'assurer que le visage entier, est complètement blanchi. Fraisage inadéquat sera affiché comme des stries blanches, ou «rideaux» figurant à la verticale sur le visage d'imagerie.
Etape 26) Le visage finale moulu doit être plus grand que le visage qui est imagé. C'est parce que la résine broyée est éjecté du bloc et redépose sur la surface du bloc dans le voisinage immédiat. Cette redéposition peut empiéter sur le champ de vue de l'imagerie, et est évité par fraisage d'une zone beaucoup plus grande que ce qui est imagé. Pour une fenêtre d'imagerie qui est de 20 microns de large, la face du bloc usiné est supérieure à 30 microns de large.
Étape 29) Il est essentiel que les paramètres du faisceau d'électrons est telle que l'image est générée par des électrons qui émergent à partir de seulement les premiers nanomètres quelques de la surface du bloc. Cette une acheved en minimisant la tension en dessous de 2 kV et veiller à ce qu'aucun électrons pénètrent trop loin. Ceci est aussi aidé par l'utilisation d'une tension de grille sur le détecteur de sorte que seul l'électron avec les plus hautes énergies contribuent à l'image finale. Typiquement, une tension de grille de 1,3 kV est utilisé pour une tension de 1,5 kV imagerie.
5. Les résultats représentatifs:

Figure 1. Préparation du bloc de résine. Une résine) embarqué coupe coronale (80 microns d'épaisseur) grâce à un cerveau de rat adulte affiché dans un steromicroscope. L'image montre clairement les différentes régions du cerveau qui peut être coupé de la section (b) en utilisant une lame de scalpel. Ici, un carré de 1 mm du cortex est retirée et (c) collé à un bloc de résine vierge. D) Le bloc de résine est ensuite ébarbé avec un couteau de verre monté dans un ultramicrotome, et une fois le bloc a été réduit à seulement quitter le région d'intérêt (e), une étape est coupée perpendiculairement à la surface avant du matériel embarqué. f) Cette région entière taillée est alors coupé du reste de la résine et montée sur un talon en aluminium prête pour le revêtement de métal et de l'imagerie dans le microscope électronique à balayage.

Figure 2. Préparation de la face du bloc pour FIB / SEM imagerie. A) et b) montrent les illustrations du bloc et le bord qui est moulu pour créer le visage d'imagerie (indiquée avec le noir double flèche). La position du faisceau d'ions (blanc) est indiqué parallèlement à la face d'imagerie, et le faisceau d'électrons (en gris) est montré frapper le visage à 54 ° au faisceau d'ions. C) montre une vue du bloc de prise avec le faisceau d'électrons et imagé avec les électrons secondaires. Le long de ce côté du bloc sombre une région (indiqué par boîte blanche pointillée) montre une partie du visage qui a été grossièrement moulu (illustré avec double têteed flèche noire) pour révéler l'échantillon sous-jacent. d) Lorsque cette région est imagée en utilisant uniquement les électrons rétrodiffusés le tissu embarqué peut être vu. Ici, la largeur de la section de tissu incorporé est indiquée par une flèche à double tête blanche. La barre d'échelle en C) est de 100 microns.
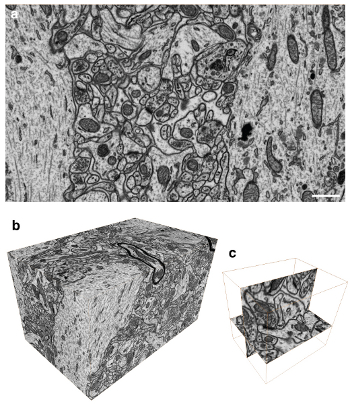
Figure 3. Imagerie du volume des tissus du cerveau avec les voxels isotropes. A) Inversion contraste de l'image rétrodiffusée de la face du bloc montrant l'ultrastructure dans une région du cerveau du rat. Toutes les membranes sont visibles ainsi que des structures macromoléculaires. B) Un total de 1600 images ont été recueillies à 5 nm d'espacement résultant en une pile d'images avec les voxels isotropes. C) Cette pile peut être captée dans n'importe quel plan avec la même résolution. Cette image montre que la seule connexion synaptique est imagé dans le plan xy et le plan yz.
Discussion
La technique du FIB / SEM fonctionne de manière optimale lorsque la région d'intérêt n'est pas trop grand. La limite supérieure pour un volume imagé dépend du faisceau d'ions et de la région qu'elle peut constamment moulin à plusieurs reprises pendant plusieurs heures. Jusqu'à présent, ce qui a été fait avec des zones d'environ 60 x 60 microns, cependant, l'imagerie de cette surface n'est pas possible avec une résolution d'image convenable, principalement en raison du facteur temps dans la collecte d'une telle image de grande taille. À titre d'exemple, une image 4 kx 4 k avec un pixel temporisation à 10 microsecondes prendrait 2 minutes et 40 secondes à acquérir, et pour un champ de vision de 60 microns cela ne ferait que donner une taille de pixel de 15 nm. Pour l'imagerie de l'ultrastructure des cellules et des tissus, une plus petite taille des pixels est plus approprié, généralement entre 4 et 10 nm / pixel. Pour une surface de 60 x 60 microns, l'image serait acquise en 10 heures, même si le microscope avait cette capacité. Pour ces raisons, le microscope est un outil idéal pour des volumes de l'image de l'ordre de 10 x 10 x 10 microns, ou des régions importantes de cellules entières. Cela peut facilement être fait dans un délai de 48 heures sur des échantillons qui sont bien en contraste avec cette procédure.
Jusqu'ici le protocole a été utilisé principalement avec les tissus du cerveau, ainsi que différents types de cellules de mammifères cultivées adhérant à lamelles. Toutefois, la procédure de fixation et de coloration peut être utilisé avec de nombreux autres types de matériel biologique, y compris les matières végétales pour produire aussi des piles d'images bien contrastées.
Par conséquent, le principal avantage de cette technique est sa capacité à volumes d'image avec les voxels isotropes. Piles d'images de ce type permettent d'analyser le volume 3D en utilisant des images prises à n'importe quel plan dans la pile. L'avantage de cela est de permettre à l'observateur de caractéristiques de l'image de la série d'images de n'importe quelle direction et en fournissant un détail plus grande image (figure 3).
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Colle cyanoacrylate | |||
| Microscope à dissection: Leica MZ8 | Leica Microsystems, Allemagne | ||
| Durcupan de résine | Sigma-Aldrich Chemie GmbH, Suisse | ||
| FIB / SEM microscope (Zeiss, Nvision 40) | |||
| Verre d'histologie diapositives | Menzel-Glaser, Allemagne | AA00008032E | |
| Coutelier de verre: Leica EM KMR2 | Leica Microsystems, Allemagne | ||
| Flacons à scintillation en verre (20ml) | EMS, USA | 72634 | |
| Glutaraldéhyde | EMS, USA | 16222 | |
| Joaillier vu | EMS, USA | 72010 | |
| Agent de moisissure séparant | GLOREX, Suisse | 62407445 | |
| Tétroxyde d'osmium | EMS, USA | 19110 | |
| Paraformaldéhyde | EMS, USA | RT 19208 | |
| Sels de phosphate pour un tampon phosphate | Sigma-Aldrich Chemie GmbH, Suisse | 71642 et 71496 | |
| Cacodylate de sodium | Sigma-Aldrich Chemie GmbH, Suisse | 20840 | |
| Sputter Coater avec l'objectif d'or | Cressington, USA | ||
| Tris base (TBS) | Sigma-Aldrich Chemie GmbH, Suisse | T1378 | |
| Ultramicrotome: Leica UCT | Leica Microsystems, Allemagne | ||
| Acétate d'uranyle | EMS, USA | RT 22451 |
Références
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28, 2959-2964 (2008).
- Hekking, L. H., Lebbink, M. N., De Winter, D. A., Schneijdenberg, C. T. Focused ion beam-scanning electron microscope: exploring large volumes of atherosclerotic tissue. J Microsc. 235, 336-347 (2009).
- Armer, H. E., Mariggi, G., Png, K. M., Genoud, C. Imaging transient blood vessel fusion events in zebrafish by correlative volume electron microscopy. PLoS One. 4, e7716-e7716 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon