Method Article
Piège chromosomes associés pour identifier les interactions ADN à longue distance
Dans cet article
Résumé
Le piège de chromosomes associés (ACT) dosage est une nouvelle méthode impartiale pour identifier les interactions ADN à longue portée. La caractérisation des interactions ADN à long gamme va nous permettre de déterminer la relation de l'architecture nucléaire à l'expression des gènes dans les deux physiologie normale et dans des états pathologiques.
Résumé
L'information génétique codée par l'ADN est organisé en une structure complexe et très réglementé chromatine. Chaque chromosome occupe un territoire spécifique, qui peut changer selon le stade de développement ou du cycle cellulaire. L'expression des gènes peut se produire dans des usines spécialisées transcriptionnelle où les segments de chromatine peut en boucle à partir de différents territoires chromosomiques, conduisant à la co-localisation des segments d'ADN qui peuvent exister sur les chromosomes différents ou très éloignés sur le même chromosome. Le piège Associated chromosomes (ACT) test fournit une méthodologie efficace pour identifier l'ADN de ces associations à long terme de façon impartiale en étendant et en modifiant la technique de capture des chromosomes conformation. Le dosage de loi rend possible pour nous d'étudier les mécanismes de la régulation transcriptionnelle en trans, et peut aider à expliquer la relation de l'architecture nucléaire à l'expression des gènes dans la physiologie normale et pendant les états pathologiques.
Protocole
1. Fixation de formaldéhyde des interactions chromatine longue portée
- Lignée cellulaire humaine Culture HL-60 au milieu RPMI1640 avec 15% de FBS et 1 x pénicilline / streptomycine à 80-90% de confluence dans un incubateur fourni avec 5% de CO 2 à 37 ° C.
- Recueillir les cellules dans un tube de 50 ml Nunc, centrifuger à 1200 rpm pendant 15 minutes, puis retirez le support par aspiration
- Ajouter 5 ml de milieu de culture pour remettre les culots cellulaires, et de compter les cellules en utilisant un hématimètre. Prenez environ 1 x 10 7 cellules pour un volume de 40 ml avec FBS RPMI1640 / 10%, puis ajouter 1,7 ml de formaldéhyde à 37% de fixer la chromatine diluer.
- Incuber à température ambiante pendant 10 minutes en remuant doucement, puis trempe avec 2,4 ml de 2M glycine. Centrifuger pendant 15 minutes à 1200 rpm à 4 ° C, et retirer le surnageant. Laver le culot une fois avec 40 ml PBS glacé, puis le culot spin bas et retirer le CPE.
2. La lyse cellulaire à isoler les noyaux
- Resuspendre les cellules dans 40 ml de tampon de lyse de la glace froide (10 mM Tris-HCI, pH 8,0, NaCl 10 mM, 0,2% NP-40) avec des inhibiteurs de protéase fraîchement ajoutée (1:500 dilution) et 0,1 mM PMSF. Incuber dans une chambre froide avec une rotation de 90 minutes, centrifuger à 2500 rpm pendant 15 minutes, et retirer le surnageant.
3. La digestion par enzyme de restriction avec Bgl II
- Resuspendre les noyaux dans 0,5 ml d'une mémoire tampon x ONE 3, et ajouter 15 μlof SDS à 10%. Incuber à 37 ° C pendant 1 heure en agitant, puis ajouter 45 ul de 20% de Triton X-100 pour séquestrer le SDS. Incuber à 37 ° C pendant 1 heure avec agitation.
- Utilisez une aliquote de 1 x 10 6 noyaux (environ 15 mg, soit un dixième des cellules d'origine) pour la digestion des enzymes de restriction. Sortez 55 pi de solution de noyaux de l'étape 3.1 et compléter à 500 ul avec 433 ul de 1 x ONE tampon 3 et 12 pl d'Bgl II (50U/ul). Incuber à 37 ° C pendant la nuit.
4. La ligature des segments d'ADN interagissant
- Inactiver les enzymes de restriction en ajoutant 95 ul de 10% de SDS, et dénaturer par chauffage à 65 ° C pendant 20 minutes dans un bain d'eau.
- Ajouter 7 ml de tampon de ligation 1 x (30 mM Tris-HCI, pH 8,0, MgCl2 10 mM, DTT 10 mM, ATP 1 mM) et 360 ul de 20% de Triton X-100 et incuber à 37 ° C pendant 1 heure .
- Baisser la température à 16 ° C et ajouter 50 l de 400 U / ul ADN ligase T4. Incuber l'échantillon à 16 ° C pendant 4 heures puis à température ambiante pendant 30 minutes.
5. Purification d'ADN
- Ajouter 300 ug de la protéinase K, et incuber à 65 ° C pendant la nuit.
- Ajouter 5 ug de RNase A et incuber à 37 ° C pendant 30 minutes
- Purifier l'ADN par extraction au phénol / chloroforme, et précipiter l'ADN dans l'isopropanol. Dissoudre l'ADN dans 150 ul d'eau distillée stérile.
6. Digestion avec Msp I et ligature avec des lieurs oligonucléotidiques
- Incuber 2μg d'ADN purifié avec 5 unités de Msp I à 37 ° C pendant 4-6 heures. Inactiver j'ai Msp à 65 ° C pendant 10 minutes, puis précipiter l'ADN dans de l'éthanol avec 1 pi de 5 mg / ml de glycogène. Dissoudre le culot d'ADN dans 50 ul d'eau distillée stérile.
- Mélanger 50 pl de Msp I-traitée ADN avec 2 pi d'un L 20 uM oligonucléotidiques linker (5'-gctgaccctgaattcgcacgtgcctgtcgttagcggacacagggcgattcac-3 '), 1 pl d'une 20 oligonucléotidiques uM S (5'-cggtgaatc-3'), 1 pl de l'eau distillée stérile et 6 pl d'ADN de 10 x tampon ligase T4. Couvrir le mélange avec de la cire liquide.
- Oligonucléotides Dénaturer à 50 ° C pendant 1 minute et laisser refroidir progressivement à 10 ° C dans un 0,5 ° C / minute gradient dans un cycleur thermique.
- Ajouter 1 l de 400 U / ul ADN ligase de T4 et incuber à 15 ° C pendant la nuit. Purifier l'ADN linker-ligaturés en utilisant un kit QIAquick PCR Purification, et éluer dans 50 ul d'eau distillée stérile.
7. Amplification par PCR et analyse de séquences
- Choisissez une amorce pour la région spécifique de l'ADN que vous voulez examiner pour interactions à longue portée (c'est à dire, le «appât»). Dans cet exemple, nous utilisons ABL-1.
- Prendre 1 pl de l'ADN purifié pour effectuer le premier tour de PCR utilisant 1 pl de 20 pM ABL -1 amorces spécifiques # 4656 (5'-gttcaagcgattctcctgcctcga-3 '), 1 pl de 20 pM linker amorces spécifiques # 2963 (5'- gctgaccctgaattcgcacgtgcct-3 '), 3μl de 3 x Klen Taq polymérase ADN I cocktail et 3 ul d'eau distillée stérile. Deux ul de 32 P-dCTP est ajouté à 100 ul de 3 x Klen Taq ADN polymérase I cocktail avant l'amplification par PCR. Le cycle thermique pour un démarrage à chaud PCR est de 72 ° C pendant 2 min, 95 ° CFOR 2 minutes, 18 cycles de 95 ° C pendant 20 secondes, 65 ° C pendant 40 secondes, et 72 ° C pendant 1 minute; l'extension finale est effectué à 72 ° Cpendant 5 minutes.
- Purifier le premier tour des produits de PCR utilisant un kit QIAquick PCR Purification, et l'ADN éluer dans 30 ul d'eau distillée stérile.
- Prendre 1 l de 100 x diluée premier produit de PCR pour effectuer un deuxième tour de PCR utilisant des amorces imbriquées en ajoutant 1 pl de 20 pM ABL-1 amorces spécifiques # 4626 (5'-ggagaatttttatctgcctctgtga-3 ') (figure 1a), 1 pl de 20 uM d'amorces spécifiques linker # 2961 (5'-gtcgttagcggacacagggcgattc-3 '), 3 pi de 3 x Klen Taq polymérase ADN I cocktail et 3 ul d'eau distillée stérile. Le calendrier des cycles thermiques est de 25 cycles de 95 ° C pendant 20 secondes, 67 ° C pendant 40 secondes, et 72 ° C pendant 1 minute, puis par extension à 72 ° C pendant 5 minutes.
- Visualisez les produits de PCR en exécutant un 5% d'urée-PAGE sur gel et la numérisation de l'écran exposé dans un Phosphoimager (figure 1b). Chaque bande de PCR peuvent être recyclés à partir du gel par la dissolution des bandes de gel dans un tube Eppendorf contenant 60 ul d'eau distillée stérile, et l'incubation à 95 ° C pendant 5 minutes. Centrifuger brièvement à 10000 rpm pendant 10 sec pour collecter tous les échantillons. Retirer 1 pl pour l'utiliser comme matrice d'ADN pour effectuer la PCR avec le couple d'amorces 2961/4626 en utilisant les mêmes conditions que décrites ci-dessus. L'analyse des séquences peut être effectuée après purification utilisant un kit QIAquick PCR Purification.
- Séquences d'ADN sont analysés en utilisant un outil en ligne pour déterminer leur localisation chromosomique sur le site web: http://genome.ucsc.edu (figure 1c). Cliquez sur "BLAT 'pour entrer dans une nouvelle fenêtre qui permet de coller une séquence d'ADN, une nouvelle fenêtre apparaît après avoir cliqué sur« soumettre », et montre les« Résultats de la recherche BLAT ». Cliquez sur "navigateur" de la frapper avec 100% d'identité pour entrer dans une fenêtre de côté pour montrer l'emplacement de la séquence d'ADN.
8. Les résultats représentatifs
1. Test ACT utilisant ABL-1 région comme appât afin de déterminer sa longue interactions ADN large
Comme illustré dans la figure 1a, deux sites Bgl II et un site BamH I ont été choisis pour le dosage de l'ACT. Dans le second cycle de PCR, l'amorce mis 4626/2961 a été utilisé pour amplifier ABL-M1, 4630/2961 a été utilisé pour ABL-M2 et 4636/2961 a été utilisé pour ABL-M3. Un motif de gel typique montre un à plusieurs bandes (figure 1b). Chaque fragment d'un test ACT est constitué de deux segments d'ADN combinés: un segment est dérivée de la région d'ADN appâts, tandis que le second segment provient du partenaire associé, qui a été rejoint au segment région appât par la séquence de reconnaissance d'enzyme de restriction premier. La séquence deuxième enzyme de reconnaissance apparaîtra à la fin de la séquence des partenaires associés (figure 1c). Le cloné ABL-M1 fragment contient l'ADN de la région de ABL1 situé sur le chromosome 9q32.4 partir +133,592,306-133,592,399, et le partenaire associé est situé au chromosome 3p13 +71,869,882-71,870,107. L'identité des partenaires associés sont découverts par le dynamitage de leurs séquences en utilisant le navigateur du génome UCSC (GRCh7/hg19 publié en Février 2009). PROK2 a été identifié comme le partenaire associé au locus chr3p13.
De même, le partenaire ABL-M2 associé a été localisé à chr5q21.1, tout clone ABL-M3 a été identifiée comme une association intra-chromosomique à proximité de l'ABL-1 locus.
2. Déterminer moins répandue interactions à longue portée utilisant test ACT
D'autres essais basés sur 3C ont rapporté beaucoup plus de partenaires que les interactions que nous avons montré dans la figure 1 et à l'IGF2 / H19 le locus 12. La méthodologie que nous avons décrites sélectionnera les interactions les plus répandues de longue portée. Cependant, en augmentant le nombre de cycles de PCR, il est possible d'identifier d'autres, les associations moins fréquentes aussi bien (figure 2).
3. Les différences dans les interactions à longue portée dans les cellules cancéreuses par rapport aux tissus normaux.
Le test ACT peut aussi être utilisé pour identifier les différences dans l'architecture nucléaire et les interactions à longue portée entre les cellules normales et les cellules cancéreuses (figure 3). Ces différences peuvent refléter des changements d'architecture nucléaire qui se produisent pendant la transformation cellulaire, et donc ce test pourrait finalement être applicables à des fins diagnostiques. Les modèles de gel similaires qui se produisent dans les deux normaux et tissus cancéreux ont indiqué que le test ACT est fiable et reproductible. Alors que le test ACT peut identifier l'ADN des partenaires à long gamme, des analyses supplémentaires, tels que les poissons et les analyses de ChIP, sont tenus de vérifier la présence des associations identifiées entre loci lointain. Des études génétiques, physiologiques et biochimiques peuvent alors être effectuées pour élucider les implications biologiques de ces associations à long ADN gamme.
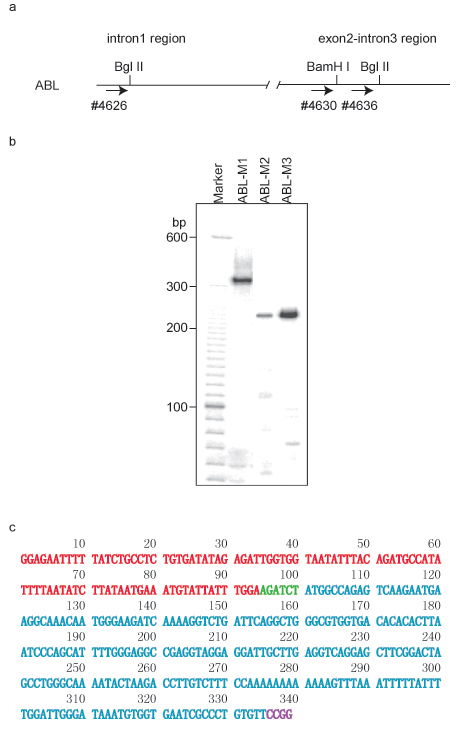
Figure test ACT 1 en utilisant ABL-1 région comme appât dans l'ADN cellules HL-60. a. Struct ADNUre de ABL-1 région. L'enzyme de restriction d'abord utilisé dans ACT dosage était Bgl II. Les amorces pour le deuxième tour de PCR sont également marqués par des flèches et des numéros amorce correspondant. b. Motif de gel de l'essai ACT dans 5% d'urée-PAGE. La paire d'amorces 4626/2961 a été utilisé pour amplifier clone ABL-M1 à la PCR nichée, 4630/2961 a été utilisée pour cloner ABL-M2 et 4636/2961 a été utilisée pour cloner ABL-M3. C. Séquence d'ADN du clone ABL-M1. Fragment d'ADN de l'ADN-1 ABL appât est étiqueté en rouge, et le partenaire d'ADN associées est étiqueté en cyan. BglII site (AGACTC) a été marqué en vert, et le site Msp I (CCBG) est étiquetée en violet.

Figure 2 cycles de PCR affecter les résultats d'essai ACT. Utilisation de la région de contrôle impression (ICR) au niveau du locus Igf2/H19 que l'ADN d'appât dans les cellules de fibroblastes de souris, programmes de cyclisme différents ont été appliqués dans les premier et deuxième tours de la PCR dans le dosage de l'ACT. 18-20 cycles dans le premier cycle de PCR n'a pas amplifier le signal suffisant pour être visualisées. Vingt cinq cycles dans les résultats de la PCR deuxième bandes claires, tout en augmentant le nombre de cycles pour le deuxième tour de PCR induit un modèle de diffamation, en plus de plusieurs bandes.

Figure 3 Détection des différences dans l'architecture nucléaire entre les tissus du côlon normal et le tissu du cancer du côlon dans l'essai ACT. A. Structure de l'ADN de la région de l'ICR au IGF2/H19 locus et le gène IGF2. Dpn les sites II pour le dosage de l'ACT sont étiquetés. Amorces utilisées dans le second cycle de PCR sont marquées par des flèches et des numéros de différentes couleurs qui correspondent à chaque voie dans le volet B de la figure. b. Motif de gel de l'essai ACT dans 5% d'urée-PAGE. Tissus du côlon normal MAD03-1423 et les tissus du cancer du côlon MAD04-149 a été obtenu à partir de tissus du Réseau coopératif de l'homme (CHTN) Division de l'Ouest. Après chaque tissu du côlon a été homogénéisé, test ACT a été réalisé en suivant les procédures décrites ici. Voie 1 représente les résultats PCR en utilisant la paire d'amorces # # 2961and 4161 (5'-tctgcgccatcagggcagtgagac-3 ') marqué en rose dans le panneau a; piste 2 représente les résultats de la PCR en utilisant la paire d'amorces # 2961 et # 4163 (5'-gccgcgcggccacttccgattcc-3 ») marqué en orange dans le panneau a; piste 3 représente les résultats de la PCR en utilisant la paire d'amorces # 2961 et # 5145 (5'-gccatgcaggtaggatttgagctg-3 ') marqué en bleu dans le panneau a; piste 4 représente les résultats de la PCR en utilisant la paire d'amorces # 2961 et # 5151 (5'-gtctcaaataggggccagctagcttgg-3 ') marqué en vert sur le panneau a. Des bandes uniques qui apparaissent uniquement dans les tissus du côlon normal sont étiquetés par des flèches jaunes, et les bandes qui n'est apparu que dans les tissus du cancer du côlon sont étiquetés dans les flèches rouges. ICR, région de contrôle empreinte; DMR, différentes régions méthylées.
Discussion
Dekker et al. Développée la conformation capture de chromosomes (3C) approche pour détecter la fréquence de l'interaction entre deux locus génomiques 1, et 3C a été largement utilisée pour étudier les associations intra-et inter-chromosomique chromosomiques entre deux régions de l'ADN des cellules de mammifères connues 2 -9. Bien que nouvellement développé Salut-C méthodologie peut être appliquée pour l'étude de l'ADN du génome entier d'association, dosage de loi est encore une technique efficace pour l'étude des interactions ADN spécifiques de locus 10-11. Nous avons modifié cette approche pour identifier les régions d'ADN inconnus qui sont associés à une région d'ADN connues chez la souris et les cellules humaines en culture (figure 1). Nous avons nommé cette méthode, le piège de chromosomes associés (ACT) de dosage, comme il nous a fourni une méthode fiable et reproductible pour identifier de nouveaux partenaires l'ADN inconnu qui associent à une région d'ADN cible connue 12. Un test réussi 3C avec des contrôles appropriés sont effectués avant l'exécution des nouveaux aspects de l'essai ACT 13. Afin tofind que de nombreuses régions d'ADN associées que possible, il est nécessaire d'utiliser différentes combinaisons d'enzymes de restriction premier et deuxième. Il est particulièrement important d'utiliser des enzymes de restriction qui sont insensibles à la méthylation CpG pour effectuer l'étape de ligation premier 3C. La liaison aux protéines et de méthylation de l'ADN peuvent également influer sur l'efficacité de digestion d'enzymes de restriction et peut conduire à l'échec de la ligature des régions d'ADN associées à certaines digestions d'enzyme de restriction. La survenue d'une ligature intra-ou inter-chromosomique dépend de protéine-ADN de réticulation et appropriée des cartes physiques des deux régions d'ADN associées. Ainsi, certaines expériences préliminaires sont indispensables pour établir une concentration de formaldéhyde possible efficace et temps de traitement dans l'essai de l'ACT. Une gamme de concentrations finales de formaldéhyde (from1.5% à 2%) ont été utilisés dans plusieurs laboratoires lors de la partie 3C de l'essai 7,9. Alternativement, les oligonucléotides utilisés comme agents de liaison peuvent être conçus pour correspondre à la fin de cohésion coupé par l'enzyme de restriction secondes. Bien que nous avons constaté que 18 à 20 cycles dans le premier cycle de PCR et 20-25 cycles dans le second cycle de PCR pourrait fournir des bandes claires, il est nécessaire d'établir les meilleures conditions de PCR pour chaque expérience (figure 2). Intra-molécule recuit entre la séquence adaptateur extrémité 5 'et 3'-end complémentaire d'un brin d'ADN peut se produire dans la PCR, il inhibe l'adaptateur amorce spécifique de recuit avec la molécule d'ADN, et conduit à l'efficacité d'amplification beaucoup plus faible dans les premiers cycles de plusieurs. Après l'ADN cible a été amplifié par cycles, son montant peut être beaucoup plus grande que ces réactions non spécifiques, et peuvent faciliter la concurrence des hybridation des amorces à des molécules d'ADN cible. C'est aussi pourquoi nous pouvons voir l'amplification de fond, et pourquoi le premier produit de PCR rondes doit être dilué pour diminuer amplification.It fond est important d'enlever les amorces en excès de la réaction PCR afin de diminuer le fond dans le second cycle de PCR. Comme dans toutes les expériences basées sur la PCR, il est essentiel de concevoir des amorces qui ne sont pas situés dans des régions séquence de répétition, qui constituent la majorité de l'ADN humain et la souris. Bien que nouvellement développé Salut-C méthodologie peut être appliquée pour l'étude de l'ADN du génome entier d'association, dosage de loi est encore une technique efficace pour l'étude des interactions ADN spécifiques de locus.
Déclarations de divulgation
Remerciements
Nous remercions Adelle Murell et Wolf Reik beaucoup pour le partage de leur protocole 3C. Ce travail a été soutenu par le ministère de la Défense et le Service de recherche du ministère des Anciens Combattants.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI1640 medium | Invitrogen | 22400-105 | |
| acrylamide | Invitrogen | 15512-023 | |
| ATP solution, 10mM | Invitrogen | AM8110G | |
| fetal bovine serum | Invitrogen | 16000-044 | |
| penicillin-streptomycin | Invitrogen | 15140-122 | |
| 1M Tris pH8.0 | Invitrogen | AM9856 | |
| RNase A | Invitrogen | 12091-039 | |
| SDS | Invitrogen | 15525-017 | |
| urea | Invitrogen | 15505-035 | |
| BamH I | New England Biolabs | R0136T | |
| Bgl II | New England Biolabs | R0144M | |
| Dpn II | New England Biolabs | R0543T | |
| Msp I | New England Biolabs | R0106S | |
| dNTPs | New England Biolabs | N0447L | |
| proteinase K | New England Biolabs | P8102S | |
| T4 DNA ligase | New England Biolabs | M0202T | |
| 37% formaldehyde | Sigma-Aldrich | F8775 | |
| Bis-acrylamide | Sigma-Aldrich | 146072 | |
| dithiothreitol | Sigma-Aldrich | 43815 | |
| glycine | Sigma-Aldrich | 50046 | |
| PMSF | Sigma-Aldrich | 93482 | |
| proteinase inhibitor | Sigma-Aldrich | S8830 | |
| Nonidet P-40 | Roche Group | 11754599001 | |
| KlenTaq1 | Ab peptides | 1001 | |
| dCTP alpha P32 | PerkinElmer, Inc. | BLU513H250UC | |
| PTC-100 Thermal Cycler | MJ Research | mjptc100 | |
| Power Supply | Bio-Rad | 164-5056 | |
| OmniPAGE Maxi | Aurogene Life Science | VS20D | |
| Typhoon 9400 | GE Healthcare | 63-0055-78 |
Références
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295, 1306-1311 (2002).
- Apostolou, E., Thanos, D. Virus Infection Induces NF-kappaB-dependent interchromosomal associations mediating monoallelic IFN-beta gene expression. Cell. 134, 85-96 (2008).
- Duan, Z. A three-dimensional model of the yeast genome. Nature. 465, 363-367 (2010).
- Lomvardas, S. Interchromosomal interactions and olfactory receptor choice. Cell. 126, 403-413 (2006).
- Murrell, A., Heeson, S., Reik, W. Interaction between differentially methylated regions partitions the imprinted genes Igf2 and H19 into parent-specific chromatin loops. Nat Genet. 36, 889-893 (2004).
- Schoenfelder, S. Preferential associations between co-regulated genes reveal a transcriptional interactome in erythroid cells. Nat Genet. 42, 53-61 (2010).
- Spilianakis, C. G., Lalioti, M. D., Town, T., Lee, G. R., Flavell, R. A. Interchromosomal associations between alternatively expressed loci. Nature. 435, 637-645 (2005).
- Vakoc, C. R. Proximity among distant regulatory elements at the beta-globin locus requires GATA-1 and FOG-1. Mol Cell. 17, 453-462 (2005).
- Xu, N., Tsai, C. L., Lee, J. T. Transient homologous chromosome pairing marks the onset of X inactivation. Science. 311, 1149-1152 (2006).
- Lieberman-Aiden, E. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science. 326, 289-293 (2009).
- Berkum, N. L. v. a. n. Hi-C: a method to study the three-dimensional architecture of genomes. J Vis Exp. , (2010).
- Ling, J. Q. CTCF mediates interchromosomal colocalization between Igf2/H19 and Wsb1/Nf1. Science. 312, 269-272 (2006).
- Dekker, J. The three 'C's of chromosome conformation capture: controls, controls, controls. Nat Methods. 3, 17-21 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon