Method Article
Détection de signalisation Effector-Complexes en aval de BMP4 aide In situ PLA, un dosage Ligature Proximité
Dans cet article
Résumé
Ici, nous montrons comment utiliser Assay ligature de proximité (APL), avec une combinaison d'anticorps de visualiser des protéines morphogénétiques osseuses (BMP) de signalisation dans les cellules fixes. Cette technique nous a permis de suivre l'accumulation nucléaire de BMP endogènes effectrices activées-complexes et de quantifier leur niveau au cours du temps sous BMP4 stimulation.
Résumé
Les PGB sont responsables pour une large gamme d'effets sur le développement et biologiques. Récepteurs BMP activer (phosphoryler) le Smad1/5/8 effecteurs, qui ensuite, former un complexe avec Smad4 et translocation vers le noyau où ils fonctionnent comme des facteurs de transcription spécifiques pour initier BMP effets en aval 1. Traditionnel des techniques immuno-fluorescence avec des anticorps contre phospho-Smad peptides présentent une faible sensibilité, bruit de fond élevé et offrent une quantification brute car elles reposent sur l'intensité du signal d'anticorps particulier si ce n'est photosensibles fluorescentes. En outre, les phospho-Smad ne peuvent pas tous être dans un complexe avec Smad4 et engagés dans la transcription active.
In situ APL est une technologie capable de détecter les interactions entre protéines avec une haute spécificité et sensibilité 2-4. Cette reconnaissance nouvelle technologie d'anticorps couples avec l'amplification de l'ADN porteuse de la protéine. Il génère une version localisée, signal discret dans une forme de taches révéler la position exacte de l'événement de reconnaissance. Le nombre de signaux peuvent être comptés et comparés fournir une mesure. Nous avons appliqué in situ de l'APL, l'aide du kit DuoLink, avec une combinaison d'anticorps qui permet la détection des effecteurs de signalisation BMP et phospho-Smad1/5/8 Smad4 que lorsque ces derniers sont dans IE proximité dans un complexe qui se produit uniquement avec de signalisation d'activation. Cela a permis pour la première fois, la visualisation et la mesure de signalisation des BMP endogènes avec une haute spécificité et la sensibilité dans une expérience bien sûr le temps sous stimulation BMP4.
Protocole
1. Placage de cellules et de traitement avec BMP
- Culture des cellules Neuro2a au GMEM supplémenté avec 10% de FBS, 1x non-acides aminés essentiels (NEAM), 1x pyruvate de sodium et 1x L-glutamine. Fractionner les cellules en utilisant la trypsine (0,05%-EDTA) et la plaque de 15.000 à 20.000 cellules par puits dans une diapositive de chambre de 16 puits.
Culture HEK293T ou Cos7 cellules dans du DMEM supplémenté avec 10% de FBS, 1x L-glutamine et 1x pénicilline / streptomycine. Stériliser diapositives polysine en les plongeant dans de l'éthanol 70% et en utilisant un stylo Immedge tirage de 1 cm 2 puits. Fractionner les cellules en utilisant la trypsine (0,05%-EDTA) et la plaque de 20.000 à 25.000 cellules par puits dans 50 pl de milieu. - Incuber les cellules à 37 ° C dans un incubateur humidifié, 5% de CO 2 incubateur.
- Après 24 h de remplacer le milieu avec sérum gratuitement GMEM (supplémenté avec 0,1% d'albumine, 1x NEAM, 1x pyruvate de sodium et 1x L-glutamine) pour Neuro2a ou avec du sérum sans DMEM (complétée par la L-Glutamine et 1x pénicilline / streptomycine) pour HEK293T / Cos7 et incuber les cellules pendant 2-3 h. Gardez trois puits avec des cellules en culture dans des conditions normales (c'est à dire 10% de FBS) à utiliser comme contrôles.
- Traiter les cellules avec dorsomorphin (inhibiteur de la voie BMP, 2 uM) ou BMP4 (25 ng / ml) pendant le temps désiré (par exemple pendant 10 min-1 h) 5.
2. Fixation et perméabilisation
- Préparer le fixateur, 4% de PFA. Peser 4 g de PFA pour préparer une solution à 4% dans 100 ml de PBS. Chauffez la solution à 50 ° C jusqu'à ce qu'elle soit claire. Filtrer la solution à travers un filtre de 0,22 um et conserver à 4 ° C jusqu'à utilisation. Utilisez fixateur frais (non stockés pendant plus de 2 jours).
- Aspirer le milieu à partir des puits et laver avec 1xPBS. Ne pas pipeter des solutions directement sur les cellules car cela peut entraîner le détachement des cellules. Avant d'aller à l'étape suivante, si les lames de chambre sont utilisés enlever les chambres, mais laissez le silicone autour des puits.
- Ajouter 50 ul PFA 4% et incuber pendant 10min, à température ambiante, sans agitation.
- Laver les cellules avec du PBS pour 3 x 5 min dans une jarre de Coplin avec agitation à température ambiante.
- Traiter les cellules avec 0,5% de Triton X-100 dans du PBS pendant 10 min sans agitation à température ambiante.
- Laver les cellules avec 0,05% de Tween 20 dans du TBS (TBS-T) pour 3 x 5 min dans une jarre de Coplin avec agitation à température ambiante.
3. Bloquant
- Secouez le TBS-T. Ajouter une goutte de solution de blocage DuoLink II (1x) par puits.
- Incuber les lames dans une chambre humide préchauffée pendant 1 h à 37 ° C.
4. Anticorps primaires
- Mélanger et diluer aP-Smad1/5/8 (polyclonal de lapin) à 1:100 et un-Smad4 (monoclonal de souris) à 1:100 dans la DuoLink Anticorps II Diluant (1x). Préparer également aP-Smad1/5/8 et un-Smad4 seul à la même concentration pour être utilisé pour les contrôles.
- Secouez la solution de blocage de la glisse. Retirez que solution beaucoup bloquant que possible, mais prenez soin de ne pas laisser les piles sèches avant d'ajouter l'anticorps. Ajouter 40 ul de solutions d'anticorps dans les puits. Dans une bien ajouter Diluant anticorps seulement comme un contrôle négatif supplémentaire.
5. Sondes PLA
- Diluer les deux sondes de PLA (DuoLink II anti-Mouse MOINS et DuoLink II anti-lapin PLUS) 1:05 dans le diluant d'anticorps.
- Secouez la solution d'anticorps primaire de la glisse. Laver les lames 2 fois 5 min chacun avec 1x DuoLink Buffer II lavage A dans une jarre de Coplin avec agitation à température ambiante.
- Secouez le tampon de lavage A partir de diapositives et ajouter la solution de PLA sonde (40 ul / puits).
Incuber les lames dans une chambre humide préchauffée pendant 1 h à 37 ° C.
6. Ligature
- Vortex le stock DuoLink Ligature II (5x) et diluer à 1:5 dans l'eau de grande pureté et mélanger. Lors du calcul du volume de l'eau, prendre en compte le volume de la ligase qui sera ajouté à une dilution finale de 1:40, juste avant l'ajout du mélange dans les puits.
- Secouez la solution de sonde PLA de la glisse. Laver les lames dans le tampon de lavage 1x A pour 2 fois 5 min chacun dans une jarre de Coplin avec agitation à température ambiante.
- Sortez la ligase du congélateur à l'aide d'un bloc de congélation (-20 ° C). Ajouter la ligase de la solution de ligation (préparé en 6.1) à une dilution 1:40 et le vortex.
- Secouez le tampon de lavage A partir de diapositives et ajouter la solution de ligation-ligase pour chaque puits (40 ul / puits). Incuber les lames dans une chambre humide préchauffée pendant 30 min à 37 ° C.
7. D'amplification
Remarque: Lumière réactifs sensibles. Gardez les diapositives abri de la lumière.
- Diluer le stock DuoLink Amplification II (5x) 1:5 dans de l'eau de grande pureté et mélanger. Lors du calcul du volume de l'eau de prendre en compte le volume de la polymérase qui sera ajouté à une dilution finale de 1:80 juste avant l'addition du mélange d'ee puits.
- Secouez la solution ligature-ligase de la glisse. Laver les lames dans le tampon de lavage 1x A avec pour 2 fois 2 min chacun dans une jarre de Coplin avec agitation à température ambiante.
- Sortez la polymérase du congélateur à l'aide d'un bloc de congélation (-20 ° C). Ajouter la polymérase à la solution d'amplification (préparé en 7.1) à une dilution 1:80 et le vortex.
- Secouez le tampon de lavage A partir de diapositives et ajouter la solution d'amplification-polymérase dans chaque puits (40 ul / puits). Incuber les lames dans une chambre humide préchauffée pendant 100 min à 37 ° C.
8. Préparation pour l'imagerie
Remarque: Lumière réactifs sensibles. Gardez les diapositives abri de la lumière.
- Secouez la solution d'amplification-polymérase de la glisse et de lavage pour 2 fois 10min chacun à 1x DuoLink II Laver tampon B dans une jarre de Coplin avec agitation à température ambiante.
- Plonger les lames dans 0,1 x Laver B. Tampon
- Enlever le silicone de la diapositive 16 ainsi complètement. Ajouter ~ 40μl de la Seconde DuoLink Milieu de montage avec DAPI sur la lamelle et doucement le placer sur les échantillons qu'il en appuyant légèrement pour qu'il n'y ait pas de bulles d'air sous la lamelle. Fixer et sceller la lamelle sur la lame avec du vernis à ongles. Attendez au moins 15min avant de procéder à l'imagerie.
- Analyser les échantillons avec un microscope confocal ou fluorescence. Obtenir des images numériques.
9. Quantification
Remarque: Lumière réactifs sensibles. Gardez les diapositives abri de la lumière.
- Utilisez DuoLink ImageTool à compter les signaux sur les images pour obtenir une mesure du niveau de la signalisation.
- Comparer les mesures et faire un graphique.
10. Les résultats représentatifs
Le résultat d'une expérience in situ de l'APL montre aussi discret taches fluorescentes. L'emplacement du signal dépend des protéines spécifiques étudiés.
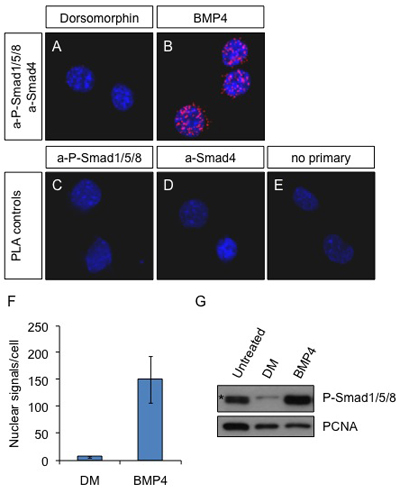
Figure 1. In situ PLA sur les cellules Neuro2a après stimulation BMP4. Les cellules ont été traitées avec 2 uM (inhibiteur de la voie BMP) dorsomorphin (A) ou 25 ng / ml BMP4 (B) pendant 60 min ou elle n'est pas traitée (CE). Des anticorps contre P-Smad1/5/8 et Smad4 ont été utilisés pour détecter les complexes actifs dans A et B. Les anticorps primaires aP-Smad1/5/8 seul (C) et un seul Smad4 (D) ou d'une omission du primaire anticorps (E) ont été utilisés comme témoins. Bleu: DAPI; rouge: signal de l'APL. Les images ont été obtenues avec un microscope Leica SP5 confocale.
(F) Les signaux de PLA ont été comptés avec le logiciel DuoLink ImageTool et le nombre moyen de taches dans le noyau par cellule est présenté dans le graphique. (G), les cellules ont été laissés Neuro2a non traitées ou traitées avec Dorsomorphin (2 pM) ou BMP4 (25 ng / ml) pendant 60 min. Les cellules ont été lysées et les protéines ont été soumis à SDS-PAGE et analysés par immunoempreinte avec aP-Smad1/5/8 et PCNA, comme le contrôle du chargement. (*) Non spécifiques bande. Notez que l'anticorps aP-Smad1/5/8 ne peut pas distinguer entre les trois protéines différentes présentes dans un complexe avec Smad4.
Discussion
La visualisation des complexes de protéines in situ est en grande demande, notamment pour des études dans la signalisation où l'interaction des protéines et modification des protéines sont les moyens que les cellules utilisent pour envoyer un signal de leur surface au noyau. Il n'a pas été possible de visualiser et de quantifier les complexes entre deux protéines endogènes in situ avec immunofluorescence avant. Co-localisation des anticorps expositions de basse résolution et ne peut pas être utilisé pour visualiser une véritable interaction. APL est une nouvelle technique que les chercheurs ont commencé à utiliser dans différents systèmes avec un grand succès 6, 7. Ici, nous montrons comment utiliser l'APL non seulement de visualiser mais aussi de quantifier les complexes endogènes entre les effecteurs Smad activées en aval de la stimulation de BMP au cours du temps. Nous avons utilisé différentes cellules de culture de tissus, y compris Neuro2a et s'est appuyé sur les anticorps commerciaux soulevées dans différentes espèces (souris, un lapin et-Smad4 aP-Smad1/5/8) pour y parvenir (figure 1). Cette méthode nous a permis, pour la première fois, pour voir l'activation de la BMP-effecteur complexes au fil du temps, et pas seulement la présence de l'Smad1/5/8 phosphorylée, ce qui ne peut pas tous être impliqués dans des complexes actifs avec Smad4. Nous avons compté les signaux (figure 1F) et comparé la mesure avec la quantification obtenue à partir des cellules immuno-mêmes 8 (figure 1G). Nous avons conclu que le nombre de taches de fournir une mesure précise de la signalisation comparative des niveaux au fil du temps. La technique a également été appliqué sur d'autres lignées cellulaires (HEK293T et Cos7) avec des résultats similaires (données non présentées).
Le principe de la technologie est basée sur deux sondes unique fourni avec le kit DuoLink. Chaque sonde se compose d'un PLA anticorps secondaire attachée à un oligonucléotide synthétique unique, qui agit comme un journaliste. La proximité de la sonde permet la ligature d'ADN à l'endroit exact où ces sondes sont attachées à proximité. La distance des oligonucléotides, qui permet l'hybridation de l'ADN et la ligature est petite (40nm <) et par conséquent, seules protéines qui interagissent peut permettre la ligature. L'ADN ligaturé peut alors être amplifiés et détectés par hybridation des oligonucléotides marqués de la séquence amplifiée. L'amplification est spécifique car elle dépend des principes d'hybridation ADN-ADN et fournit également une grande sensibilité que l'ADN ligaturé est amplifié de plusieurs ordres résultant dans l'amélioration de l'événement ligature initiale. L'ADN amplifié est détecté par hybridation avec des oligonucléotides marqués et produit un spot visible et assez grande. Comme les taches peuvent être comptés, le signal APL fournit non seulement l'information spatiale exacte (l'emplacement des événements d'interaction) mais également un moyen objectif de quantifier ces événements 2-4.
D'autres techniques qui sont employées pour la détection d'interactions entre protéines comprennent la co-immunoprécipitation, immunofluorescence et Fluorescent Resonance Energy Transfer (FRET). Co-immunoprécipitation sont largement utilisés permettant l'isolement de complexes protéiques. La méthode est accompagnée par immunoblot ce qui signifie que les protéines doivent être exprimés à des niveaux relativement élevés pour être détectés. Les problèmes de bruit de fond élevé ou la liaison non spécifique de certaines protéines sur les billes sont parfois difficiles à surmonter dans la co-immunoprécipitation. En outre, les co-immunoprécipitation permettent la détection de protéines qui peuvent faire partie d'un complexe protéique, mais ne peut pas distinguer ceux qui sont en très grande proximité physique interagissant les uns avec les autres. Par ailleurs, la co-immunoprécipitations ne peut pas fournir de quantification dans la résolution seule cellule ou d'informations sur la localisation des complexes de protéines dans la cellule. Détection de co-existence de complexes protéine dans une cellule ou d'un compartiment cellulaire par immunofluorescence est basé sur le chevauchement des signaux diffus et donc, a une faible résolution spatiale et ne peuvent pas fournir des informations précises sur les interactions entre protéines. La quantification du signal immunofluorescence peut être fait par estimation visuelle que si la différence est de plusieurs fois, et ne peuvent pas être tous exacts ou mesurables que les taches de PLA. FRET permet la visualisation des complexes de protéines dans les cellules vivantes et surmonte la nécessité d'anticorps et l'exposition de l'épitope. Toutefois, FRET dépend généralement de la surexpression de protéines fusionnées artificielle, qui peut ne pas refléter les complexes protéine endogène comme dans l'APL.
Conditions de blocage dans le protocole de l'APL sont critiques que l'agrégation des anticorps peuvent se produire et d'augmenter le fond. D'autres conditions de blocage peut être trouvé dans les fiches produit des anticorps. Des contrôles appropriés avec omission des anticorps primaires et secondaires fournissent des informations sur ce qui peut avoir mal tourné et dont ils ont besoin d'être toujours compris. Il est important de dépister des anticorps différents qui vont donner la moindre arrière-plan quand ils sont utilisés seuls et le meilleur signal quand ils sont ensemble. Fixation du CELls est essentiel que plus de la fixation peut provoquer des complexes protéiques pleinement dénaturent et dégradent, tandis que la fixation insuffisante peut conduire à la perte des complexes de protéines au cours des étapes de la procédure. Ceci peut être contrôlé en abaissant la concentration du fixateur de 3%, soit en limitant le temps de fixation. Toutefois, la fixation dépend aussi de savoir si les anticorps primaires reconnaissent les protéines dénaturées ou non. Comme la technique de l'APL est très sensible, un soin particulier est nécessaire pour maintenir le temps d'incubation et des conditions égales entre les micro échantillons différents.
Les échantillons ne doivent pas être laissées à sécher à tous les cas avant la dernière étape. Le séchage des échantillons peut conduire à fond augmenté. L'élimination complète de la solution de blocage est également essentiel afin d'éviter de fond. Les tampons de lavage doivent toujours être amenés à température ambiante avant utilisation, comme à basse température ralentit les réactions enzymatiques. Pour le dépannage, se reporter au manuel du kit.
Il est utile d'utiliser les taches de déterminer la localisation sub-cellulaire du signal APL (ex. DAPI, l'actine, etc.) Ici nous avons utilisé DAPI (dans le milieu de montage) pour colorer les noyaux. Le PLA est compatible avec l'utilisation d'immunofluorescence avec des anticorps pour déterminer le type de cellule ou un compartiment cellulaire (non représenté ici). Quantification précise qui peut être fait en comptant les signaux et l'utilisation de logiciels spécifiques (Image Tool DuoLink, OLINK Biosience).
En conclusion nous avons démontré comment utiliser in situ de l'APL, l'aide du kit de détection BMP DuoLink signalisation dans les cellules fixes et présenté ses avantages: facile à utiliser, hautement sensible, pas de fond, et une capacité unique à quantifier actifs signalisation des BMP in situ.
La limitation de l'application de cette technique pour étudier les interactions entre protéines différentes dépend de la disponibilité et la qualité des anticorps primaires qui reconnaissent les protéines de l'enquête.
Déclarations de divulgation
Remerciements
Cette recherche est financée par les MRC et les subventions du BBSRC. Nous remercions Agata Zieba et Katerina Pardalis au Laboratoire Ulf Landegren de l'Université d'Uppsala pour aider à la mise en place de la technique et des conseils utiles. Biosience OLINK de l'aide technique et de la présentation.
matériels
| Name | Company | Catalog Number | Comments |
| GMEM | Invitrogen | 21710025 | |
| DMEM | Invitrogen | 21063029 | |
| FBS | AutogenBioclear | 7.01 | |
| Non-essential Amino Acids | Invitrogen | 11149068 | |
| Sodium Pyruvate | Invitrogen | 11360070 | |
| Penicillin / Streptomycin | Invitrogen | 15140122 | |
| L-glutamine | Invitrogen | 25030-054 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | |
| 16-well chamber slides | Lab-Tek | 178599 | |
| Polysine | VWR international | 631-0107 | |
| Cover glass | VWR international | 631-0138 | |
| a-pSmad1/5/8 | Cell Signaling Technology | 9511 | |
| a-Smad4 (B8) | Santa Cruz Biotechnology, Inc. | sc-7966 | |
| Dorsomorphin | Merck & Co., Inc. | 171260-10MG | |
| Recombinant Mouse BMP-4 | R&D Systems | 5020-BP-010 | |
| PFA | Sigma-Aldrich | P6148 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Promega Corp. | H5151 | |
| Duolink II Detection Reagents (Orange) | Olink Bioscience | 92007-0100 | |
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | |
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | |
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | |
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
Références
- Miyazono, K., Kamiya, Y., Morikawa, M. B. o. n. e. morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 .
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon