Method Article
Fabrication d'hydrogels pour les systèmes de culture Micropatterned neuronaux utilisant la photolithographie dynamique projection de masque
Dans cet article
Résumé
Des techniques simples sont décrites pour la production rapide de systèmes de culture microfabriqué neurones en utilisant un dispositif micromiroirs numériques pour la lithographie masque de projection dynamique sur réguliers des substrats de culture cellulaire. Ces systèmes de culture peut être plus représentatif de l'architecture biologique naturel, et les techniques décrites peuvent être adaptées pour de nombreuses applications.
Résumé
De plus en plus, les environnements à motifs de culture de cellules deviennent une technique pertinente pour étudier les caractéristiques cellulaires, et de nombreux chercheurs croient en la nécessité pour les environnements en 3D pour représenter des expériences in vitro qui permettent de mieux imiter les qualités de vivo 1-3. Des études dans des domaines tels que le cancer de recherche 4, 5 neurones d'ingénierie, physiologie cardiaque 6, et interactions cellule-matrice 7,8 ont montré le comportement des cellules diffère considérablement entre les cultures traditionnelles et les constructions monocouche 3D.
Les hydrogels sont utilisés comme des environnements 3D en raison de leur variété, la polyvalence et la capacité à adapter la composition moléculaire grâce à la fonctionnalisation 9-12. De nombreuses techniques existent pour la création de constructions que des cellules de soutien des matrices, y compris électrofilage 13, timbres élastomère 14, impression jet d'encre 15, 16 photopatterning additif, photomasque statiques de projection-lithographie 17, et microstéréolithographie masque dynamique 18. Malheureusement, ces méthodes impliquent de multiples étapes de production et / ou équipements ne sont pas facilement adaptables à la cellule conventionnelle et méthodes de culture tissulaire. La technique employée dans ce protocole s'adapte aux deux dernières méthodes, en utilisant un dispositif de micromiroirs numériques (DMD) pour créer des masques dynamiques de réticulation géométriquement spécifiques poly-(éthylène glycol) (PEG) hydrogels, induite par UV polymérisation initiée par les radicaux libres. Le résultat "2.5D" structures offrent un environnement contraint 3D pour la croissance neuronale. Nous employons une approche bi-hydrogel, où PEG sert une structure cellulaire région restrictive fourniture d'une autre cellule, mais informes permissive d'auto-assemblage de gel fait à partir de Puramatrix ou d'agarose. Le processus est un moyen rapide simple d'une fabrication étape qui est hautement reproductible et facilement adaptable pour une utilisation avec les méthodes classiques de culture cellulaire et des substrats.
Explants de tissus entiers, tels que ganglions de la racine dorsale embryonnaire (DRG), peuvent être incorporés dans les constructions d'hydrogel double pour les essais expérimentaux tels que la croissance des neurites. En outre, les cellules dissociées peuvent être encapsulés dans l'hydrogel photoréticulables ou auto polymérisant, ou de manière sélective collé à la membrane cellulaire support perméable à l'aide restrictive photopatterning. Utilisation de la DMD, nous avons créé des constructions hydrogel jusqu'à ~ 1 mm d'épaisseur, mais en couches minces (<200 um) des structures de PEG ont été limités par la trempe d'oxygène de la réaction de polymérisation radicalaire. Nous avons ensuite développé une technique utilisant une couche d'huile au dessus du liquide de polymérisation qui a permis à la structure fine de polymérisation PEG.
Dans ce protocole, nous décrivons la création rapide de systèmes d'hydrogel 3D pour la production de cellules neurales microfabriqué et cultures de tissus. Les constructions d'hydrogel double démontré ici représentent polyvalent des modèles in vitro qui peuvent s'avérer utiles pour les études en neurosciences impliquant la survie cellulaire, la migration et / ou la croissance des neurites et d'orientation. Par ailleurs, comme le protocole peut travailler pour de nombreux types d'hydrogels et les cellules, les applications potentielles sont à la fois varié et vaste.
Protocole
1. Configuration DMD
- Le conseil DMD, guide de lumière UV (avec collimateur) et objectif 4x sont tous montés à la verticale sur une table anti-vibrations.
- Le guide de lumière UV devrait être ajusté afin que la lumière frappe le miroir array à un angle de 45 ° par rapport au plan des miroirs, et 24 ° en dessous du plan des miroirs (figure 1).
- L'objectif est monté de telle sorte que la distance de la DMD de la lentille de l'objectif correspond à la longueur focale associée à la lentille.
- Un microscope inversé est placé sous la lentille de l'objectif, tel que la lumière réfléchie par le concentré DMD peut être visualisée à travers le microscope. La distance entre la lentille de l'objectif à la surface de polymérisation doit correspondre à environ la distance de travail de la lentille. La scène sur le microscope peut alors être utilisé pour ajuster finement cette distance à focaliser l'image. Cette distance peut varier en fonction de la surface de polymérisation choisi.
2. Construit hydrogel double pour des cultures d'explants de tissus
L'adhérence A. explant DRG
- Enduire les murs de 6 puits revêtues de collagène inserts de culture cellulaire (Corning) avec Rain-X, en prenant soin d'éviter la membrane elle-même. (Sinon, un stylo barrière hydrophobe peut être utilisé.)
- Inserts Hydrater la nuit avec 1,5 mL de milieu d'adhérence dans un incubateur à 37 ° C et 5% de CO 2. L'adhérence est moyenne milieu neurobasal avec 10% de sérum de veau fœtal, 1% de pénicilline / streptomycine, 0.5mm L-glutamine, et 20 ug / ml de NGF.
- Récolte des ganglions de la racine dorsale embryonnaire (DRG) de chiots E-15 chez le rat. GHM devrait être plaqué sur revêtues de collagène de 6 puits inserts, autant que quatre par plaquette.
- Incuber inserts pendant 2 heures pour permettre l'adhésion DRG à la membrane.
Photopolymérisation B. masque dynamique
Un dispositif micromiroirs numériques (DMD) est une matrice 1024 x 768 de miroirs individuels, semblable à celui de téléviseurs à projection, ce qui reflète la lumière de façon sélective basée sur la position miroir. Pour nos besoins, le DMD est utilisée pour l'ultraviolet motif (UV) sur des hydrogels photoréticulables, la création de géométries hydrogel spécifiables d'une manière simple et rapide. La figure 1 illustre la configuration de la voie la DMD et la lumière UV. Bien que notre DMD est une unité autonome, l'appareil peut également être intégré pour une utilisation avec de nombreux microscopes existants.
- Retirez tous les excès de liquide d'insertion, et ajouter 500 ul de milieu de polymérisation à l'intérieur de l'insert. Milieu de polymérisation contient du PEG à 10% (1000 MW) et de 0,5% Irgacure 2959 dissous dans un milieu de neurobasal complété avec 20 ug / ml de NGF et de Pen 1% / Strep.
- Placer l'insert sous le dispositif DMD sur une lame de Rain-X en verre traité.
- Charger l'image appropriée en noir et blanc pour être utilisé comme un "photomasque" sur le DMD, grâce à l'utilisation du programme inclus GUI ALP-3 de base. Pour nos besoins, une forme bifurcation a été choisi pour permettre la mise en œuvre de systèmes d'orientation des neurites.
- En utilisant un microscope inversé pour la visualisation, d'aligner les explants de tissu à l'emplacement approprié sur le photomasque utilisant une source de lumière visible se reflétant sur la DMD.
- Mettez la source de lumière visible pour la source de lumière UV, et d'éclairer la solution de PEG jusqu'à réticulation est suffisante. (Pour les conditions indiquées et 5,0 Watts / cm 2 d'incident sur le DMD, la réticulation peut être complétée en aussi peu que 55 secondes.) Répétez l'opération pour tous les GHM quatre sur l'insert.
- Laver chaque insérer trois fois avec du DPBS stérile et 1% de Pen-Strep.
- Ajouter un milieu de croissance de 1,5 ml sous les inserts de culture cellulaire, et permettent d'équilibrer dans un incubateur pendant 30 minutes. Le milieu de croissance est moyen neurobasal contenant B-27 à 2%, 1% Pen / Strep, 0.5mm L-glutamine et 20 ug / ml de NGF.
C. hydrogel secondaire
Puramatrix
- Pour des applications neuronales, Puramatrix 1% est dilué conformément aux instructions du fabricant à 0,15% en H 2 O stérile et complété avec 1 ug / ml de laminine soluble.
- Tous les médias en excès doit être retiré de la PEG vides, qui contiennent les explants DRG, en utilisant un applicateur de coton stérile pointe, Kimwipe, ou micropipette.
- Puramatrix est ajouté à la vides PEG avec une micropipette, afin de combler l'espace vide, sans débordement. Selon le volume de vide, généralement ~ 1 ul est utilisé par la construction.
- Puramatrix commence le processus d'auto-assemblage immédiatement après le contact avec une solution salée physiologique, à savoir le PEG enflée, mais de 1,5 mL de milieu de croissance est ajouté au-dessous de l'insert et placés dans l'incubateur pendant une heure afin d'assurer la gélification totale.
- Initialement, Puramatrix est légèrement acide, donc changer le support après une heure pour permettre le pH à s'équilibrer.
- Changements des médias sont priés environ toutes les 48 heures. Veillez à ce que tous les médiasajouté en dessous de l'insert, pour protéger l'intégrité de Puramatrix mécaniquement faible.
Agarose
- Pour des applications neuronales, l'agarose est dilué à une solution à 1% en milieu de croissance et placé dans un bain d'eau à 60 ° C jusqu'à ce que l'agarose dissout complètement (~ 1 h). La solution est alors complété par 1 ug / ml de laminine soluble.
- Tous les médias en excès doit être retiré de la PEG vides.
- L'agarose est ajouté à la PEG vides afin de combler l'espace vide, sans débordement. Selon le volume de vide, généralement ~ 1 ul est utilisé par la construction.
- 1,5 ml de milieu de croissance est pré-frais (8 ° C) dans une plaque à 6 puits, et les inserts d'agarose contenant sont transférés aux médias réfrigérée et maintenue dans un réfrigérateur à 8 ° C pendant au moins trois minutes pour permettre à l'agarose gel.
- Enfin, les inserts sont transférés à 1,5 mL de milieu de croissance pré-chauffée (37 ° C) et maintenu dans l'incubateur à 37 ° C, avec les changements de supports nécessaires toutes les 48 heures.
3. Double encapsulation cellulaire Hydrogel 3D
Encapsulation hydrogel double est appropriée lorsque vous utilisez un gel de l'auto-assemblage. Le gel photoréticulables, dans ce cas, le PEG, sert de support structurel pour la présentation géométrique du gel de l'auto-assemblage, par exemple Puramatrix ou d'agarose. Certaines de ces méthodes, en particulier le type de gel et le choix du photomasque, dépendra de l'application particulière désirée.
- Charger un masque approprié sur la DMD. Pour notre survie cellulaire d'application, nous avons simplement choisi une présentation cylindrique de Puramatrix à l'aide de l'imagerie des cellules. Les chercheurs qui étudient la signalisation cellulaire pourraient être intéressés à une géométrie parcellaire pour permettre la diffusion de molécules chimiotactiques. De plus, une approximation grossière d'une artère a été montré pour représenter une éventuelle application à la recherche des vaisseaux sanguins.
- Traiter les murs d'un insert de culture cellulaire de polyester avec Rain-X, et les placer sous DMD sur Rain-X lame revêtue.
- Ajouter 500 ul de milieu de polymérisation à l'insert. Provoquer réticulation PEG par l'exposition à la lumière UV pendant 55 secondes.
- Laver trois fois avec du DPBS stérile et 1% de Pen-Strep.
- Retirez tous les supports vides en excès de la PEG.
- Isoler les cellules à la densité désirée dans une pastille. Des précautions doivent être prises pour éliminer tous les moyens à partir du culot cellulaire avant de les mélanger, comme Puramatrix commence l'auto-assemblage immédiatement après le contact avec une solution saline. Suspendre l'intérieur des cellules Puramatrix 0,15% dilué dans H 2 O stérile complété avec 10% de saccharose.
- Injecter l'Puramatrix / cellule / saccharose mélange à l'intérieur des vides dans le PEG.
- Ajouter 1,5 mL de milieu de croissance en dessous de l'insert, et de permettre au gel de l'intérieur incubateur pendant une heure.
- Changer les médias après une heure, et ~ toutes les 48 heures après.
4. Simple encapsulation cellulaire Hydrogel 3D
Une encapsulation hydrogel unique serait approprié pour toute situation où les cellules peuvent être examinées à l'intérieur d'un hydrogel photoréticulables.
- Charger un masque approprié sur la DMD. Pour les études de survie cellulaire, nous avons de nouveau choisi un masque de base circulaire, pour représenter un cylindre. Masques similaires à celles indiquées dans la méthode 4 pourrait de nouveau être appliquée pour le champ de recherche approprié.
- Traiter un insert de culture cellulaire de polyester avec Rain-X, et les placer sous DMD sur Rain-X lame revêtue.
- Cellules à toute concentration désirée peut être ajouté directement à la solution de PEG 10%, en mélangeant bien pour assurer une distribution homogène.
- Ajouter 500 ul de milieu de polymérisation à l'insert. Provoquer réticulation PEG par l'exposition à la lumière UV pendant 55 secondes.
- Laver trois fois avec du DPBS stérile et 1% de Pen-Strep.
- Remplir avec un milieu de croissance au-dessous et au-dessus de l'insert, en changeant tous les 2 jours ~.
5. Mince polymérisation du film d'hydrogel
- Charger un masque approprié sur la DMD.
- Traiter un revêtus de collagène insert de culture cellulaire de polyester avec Rain-X, et les placer sur Rain-X lame revêtue.
- Ajouter milieu de polymérisation suffisant pour simplement couvrir le fond de l'insert (~ 250-300 uL pour les inserts plaque à 6 puits). Autoriser les médias à travers la membrane d'insertion pour 30-45 minutes à température ambiante.
- Retirer l'excès de milieu de polymérisation l'insert avec une micropipette ou Kimwipe. Ajouter une quantité suffisante d'UV-transparente d'huile pour recouvrir complètement le fond de l'insert. Autoriser l'insertion de s'asseoir pendant 15-30 minutes à température ambiante, assez longtemps pour que l'huile pour former une couche distincte au-dessus du milieu de polymérisation saturer la membrane d'insertion.
- Placer l'insert et de glisser sous la DMD. Provoquer réticulation PEG par l'exposition à la lumière UV. En raison de la minceur de la couche de PEG, la réticulation peut être complétée en aussi peu que 15 secondes à 5,0 W / cm 2 d'incident sur la DMD.
- Lavez les trois fois avec du DPBS insertion stérile et 1% de Pen-Strep. (Si la persistance d'un résidu huileux est une préoccupation, un détergent doux tel que le Tween 20 (1%) peut être ajouté au tampon de lavage.)
- Magasin de l'insert dans une plaque de 6 puits de culture de tissu. Ajouter un milieu de croissance pour les cellules en suspension, dans la concentration désirée, et la pipette un volume suffisant de la suspension cellulaire dans l'insert de culture cellulaire afin d'obtenir la densité cellulaire désirée. Ensuite, ajoutez un milieu de croissance assez en dessous de la insérez complètement à maintenir la viabilité des cellules (~ 1,5 ml).
- Après 48 heures se sont écoulées, se laver les trois insérer des fois avec du DPBS stérile et 1% de Pen-Strep pour déloger les cellules non collées. Changer les médias environ une fois toutes les 48 heures.
6. Les résultats représentatifs
Exemples d'hydrogel double constructions contenant des explants DRG sont présentés dans la figure 2. Remarquez que la migration cellulaire et l'extension des neurites est limitée à la région de cellules permissives de l'hydrogel double construire. La figure 3 représente cellules dissociées de la même encapsulée à l'intérieur du construit hydrogel double. En raison de la nature dynamique du photomasque DMD, la géométrie disponibles pour l'encapsulation est seulement limité par les dimensions et la résolution de l'optique. Encapsulation des cellules est également possible à l'intérieur d'un hydrogel seule photopolymérisables, PEG, et un test de viabilité vivants / morts a été réalisée, comme en témoigne la figure 4. Encapsulation dans le PEG est destinée uniquement à titre d'exemple, que le PEG ne représentent pas un environnement idéal pour des cellules neurales. Par conséquent, la viabilité cellulaire réalisé dans nos constructions PEG est compréhensible faible. Enfin, des exemples de l'utilisation des films minces de PEG comme une couche à motif contraignant pour l'adhésion cellulaire sur les inserts de culture cellulaire sont présentés dans la Figure 5. En outre, les exemples de possibles «mauvais» résultats sont proposés dans la Figure 6.
Les résultats ne représentent qu'une petite fraction des utilisations possibles des méthodes développées dans notre laboratoire. Ils sont destinés à démontrer la facilité, une polyvalence et la viabilité de notre approche, et pourrait être traitée comme une «preuve de principe» pour les chercheurs à développer leurs propres adaptations possibles.
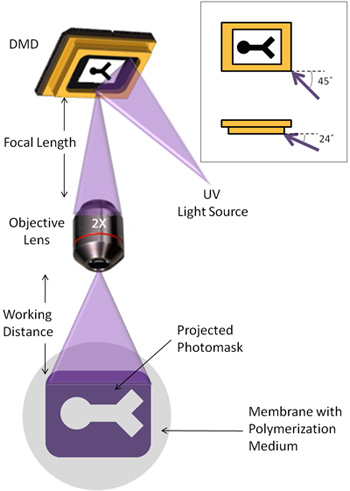
Figure 1. Illustration schématique de la voie de lumière utilisée pour la photolithographie. En médaillon: La lumière UV illumine le DMD à un angle de 45 °, et 24 ° en dessous du plan du tableau miroir.

Figure 2. Étiqueté la croissance et la prolifération des DRG hydrogel contenant des constructions double. JC) les images qui illustrent les constructions polymérisé PEG (gris) avec neurites étiquetés avec Bêta III tubuline (vert), les noyaux de cellules DAPI colorés (bleu). Les explants DRG sont contenues dans Puramatrix et situés dans les régions circulaire du modèle, avec des neurites croissante vers la bifurcation (s).
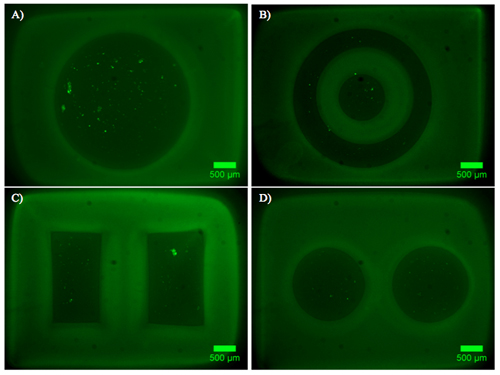
Figure 3. Construit hydrogel contenant Double cellules marquées à la calcéine AM, un marqueur de cellules vivantes, après 48 heures dans un milieu de croissance. JC) PEG formes variées, remplies de Puramatrix contenant dissocié neurones DRG (~ 5x10 3 cellules / ml).
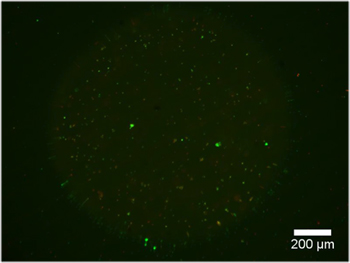
Figure 4. Hydrogel simple construction contenant des cellules vivantes étiquetés avec calcéine AM (vert) et les cellules mortes étiquetés d'éthidium homodimère-1 (rouge) après 24 heures dans un milieu de croissance (5x10 3 cellules / ml).
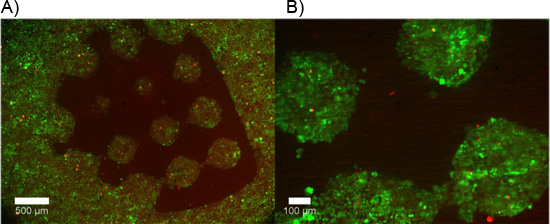
PEG cellulaire Figure 5. Restrictives polymérisé comme un film mince en utilisant un "modèle de test« de façon sélective adhèrent cellules dissociées à la membrane de collagène revêtement de supports perméables. A, B) Les cellules vivantes sont marquées après 48 heures avec AM calcéine (vert), tandis que les cellules mortes sont étiquetés avec éthidium homodimère-1 (rouge). Adhésion cellulaire minimale se produit dans la zone contenant le film PEG mince.

Figure 6. Images représentant des résultats indésirables. A) polymérisation partielle du PEG, conduisant à une PEG inutilisable construire. Polymérisation incorrecte peut se produire en raison de la présence d'un ménisque dans le milieu pré-polymère, des quantités insuffisantes de milieu de polymérisation, l'exposition aux UV insuffisante ou inadéquate attention de l'optique. B) l'image dépeignant polymérisé construit PEG (gris) avec neurites étiquetés avec Bêta III tubuline (vert), les noyaux de cellules DAPI colorés (bleu). Les neurites ont pu croître en dehors des canaux PEG motifs. Cela se produit souvent dans la condition qui déborde Puramatrix sur le dessus de la partie PEG pendant l'injection.
Discussion
Le procédé décrit ici pourrait être utilisée par tout enquêteur cherchant simple et reproductible des systèmes de culture cellulaire. Théoriquement, en raison de la grande variété d'hydrogels photopolymérisables disponibles, l'environnement pourrait être adapté pour permettre une utilisation avec n'importe quel type cellulaire, y compris les explants de tissu ensemble. De plus, le système dual d'hydrogel permet de contrôler spatiale améliorée dans la présentation de l'auto-polymérisant hydrogels, qui ont tendance à former des formes amorphes sur leurs propres. Le résultat "2.5D" construit hydrogel micropatterned fournir une matrice 3D de croissance neuronal présenté dans une configuration 2D qui permet facilement l'évaluation microscopique. Le substrat sur lequel les gels sont polymérisés peuvent également être variés, permettant un meilleur contrôle de la conception expérimentale. Nos méthodes sont optimisées pour une utilisation avec des supports de cellules perméables culture, comme nous avons vu la viabilité améliorée (figure 4) par rapport à la polymérisation sur des lames de verre (données non présentées). Toutefois, les surfaces de polymérisation d'autres peuvent être plus applicable pour différentes applications: fabrication sur lames de verre utilisées dans les expériences de la microfluidique ou formations agrégat de cellules, par exemple.
Notre expérience avec ces systèmes de culture a conduit à l'identification des domaines potentiels de la difficulté. Tout d'abord, les techniques de soin sont nécessaires pour maintenir la stérilité des constructions. En raison de la nature encombrante de la configuration de la DMD, il est difficile d'opérer étapes de polymérisation dans des conditions stériles. Pour lutter contre ce problème, l'étape de rinçage décrit dans les méthodes sont utiles, et les antibiotiques doivent être utilisés dans tous les médias. De plus, l'épaisseur et la forme finales de la construction polymérisé est fortement dépendante du comportement des fluides du mélange de pré-polymère, et la présence d'un ménisque peut se traduire par des constructions de gel qui sont trop minces ou incomplète polymérisé (figure 6). Deux mesures peuvent être prises pour minimiser la formation d'un ménisque intérieur inserts de culture cellulaire. Pour hydrogels épais (> 200 um), une simple couche de Rain-X autour de la paroi intérieure de l'insert est suffisant. Cependant, comme décrit brièvement ci-dessus, pour les constructions minces (<200 um), une couche d'huile est nécessaire pour minimiser à la fois le ménisque et nient trempe oxygène de la polymérisation radicalaire. Résolution a été trouvé à être dépendante de l'épaisseur, avec une diminution de la taille caractéristique réalisé avec des gels plus épais. La résolution a également varié selon que la fonction a représenté un relief positif ou négatif dans l'hydrogel. Toutefois, nous avons obtenu une résolution suffisante pour des constructions avec des tailles de fonction minimale sur l'échelle de ~ 100 um en utilisant des objectifs de microscope seulement comme une optique de focalisation.
Nos expériences ont montré que les constructions à double hydrogel décrit ici représentent une excellente base pour la formation de base in-vitro des modèles de croissance des neurites et d'orientation. La technique employée micropatterning est une adaptation des méthodes existantes 18,19, mais notre set-up a souligné un simple à mettre en œuvre la conception et a été optimisé pour la production de constructions hydrogel double sur inserts de culture cellulaire; inserts de culture cellulaire ont été essentiels pour améliorer la viabilité des cellules ainsi que réticulation autour d'explants de tissus préalablement adhérentes. La portée des résultats présentés est limité par les intérêts de notre laboratoire, mais nous croyons que les méthodes décrites dans cette publication sera utile aux chercheurs la recherche d'un relativement bon marché, méthode rapide et facile à utiliser pour la fabrication de culture cellulaire 3D modèles.
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier le laboratoire du professeur Anthony Windebank pour partager leur expertise sur les DRG dissection et la culture, ainsi que le professeur Chen Shaochen des discussions utiles sur la configuration de la DMD. Cette recherche a été financée en partie par l'Université Tulane et des subventions du Conseil des régents en Louisiane (LEQSF [2009-10]-RD-A-18) et le NIH (NS065374).
matériels
| Name | Company | Catalog Number | Comments |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | |
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript |
| Neurobasal Medium | Invitrogen | 21103-049 | |
| Fetal Bovine Serum | Invitrogen | 16000-036 | |
| L-glutamine | Invitrogen | 25030-164 | |
| Nerve Growth Factor | Invitrogen | 13257-019 | |
| Pen/Strep | Invitrogen | 15140-122 | |
| B-27 Supplement | Invitrogen | 17504-044 | |
| DPBS | Invitrogen | 14190-250 | |
| Puramatrix | BD Biosciences | 354250 | |
| PEG 1000 | Polysciences, Inc. | 15178 | |
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | |
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | |
| OmniCure Series 1000 | EXFO | ||
| Rain-X |
Références
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon