Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La transfection des cellules ganglionnaires de la rétine de la souris par In vivo L'électroporation
Dans cet article
Résumé
Nous démontrons une In vivo pour la transfection des grappes simples ou petites des cellules ganglionnaires de la rétine (CGR) et d'autres types de cellules rétiniennes chez les souris postnatale sur un large éventail d'âges. La capacité d'étiqueter et de manipuler génétiquement CGR postnatale In vivo Est un outil puissant pour les études de développement.
Résumé
Le ciblage et le raffinement des projections de la CJR mésencéphale est un système modèle populaire et puissant pour étudier comment les schémas précis de la forme de connectivité neuronale pendant le développement. Chez les souris, les projections sont retinofugal disposés de manière topographique et la forme des yeux spécifique des couches dans le corps genouillé latéral (dLGN) du thalamus et le colliculus supérieur (CS). Le développement de ces modèles précis de prévisions retinofugal a généralement été étudié par marquage des populations de CGR avec des colorants fluorescents et les traceurs, comme la peroxydase de raifort 1-4. Cependant, ces méthodes sont trop grossiers pour donner un aperçu des changements développementaux dans les différents morphologie tonnelle CJR axonale qui sont la base de la formation Plan rétinotopiques. Ils ne permettent pas de la manipulation génétique des CGR.
Récemment, l'électroporation est devenue une méthode efficace pour fournir un contrôle précis spatiale et temporelle pour la livraison de molécules chargées dans la rétine 5-11. Les protocoles actuels électroporation rétine ne permettent pas de manipulation génétique et le traçage des projections retinofugal d'un cluster unique ou petite des CGR chez la souris postnatale. Il a été soutenu que postnatale chez électroporation in vivo n'est pas une méthode viable pour la transfection CGR car l'efficacité de l'étiquetage est extrêmement faible et donc nécessite de cibler à l'âge embryonnaire, lorsque les progéniteurs CJR sont en cours de différenciation et la prolifération 6.
Dans cette vidéo, nous décrivons une électroporation in vivo dans le protocole d'administration ciblée de gènes, shRNA, et dextranes fluorescents au CGR murin après la naissance. Cette technique fournit une solution rentable, rapide et relativement facile pour la plate-forme de dépistage efficace de gènes candidats impliqués dans plusieurs aspects du développement neural, y compris la rétraction des axones, ramification, le laminage, la régénération et la formation des synapses à différents stades de développement des circuits. En résumé, nous décrivons ici un outil précieux qui permettra de mieux appréhender les mécanismes moléculaires qui sous-tendent le développement carte sensorielle.
Protocole
1. Installation des équipements pour l'électroporation
- Electrodes: Nous avons modifié Dumont # 5 pinces pour servir d'électrodes.
- Séparés et se briser la pince.
- Soudez un fil à l'extrémité plus large de chaque dent. Enroulez le fil attaché et broches avec du ruban isolant en laissant environ 25-30 mm de la pointe des branches exposées.
- Mettez la pince modifiés retour ainsi que tout entretoise en plastique approprié (par exemple un bouton) entre les deux branches de fournir d'action au printemps.
- L'équipement électrotechnique: Nous utilisons un stimulateur électrique pour fournir des impulsions de courant pour l'électroporation et un moniteur d'oscilloscope et audio pour confirmer la forme d'onde et le nombre d'impulsions étant livrés.
- Connectez le fil d'une broche de la pince à une pédale qui est également connecté en série avec le stimulateur. La pédale agit comme un interrupteur. Lorsqu'il est enfoncé il complète le circuit pour l'électroporation.
- Connectez le fil de l'autre volet au stimulateur électrique.
- Connectez le stimulateur à l'oscilloscope et moniteur audio.
- Micropipette et l'injecteur de configuration: Nous utilisons forte pipettes en verre tiré et les Nanoinject II Le système d'injection pour injecter de très petits volumes de colorant ou de solution d'ADN directement dans la rétine.
- Mont système d'injection sur un micromanipulateur à 3 axes.
- Tirez pipettes en verre avec un cône long et petite astuce.
- Retour remplir la pipette tiré avec de l'huile minérale et sécurisé à l'injecteur (pour plus de détails voir le manuel d'instruction Nanoinect II).
- En utilisant des ciseaux pointus microdissecting une coupe de la pointe de la pipette, en créant une petite ouverture (~ 2-3 um).
- Remplir la pipette avec la quantité désirée de la solution d'injection à travers la pointe de la pipette. Tant que l'intégrité de la pointe est titulaire, il peut être utilisé pour les injections multiples et les animaux.
Remarque: i) Assurer assez de solution pour injection est chargé dans les conseils tels que l'huile minérale remblayé n'est jamais injecté dans l'œil. ii) Le Nanoinject II du système et l'équipement électronique spécifique utilisé dans cette vidéo ne sont pas essentiels à la réalisation réussie d'étiquetage des CGR. Les injections faites avec d'autres appareils comme une picospritzer et l'électroporation avec d'autres stimulateurs commune peut également être utilisé pour CGR étiquette.
2. Solutions de plasmide pour l'étiquetage du CJR
- Pour l'étiquetage des petits amas de CGR: Nous utilisons une construction codant pour l'EGFP (~ 2-3 pg / pl) améliorée protéine fluorescente verte) sous le contrôle d'un promoteur CAG (poulet β-actine avec un promoteur CMV précoce immédiat Enhancer). EGFP est étiqueté avec la séquence palmitoylation de GAP-43 (protéine associée à la croissance-43), il cible à la membrane cellulaire (mut4EGFP) 12. Cette construction est appelée pCAG-gapEGFP.
- Pour l'étiquetage cellule unique: Nous utilisons une combinaison de deux concepts. Le premier vecteur est un promoteur CAG conduire recombinase Cre (pCAG-Cre, Addgene [Cambridge, MA] plasmidique 13 775) 13 et le deuxième vecteur contient une cassette d'arrêt floxés suivie par la membrane cible EGFP (pCAG-LNL-gapEGFP). pCAG-Cre (~ 0.15-ng/μL) est utilisé à une concentration d'environ 1,000-10,000 fois plus faible que pCAG-LNL-gapEGFP (~ 1-2 μgμL), confinant expression de l'EGFP fort à un petit nombre de cellules (en vertu de relativement faible de la pCAG-Cre concentration).
3. Injection de la rétine et du Protocole d'électroporation
- Jour postnatal 0 (P0) pour chiots P5 sont anesthésiés par l'hypothermie, tandis que les souris âgées de P5 sont anesthésiés par une injection intrapéritonéale (0,7 ml / kg) d'un cocktail de kétamine (4,28 mg / mL), la xylazine (0,82 mg / ml) , et l'acépromazine (0.07mg/ml) 14.
- Stériliser tous les instruments chirurgicaux et des conseils d'électrode dans un stérilisateur à chaleur perle. Par la suite refroidir à la fois dans une solution saline stérile avant utilisation pour éviter les dommages thermiques à l'œil.
- Placez la souris dans un champ de dissection et la position de l'injecteur.
- Pour les souris plus jeunes que P14 (avant l'ouverture des yeux), une intervention chirurgicale de la paupière ouverte en coupant sur toute la longueur de l'ouverture de la paupière avenir avec des ciseaux à ressort micro b dissection.
- Faire partie du globe oculaire saillir par un léger appliquant une pression autour de l'œil avec le bout des pinces à c.
- Tenir l'œil en place en pinçant doucement la peau autour du globe oculaire.
- Ajustez micromanipulateur et apporter une pipette à proximité du globe oculaire.
- Pédale de presse, qui est relié au système Nanoinject II, d'expulser quelques gouttes de solution d'injection et donc de vérifier que la pipette n'est pas bouché.
- Avec une main stabiliser le globe oculaire, déplacer le micromanipulateur de telle sorte que la pointe de la pipette en verre perce à travers l'épithélium pigmentaire de la rétine et pénètre dans la rétine.
- Injecter desIRED montant de la solution en appuyant sur la pédale pour le système Nanoinject II. Par exemple, pour l'étiquette CGR seule que nous faisons une injection unique de 2,3 4.6nL.
- Rétracter la pipette et placer soigneusement extrémités des électrodes directement sur le site d'injection et à déprimer pédale pour stimulateur pour compléter le circuit et électroporation de l'œil. Nous utilisons généralement des impulsions carrées avec des réglages de puissance 25V, 50 ms durée, en dehors 1sec. 10 impulsions (5 impulsions de chaque polarité) sont appliqués pour les souris impulsions de plus de P4 et 6 (3 impulsions de chaque polarité) sont appliquées pour P0 à P3 souris.
- Poussez doucement globe oculaire en arrière dans la douille et appliquer une pommade ophtalmique stérile sur les paupières coupées.
- Animaux Placer sur un pad thermique à température contrôlée et sur le rétablissement complet, y compris le réchauffement adéquats et la mobilité, le retour des animaux à leur mère.
- Surveiller les animaux toutes les 12 heures pour tout signe de douleur, de détresse ou d'inconfort, comme la perte de mobilité, une posture anormale ou l'échec de toiletter. Plusieurs cycles de l'anesthésie, des injections et l'électroporation ne doit pas être effectuée sur le même animal.
4. Remarques
- La méthode d'injection décrite dans cette vidéo est un «aveugle» d'injection. Il est possible de visualiser la quantité et l'emplacement de l'injection lorsque l'on travaille avec des souris albinos et des solutions colorées (DII ou solution de plasmide avec des traces de bleus rapide). Cependant, avec des souches de souris pigmentée l'emplacement d'injection ne peuvent être directement visualisées et donc il est difficile de décrire verbalement que l'on a atteint l'emplacement prévu rétinienne ou combien il faut déplacer la pipette pour cibler spécifiquement la couche CJR. Par conséquent, nous conseillons vivement aux utilisateurs de nouvelles de commencer d'abord avec les injections DiI chez des souris albinos car ces injections peuvent être immédiatement visualisées dans la rétine et l'étiquetage des projections CJR à la rétine et le cerveau peuvent être utilisés pour évaluer la qualité de l'injection. Préparer 10% DiI dans le N, N-diméthylformamide (100%) pour des injections focales. Utilisateurs Une fois cette procédure est maîtrisée doit être capable de cibler systématiquement CGR avec des solutions d'ADN plasmidique évident chez les souris pigmentées.
- La méthode d'injection décrite dans cette vidéo peut être utilisé pour faire des injections de focale DiI à l'étiquette de petites populations de cellules à étudier rétinotopie (4.6nL étiquettes à quelques centaines de CGR) 14 et au CGR étiquette en vrac avec des fluorophores (Alexa555, 488, etc), conjugué à B du choléra sous-unité de toxine pour étudier yeux ségrégation spécifique, à l'exclusion de l'étape d'électroporation dans # 10 ci-dessus. Un volume d'injection maximale totale de 2-3UL pour les souris de plus de P14 et 1-2UL pour des souris plus jeunes que P14 de toute solution est recommandée.
- Pipettes peut être remblayée avec des solutions à injecter suivie par remblayage avec de l'huile minérale avant le montage de la pipette sur l'injecteur et de briser la pointe. Ceci est particulièrement utile lors de l'utilisation des solutions à forte concentration de l'ADN (~ 6ug/uL), qui sont en général très visqueux et difficile à charger à partir de la pointe de la pipette.
- Si la pipette en verre devient bouché, essuyez soigneusement la pipette avec un coton tige trempé dans de l'eau pour des solutions d'ADN et de l'éthanol (100%) pour le colorant (DII) de solutions.
- Après l'injection dans l'oeil, rétracter la pointe de la pipette du globe oculaire et appuyez sur la pédale d'injecter à nouveau. Ceci est pour confirmer que la pointe ne sont pas obstruées durant le processus d'injection. Si aucune solution n'est dispensé, il est fort probable que l'injection n'a pas été couronnée de succès. Toutefois, cela ne devrait pas être pris comme un signe absolu que l'injection n'a pas été couronnée de succès. L'expérimentateur peut injecter le même œil nouveau si les sites d'injection multiples et l'étiquetage des plus grand nombre de cellules est souhaitée.
- Pour l'étiquetage des CGR seule, régler la vitesse d'injection pour ralentir sur le boîtier de commande Nanoinject. Cela réduit encore la quantité de solution injectée dans la rétine comme le système prend plus de temps à ce paramètre pour passer la solution tout en l'extrémité de la pipette en verre est rentré rapidement à partir du globe oculaire.
- Electroporation de jour postnatal 0 à 3 (P0 à P3) souris nécessite des soins supplémentaires car il est très facile d'endommager l'oeil (cela devient évident après quelques jours de la reprise, quand l'œil est manifestement inférieure à la normale). Réduire le nombre d'impulsions et de la tension appliquée est conseillé pour le début de souris néonatales. Après P4, les globes oculaires sont plus résistants aux dommages causés par l'électroporation.
- Dans notre expérience de la membrane versions ciblées de EGFP ou DDP («gapEGFP ', voir 12) sont de loin supérieures à la GFP non modifiée pour examiner les projections retinofugal au cerveau. Toutefois, pCAG-tdTomato, qui manque d'une membrane cible de modification, fonctionne aussi bien (figure 1E). En outre, le dextran conjugué colorants fluorescents peuvent également être utilisés pour CGR étiquette en utilisant le protocole d'électroporation décrit ci-dessus.
- Typiquement, 9 des 10 injections mènera à CGR étiquetés, bien que seulement environ 15% des injections avec la double approche plasmiderésultat en seulement une seule CJR être étiquetés. Le nombre de cas de succès peut être augmentée par l'injection d'ADN dans de multiples endroits dans un œil ou par injection de plasmides codant pour différentes protéines fluorescentes dans chaque œil.
5. Les résultats représentatifs
RGC étiquetage a été observée à tous les âges, allant de la P2 à P25, avec un étiquetage EGFP dans CGR par les 24 heures après l'électroporation et maintenu l'expression d'au moins trois semaines après la transfection.
Dendrites marqué par fluorescence (figure 1A, B) et tonnelles axonale (figure 1F) du CGR unique peut être clairement visualisées et reconstruit.
En dehors de CGR, cette technique peut être utilisé pour étiqueter les autres types de cellules rétiniennes telles que les cellules horizontales, les cellules bipolaires et divers sous-types de cellules amacrines (figure 1C)
Cette méthode ne pas interférer avec le cours du temps normal de raffinement carte visuelle comme démontré par rétinotopie normale dans le SC (figure 1E).
À tous les âges, dans environ 90% des cas, une injection de petit volume (~ 2,3 4.6nL) de pCAG-gapEGFP conduit à l'expression dans un CGR quelques (figure 1D).
Dans environ 15% des essais en utilisant une injection unique de l'pCAG-Cre et plasmides combinaison pCAG-LNL-gapEGFP par animal, conduit à l'étiquetage seul neurone rétinien dont CGR (figure 1A, B, D) et d'autres types cellulaires comme les amacrines cellules (figure 1C).
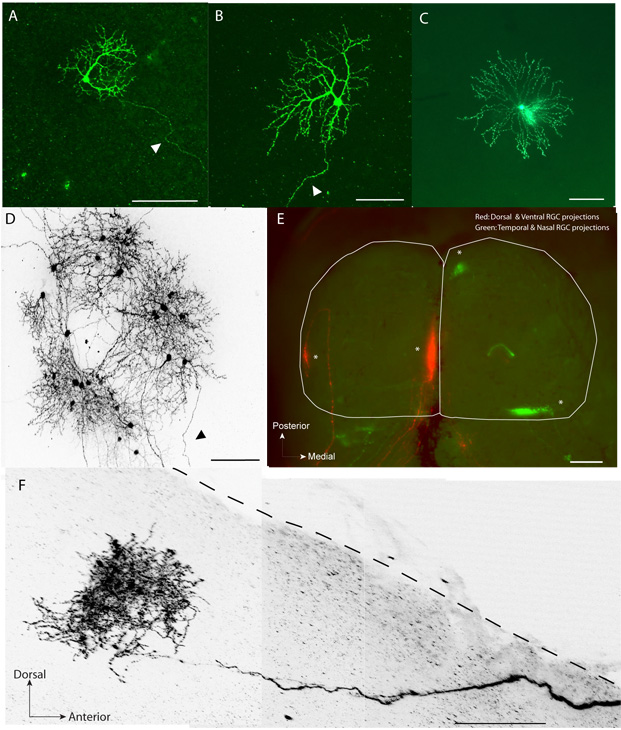
Figure 1 - A, B. Exemples de EGFP étiquetés seule cellules ganglionnaires de la rétine (tête de flèche pointant vers l'axone) dans une rétine à plat à montage en post-natal de 14 jours (P14) C. Exemple de cellule amacrines seule Starburst au P8 D.. . Un groupe de neurones rétiniens EGFP étiquetés, y compris CGR et les cellules amacrines dans la rétine, une plate-monture au P14 CGR E.. dorsale et ventrale de l'œil droit ont été électroporés et étiquetés avec EGFP et CGR temporelle et ventrale de l'œil gauche était galvanisé et étiquetés avec tdTomato en P1. Les zones cibles (astérisques) formée par le CGR marquées peuvent être vus à leur emplacement topographique correct dans le SC à P9 (toute monture, contour blanc). F. Exemple d'une seule étiquette EGFP CJR Arbor (2-D de projection) dans une coupe sagittale (250 um d'épaisseur) de la SC (ligne pointillée). Pour plus de clarté, les images en (D) et (F) ont été converties en niveaux de gris et inversée. Barres d'échelle (um): (A) - (D), (F): 100; (E): 500
Discussion
Dans cette vidéo, nous démontrons une électroporation in vivo dans le protocole que les résultats en matière d'étiquetage des grappes simples ou peu de neurones rétiniens chez les souris postnatale avec des constructions d'ADN codant pour des protéines fluorescentes. De petits groupes de marquage fluorescent des projections de la CJR dLGN et SC reproduit les modèles de projection similaires que les études précédentes utilisant l'étiquetage RGC avec les colorants lipophiles, ce qui indiq...
Déclarations de divulgation
Remerciements
Le plasmide pCAG-gapEGFP était un don du Dr. S. McConnell (Stanford, CA). pCAG-tdTomato plasmide a été un cadeau du Dr M. Feller (Berkeley, Californie). Nous remercions le Dr Edward Ruthazer pour suggérer l'utilisation d'une stratégie à deux plasmides pour l'étiquetage seule cellule et Anne Schohl (Montréal, QC) pour la validation des deux plasmides Cre / loxP stratégie dans des études pilotes et membres du laboratoire Crair pour le soutien technique. Soutenu par R01 MH62639 (MC), le NIH R01 EY015788 (MC) et NIH P30 EY000785 (MC).
matériels
| Name | Company | Catalog Number | Comments |
| Matériaux | Société | Le numéro de catalogue | |
|---|---|---|---|
| Dumont # 5 forceps | Outils Fine Science | 11252-20 | |
| Stimulateur électrique | Instruments Herbe | Model S4 | |
| Oscilloscope | Agilent | Modèle 54621A | |
| Monitor Audio | Instruments Herbe | Modèle AM8B | |
| Tireur | Sutter Instruments | Modèle P-97 | |
| Ciseaux Vannas une | Instruments de précision du monde | 14003 | |
| Micro Ciseaux b | Ted Pella | 1347 | |
| Dumont AA forceps c | Outils Fine Science | 11210-20 | |
| Nanoinject System II | Drummond scientifique | 3-000-204 | |
| Pipettes en verre | Drummond scientifique | 3-000-203-G / X | |
| Pédale | Drummond scientifique | 3-000-026 | |
| Huile minérale | Sigma-Aldrich | M3516 | |
| DiI | Invitrogen | D-383 | |
| N, N-diméthylformamide | Sigma | D4551 |
Références
- Huberman, A. D., Feller, M. B., Chapman, B. Mechanisms underlying development of visual maps and receptive fields. Annu Rev Neurosci. 31, 479-509 (2008).
- McLaughlin, T., Torborg, C. L., Feller, M. B., O'Leary, D. D. Retinotopic map refinement requires spontaneous retinal waves during a brief critical period of development. Neuron. 40, 1147-1160 (2003).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinogeniculate and retinocollicular projections in the mouse. J Comp Neurol. 230, 552-575 (1984).
- Jaubert-Miazza, L. Structural and functional composition of the developing retinogeniculate pathway in the mouse. Vis Neurosci. 22, 661-676 (2005).
- Garcia-Frigola, C., Carreres, M. I., Vegar, C., Herrera, E. Gene delivery into mouse retinal ganglion cells by in utero electroporation. BMC Dev Biol. 7, 103-103 (2007).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. , (2009).
- Ishikawa, H. Effect of GDNF gene transfer into axotomized retinal ganglion cells using in vivo electroporation with a contact lens-type electrode. Gene Ther. 12, 289-298 (2005).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J Vis Exp. , (2008).
- Ruthazer, E. S., Haas, K., Javaherian, A., Jensen, K., Sin, W. C., Cline, H. T., Yuste, R., Konnerth, A. In vivo time- lapse imaging of neuronal development. Imaging in Neuroscience and Development: A Laboratory Manual. , 191-204 .
- Kachi, S., Oshima, Y., Esumi, N., Kachi, M., Rogers, B., Zack, D. J., Campochiaro, P. A. Nonviral ocular gene transfer. Gene Ther. 12, 843-851 (2005).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156, 394-406 (1999).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- Plas, D. T. morphogenetic proteins, eye patterning, and retinocollicular map formation in the mouse. J Neurosci. 28, 7057-7067 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon