Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération de cellules souches neurales à partir de tissus humains mis au rebut corticale fœtale
Dans cet article
Résumé
Une méthode simple et fiable sur l'isolement et la culture des cellules souches neurales à partir des tissus humains jetés corticale du foetus est décrite. Cultures dérivées de humain connu des troubles neurologiques peuvent être utilisés pour la caractérisation des processus cellulaires et pathologiques moléculaires, ainsi que de fournir une plateforme pour évaluer l'efficacité pharmacologique.
Résumé
Les cellules souches neurales (NSC) résident le long de la zone ventriculaire neuroépithélium lors du développement de la plaque corticale. Ces premiers ancêtres de finalement donner naissance à des progéniteurs intermédiaires et plus tard, les divers sous-types de cellules neuronales et gliales qui forment le cortex cérébral. La capacité de générer et de développer NSCs humaine (ce qu'on appelle neurosphères) de tissus fœtaux jetés normale fournit un moyen avec lequel étudier directement les aspects fonctionnels de la normale du développement humain NSC 1-5. Cette approche peut également être dirigée vers la génération de NSC à partir connu des troubles neurologiques, procurant ainsi l'occasion d'identifier les processus pathologiques qui altèrent la prolifération progénitrices, la migration et la différenciation 6-9. Nous nous sommes concentrés sur l'identification des mécanismes pathologiques chez l'homme NSCs syndrome de Down qui pourraient contribuer à l'accélération de phénotype de la maladie d'Alzheimer 10,11. Ni in vivo, ni dans les modèles murins in vitro peut reproduire le répertoire de gènes identiques situés sur le chromosome 21 humain.
Ici, nous utilisons une méthode simple et fiable pour isoler le syndrome de Down NSCs d'humains avortés cortex fœtal et les faire grandir dans la culture. La méthodologie fournit des aspects spécifiques de la récolte des tissus, la dissection des repères anatomiques limitées, tri cellulaire, de placage et repiquage du CNS humaine. Nous fournissons également des protocoles de base pour induire la différenciation des NSCs humains en sous-types de cellules plus sélective.
Protocole
1. Préparation des solutions et matériaux pour la dissection et l'entretien de la culture de cellules souches neurales
- Préparer 100ml moyennes dissection (KNOCKOUT DMEM/F12, Invitogen) à l'avance et réfrigérer.
- Prepare100 milieu de culture ml (Stem Pro NSC GDF, Invitrogen) et conserver à 37 ° C dans un bain d'eau.
- Préparer la cellule de congélation moyenne (10% KNOCKOUT DMEM/F12 FBS + 5% DMSO) pour la cryoconservation des cellules à long terme.
- Si désiré, préparer paraformaldéhyde à 4% (PFA) pour la fixation des tissus.
- Stérile, pinces et les lames de bistouri autoclave avec des poignées sont utilisés pour la dissection.
- Mettez de côté un pistolet pipette, 10 ml pipettes de transfert, et 40 tamis cellulaire uM (BD Falcon 352 340) pour la dissociation.
- Mettez de côté quelques 10 cm de boîtes de culture (BD) pour la dissection, 50 tubes à centrifuger ml (BD) pour la dissociation, des tubes de 1,5 ml pour centrifugeuse de stockage des tissus et des coupes congelées (BD) pour les cellules de congélation.
2. Isoler les cellules souches neurales du cerveau fœtal humain
- La récolte des tissus viables immédiatement après la résiliation du fœtus est essentielle à la réussite de la procédure. Pour des interventions électives, le calendrier d'obtenir des échantillons peuvent être organisées à l'avance afin de minimiser le temps après la mort du fœtus. Les produits de conception sont récoltés dans les 2 heures après la procédure, mais, idéalement, peut être réalisé sur les procédures électives dans des minutes. Les tissus fœtaux sont souvent fragmentées. Cependant, en général une partie importante du cerveau reste intact pour une identification visuelle. Limites d'âge gestationnel (AG) sont déterminés par la loi statutaire, mais ont été effectuées en utilisant ce protocole entre 18-22 semaines AG.
- Cerveau du fœtus est placé dans une boîte de 10 ml de Petri contenant glacée KNOCKOUT DMEM/F12 solution. Identifier les différentes parties du cortex par des repères anatomiques. Limites pour les cortex frontal et pariéto-occipitale sont orientés par l'intersection de l'extrapolation sillon central et la scissure de Sylvius. Disséquer les tissus du cortex frontal antérieur à le sillon central et le long de la frontière de la fissure sylvienne avec les lames chirurgicales, en s'assurant de garder le ventricule intact et en bon état.
- Retirez tout le sang résiduel et les méninges du bloc séparé du cortex frontal. Si l'échantillon est de qualité suffisante, il est idéal pour disséquer le bloc en plusieurs petits échantillons à des fins diverses: articles (fixés dans du paraformaldéhyde 4%, PFA) et protéine / ARNm dosages (rapide gelés dans -80 ° C).
- Transfert du bloc du cerveau sélectionnés dans un tube à centrifuger de 50 ml, et ajouter glacée KNOCKOUT DMEM/F12 solution à environ 3 fois le volume du tissu. Doucement dissocient le tissu par pipetage mécanique avec une pipette de 10 ml, transférer jusqu'à ce que tous les tissus est fragmenté (en général 20-30 fois), puis filtrer les cellules à travers une cellule de 40 uM crépine (BD Falcon 352 340) pour obtenir seule ou presque seule cellule suspension.
- Centrifuger la suspension de cellules à 2000 rpm et la température ambiante pendant 5 min, resuspendre le culot cellulaire dans 10 ml du milieu de culture frais chaud (Stem Pro NSC AFD), et compter le nombre de cellules avec un hémocytomètre.
- Ajouter 5 ml de milieu de culture chaud dans tous les 25 cm de flacons de culture 2, et le transfert 2X10 6 cellules pour chaque ballon. Les cultures sont maintenues dans un 37 ° C / 5% de CO 2 incubateur pour 1 semaine avant l'analyse. Changer la moitié de la moyenne une fois par semaine pour des cultures plus ou expériences.
3. Manipulaton des cellules souches neurales pour une caractérisation plus poussée ou d'expérimentations
- Neurosphères forment habituellement dans les 1 à 2 semaines selon les conditions de culture recommandée avec un diamètre allant NSC entre 200 et 400 um. Neurosphères à ce stade peut être dissociée de 0,2 g / L d'EDTA en calcium et en magnésium libre milieu de Hanks (Hanks) à 37 ° C pendant 15 min afin d'obtenir des cellules individuelles. Suspension de cellules sont filées à 2000 rpm, rincés dans l'eau douce Hanks, et réétalées en milieu de culture chaud pour subculture.
- Pour initier la différenciation, les cellules dissociées sont étalées sur des lamelles de 1 poly-D-lysine/laminin revêtement à une densité de 1x10 5 cellules par lamelle (24mmX24mm). Différenciation des oligodendrocytes est réalisé par le maintien des cellules en KNOCKOUT DMEM/F12 (Invitrogen, Main, MD) 2% B27 (50X, Invitrogen, Main, MD) 10 ng / ml de bFGF 100 ng / ml SHH + 10ng/ml PDGF-AA pour deux jours, puis passer dans le même milieu sans facteurs de croissance pour un autre 5 jours. Différenciation neuronale est réalisée par des cellules maintien en KNOCKOUT DMEM/F12 2% B27 (50X) pendant 7 jours. Différenciation astrocytaire est fait par culture de cellules de KNOCKOUT DMEM/F12 1% de FBS pendant une semaine.
- La transfection de cellules souches neurales à des gènes peut être fait avec des cellules dissociées des neurosphères préformés. Ici, nous avons montré les cellules souches neurales transfectées avec EGFP-C1 par électroporation. L'électroporation de EGFP-C1 construction a été faite en utilisant AMAXA Kits Nucleofector des cellules souches neurales de souris (VPG-1004) avec AMAXA Nucleofector périphérique (Lonza AAD-1001), suite à l'instruction de l'entreprise. En bref, 5 ug d'ADN avec 1 x 10 6 cellules ont été mélangés avec 100 ul milieu de transfection, et après l'électroporation d'impulsion, les cellules ont été remises en suspension dans les cellules souches neurales maintenir moyennes pour la culture d'autres. La différenciation des cellules transfectées ont été traitées avec la dissociation du jour neurosphères 3-4 après l'électroporation, suivant les mêmes procédures décrites dans l'étape 3.2.
4. La congélation des cellules souches neurales et les subcultures
- Suspensions cellulaires dissociées sont centrifugés et remis en suspension dans un milieu de congélation avec une concentration de 1x10 7 cellules / flacon / ml. Lentement geler les cellules de -20 ° C, -80 ° C puis transfert à l'azote liquide pour stockage de longue durée.
- Les cellules sont décongelées rapidement à 37 ° C bain-marie et remis en suspension dans réchauffé DMEM/F12 10% de sérum pour un lavage, centrifugé pour éliminer le milieu de congélation, et remis en suspension dans le milieu de culture réchauffé.
5. Les résultats représentatifs:
Les cellules souches neurales à partir d'un fœtus normal à 18 semaines d'âge gestationnel ont été cultivés suivant les méthodes décrites et neurosphères peuvent être observés après une semaine avec, bordures lisses et de taille assez homogène (figure 2a). Ces neurosphères peuvent être transfectées avec EGFP-C1 ou d'autres constructions et suivis en microscopie à fluorescence (Fig.2b,). Fondée neurosphères ont ensuite été dissociées avec EDTA et plaqués en cellules dispersées sur des lamelles de revêtement. Cellules différenciées selon les protocoles respectifs ont été fixés avec parafamaldehyde 4%, et colorés avec des marqueurs différents types cellulaires spécifiques. Multipotentiality est observée avec l'expression des marqueurs indicatifs de neurones (Fig2C, D, la rhodamine) astrocytes (Fig2E, F, la rhodamine) et des oligodendrocytes (Fig2G, H, la rhodamine). Les cellules pas subi l'électroporation de EGFP ont également été différenciées en types de cellules différentes et colorées avec des marqueurs de cellules spécifiques différentes. Multipotentiality est observée avec l'expression des marqueurs indicatifs de neurones (Fig3A, B, fluorescéine) astrocytes (Fig3C, la rhodamine et Fig3D, fluorescéine) et des oligodendrocytes (Fig3E, F, la rhodamine).
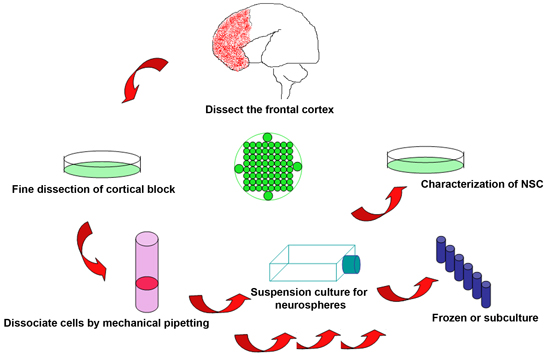
Figure 1. Schéma de la procédure expérimentale pour isoler des cellules souches neurales du cerveau du fœtus humains jetés

Figure 2. Indifférenciées et différenciées des cellules neurales humaines propagés in vitro. (A) neurosphères sont présentés en microscopie à contraste de phase montrent lisses, rondes et des frontières croissance rapide après culture pendant plus de 1 semaine. (B) Introduction de différents plasmides et les constructions peuvent être atteints grâce à la transfection. Trois jours après l'EGFP-C1 transfection, les cellules multiples montrent l'expression de la protéine fluorescente verte comme on le voit dans immunomarquage fluorescéine et de microscopie à fluorescence. EGFP-C1 neurosphères transfectées sont dissociés et différencié dans des conditions différentes dans les neurones (C, D), les astrocytes (E, F) et des oligodendrocytes (G, H) et vu sous la fluorescence rhodamine. Parallèlement, des cellules transfectées EGFP positifs sont affichés sous la fluorescéine fluorescence. Les cellules transfectées (têtes de flèche blanche) sont indiscernables de cellules non transfectées (flèches blanches). Les noyaux cellulaires sont colorés avec Hoechst33342. Barres d'échelle sont de 200 um pour A, 100 um pour B et 25 um pour CH.
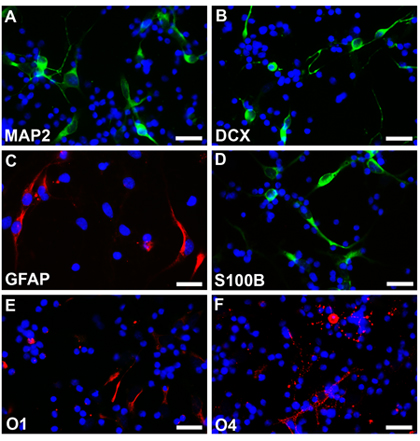
Figure 3. Neurosphères sans transfection sont dissociés et différencié dans des conditions différentes dans les neurones (A, B, fluorescéine), les astrocytes (C, la rhodamine, D, fluorescéine) et des oligodendrocytes (E, F, la rhodamine). Les noyaux cellulaires sont colorés avec Hoechst33342. Barres d'échelle sont de 25 um pour AF.
Access restricted. Please log in or start a trial to view this content.
Discussion
Il existe différentes approches envers les tissus de culture frais et la production de lignées cellulaires humaines. Historiquement, les tissus frais a été récolté et mis en culture immédiatement pour générer divers types de cellules dans le système nerveux central. Cette approche est toutefois clairement limité par le nombre d'échantillons qui peuvent être obtenus, qui dans le cas des échantillons humains, est généralement assez faible. Étant donné le degré minimal de la manipulation, fraîchemen...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu en partie par le National Institutes of Health: HD054347 et NS063997-01 à VLS. Ce travail a également été soutenu en partie par le Fonds Empire State de cellules souches par le ministère de l'État de New York contrat Santé # C024324 au VLS. Les opinions exprimées ici sont uniquement celles de l'auteur et ne reflètent pas nécessairement celles du Conseil du Empire State de cellules souches, le New York State Department of Health, ou l'Etat de New York. VLS est un Doris Duke Clinical Scientist Lauréat du Prix du développement. Nous remercions également le professeur Timothy Vartanian pour son don de l'anti-O1, anti-O4 anticorps.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Milieu de dissociation |
| Tige Pro NSC GDF | Invitrogen | A10509-01 | Le milieu de culture |
| Sérum de veau fœtal | Invitrogen | 10091-148 | Moyennes congelés |
| Hanks solution (-Ca 2 +,-Mg 2 +) | Invitrogen | 14175-095 | Milieu de dissociation |
| DMSO | Sigma-Aldrich | D2650 | Moyennes congelés |
| EDTA | Sigma-Aldrich | 431788 | Milieu de dissociation |
| Paraformaldéhyde | Sigma-Aldrich | 158127 | Solution de fixation |
| bFGF | R & D | 234-FSE | Milieu de différenciation |
| SHH | R & D | 1845-SH | Milieu de différenciation |
| PDGF-AA | R & D | 221-AA | Milieu de différenciation |
| B27 | Invitrogen | 17504-044 | Milieu de différenciation |
| De souris anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| Lapin anti-DCX | Signalisation cellulaire | 4604s | 1:200 |
| Lapin anti-GFAP | DAKO | Z0334 | 1:200 |
| Lapin anti-S100B | DAKO | Z0311 | 1:200 |
| Lapin anti-O1 | dons de professeur Timothy Vartanian * | 01:50 | |
| Lapin anti-O4 | Cadeaux du professeur Timothy Vartanian * | 01:50 | |
| Tamis cellulaire 40μm | BD Falcon | 352340 |
* Timothy Vartanian, MD, Ph.D., Département de neurologie et de neuroscience, Weill Cornell Medical College, New York, USA
Références
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon