Method Article
Détermination des espèces d'oxygène Potentiel membrane mitochondriale et réactive dans les neurones corticaux de rat en direct
Dans cet article
Résumé
Nous démontrons l'application de l'indicateur de fluorescence, TMRM, dans les neurones corticaux de déterminer les changements relatifs d'intensité de fluorescence TMRM avant et après application d'un stimulus spécifique. Nous montrons aussi l'application de la fluorescence de la sonde H 2 DCF-DA pour évaluer le niveau relatif des espèces réactives de l'oxygène dans les neurones corticaux.
Résumé
Potentiel de membrane mitochondriale (ΔΨm) est essentiel pour maintenir la fonction physiologique de la chaîne respiratoire pour produire l'ATP. Une perte importante de ΔΨm rend les cellules épuisées d'énergie avec la mort subséquente. Espèces réactives de l'oxygène (ERO) sont importantes molécules de signalisation, mais leur accumulation dans des conditions pathologiques conduit au stress oxydatif. Les deux principales sources de ROS dans les cellules sont des toxines environnementales et le processus de phosphorylation oxydative. Dysfonction mitochondriale et le stress oxydatif ont été impliqués dans la physiopathologie de nombreuses maladies et, par conséquent, la capacité de déterminer ΔΨm et ROS peuvent fournir des indices importants sur l'état physiologique de la cellule et la fonction des mitochondries.
Plusieurs sondes fluorescentes (Rhodamine 123, TMRM, TMRE, JC-1) peut être utilisée pour déterminer Δψm dans une variété de types de cellules, et de nombreux indicateurs de fluorescence (Dihydroethidium, dihydrorhodamine 123, H 2 DCF-DA) peut être utilisée pour déterminer les ROS . Presque toutes les sondes de fluorescence disponibles utilisés pour évaluer ΔΨm ou ROS sont une seule longueur d'onde des indicateurs, qui augmentent ou diminuent leur intensité de fluorescence proportionnelle à un stimulus qui augmente ou diminue les niveaux de ΔΨm ou ROS. Ainsi, il est impératif de mesurer l'intensité de fluorescence de ces sondes au niveau basal et après l'application d'un stimulus spécifique. Cela permet de déterminer le pourcentage de changement dans l'intensité de fluorescence entre le niveau de référence et un stimulant. Ce changement dans l'intensité de fluorescence reflète le changement dans les niveaux relatifs de ΔΨm ou ROS. Dans cette vidéo, nous démontrons comment appliquer l'indicateur de fluorescence, TMRM, chez le rat neurones corticaux de déterminer le pourcentage de variation de l'intensité de fluorescence TMRM entre le niveau de base et après l'application FCCP, un découplant mitochondrial. Les niveaux inférieurs de la fluorescence TMRM résultant du traitement FCCP refléter la dépolarisation du potentiel de membrane mitochondriale. Nous montrons aussi comment appliquer la fluorescence de sonde H 2 DCF-DA pour évaluer le niveau de ROS dans des neurones corticaux, d'abord au départ et puis après application de H 2 O 2. Ce protocole (avec des modifications mineures) peuvent être également utilisés pour déterminer les changements dans ΔΨm et ROS dans différents types cellulaires et dans les neurones isolés à partir d'autres régions cérébrales.
Protocole
1. La culture cellulaire
- Les neurones corticaux sont isolées et cultivées en utilisant des techniques décrites précédemment et étalées sur des boîtes de culture avec un fond de verre (MatTek Corporation, Ashland, MA) recouvertes de poly-D-lysine et de la laminine 1.
2. Préparer les solutions mères pour les sondes fluorescentes TMRM et H 2 DCF-DA
- Préparer une solution stock de 10 mM de TMRM en dissolvant 5,0 mg de TMRM dans 1 ml de diméthylsulfoxyde anhydre. Vortex c'est pendant 1 min. Ensuite, faire des aliquots et de les stocker à -20 ° C, protéger de la lumière, et l'utiliser dans un mois.
- Ensuite, préparer une solution stock de 10 mM de H 2 DCF-DA en dissolvant 4,87 mg de H 2 DCF-DA dans 1 ml de DMSO anhydre. De même, il vortex pendant 1 min. Ensuite, faire des aliquots et de les stocker à -20 ° C, protéger de la lumière, et l'utiliser dans une semaine.
3. Chargement des neurones de rat corticale avec TMRM et H 2 DCF-DA
TMRM est un potentiométrique, les cellules perméables indicateur fluorescent qui s'accumule dans l'intérieur, fortement chargées négativement des mitochondries. Il est important d'utiliser les faibles concentrations (10-50 nm) des TMRM pour éviter l'auto-extinction de TMRM mitochondriale. Ensuite, le signal de fluorescence de TMRM peuvent être directement liés à la co-ΔΨm à travers la membrane mitochondriale interne. Une perte de ΔΨm provoque une fuite de TMRM des mitochondries entraînant une perte d'intensité de fluorescence. H 2 DCF-DA est la cellule-perméable sonde converti en signal DCF-DA par des estérases intracellulaires, et ses résultats d'oxydation dans DCF fluorescente. La concentration finale de H 2 DCF-DA varie entre 2-10 uM et il devrait être testé empiriquement dans les neurones issus de différentes régions du cerveau car les concentrations de chargement élevée peut entraîner la saturation du DCF de fluorescence, même en l'absence de H 2 O 2. La présence de tout oxydant endogène ou exogène (par exemple, l'hydrogène hypoazotique oxyde) va augmenter DFC de fluorescence d'intensité. Ci-dessous, nous fournissons un protocole pour le chargement de neurones corticaux de rat avec TMRM et H 2 DCF-DA.
- Pour charger les neurones corticaux de rat avec TMRM, d'abord, lavez les neurones cultivés à 3 reprises avec du tampon de Tyrode (Superposition de texte: la tuberculose: 145 mM NaCl, 5 mM de KCl, 10 mM de glucose, 1,5 mM de CaCl2, MgCl2 1 mM, et 10 mM HEPES; ajuster le pH à 7,4 avec NaOH). Ensuite, préparez 20 nM de TMRM en diluant le stock de 10 mM TMRM 1 / 1000 fois dans la tuberculose, puis ajouter 2 pi de TMRM dilué par 1 ml de la tuberculose. Incuber les neurones avec TMRM pendant 45 min dans le noir à température ambiante. Après 45 minutes, monter la boîte de culture sur la scène du microscope et de commencer l'imagerie.
- Pour charger les neurones corticaux de rat avec du H 2 DCF-DA, laver les neurones cultivés 3 fois avec la tuberculose. Ensuite, préparez 2 uM de H 2 DCF-DA en diluant le 10 mM H 2 DCF-DA stock de 1 / 10 fois dans la tuberculose, puis ajouter 2 pi de dilution de H 2 DCF-DA pour 1 ml de la tuberculose. Puis, incuber les neurones avec du H 2 DCF-DA pendant 45 min dans le noir à température ambiante. Après 45 minutes, laver les neurones 4 fois avec la tuberculose pour enlever l'excès indicateur fluorescent, avant d'obtenir des images.
4. En direct d'imagerie des neurones incubées avec TMRM pour déterminer ΔΨm
- Pour effectuer l'imagerie en direct de neurones incubées avec TMRM, microscopie confocale à balayage laser (Superposition de texte: LSM 510, objectif Carl Zeiss Inc), avec l'application de vivre des séries chronologiques de programme, est utilisé. Appliquer à faible résolution et atténué la puissance laser (Superposition de texte: basse résolution: 256 x 256; puissance du laser: 1%) pour minimiser le temps nécessaire pour obtenir des images et d'éviter de photoblanchiment.
- . Ensuite, régler la netteté de l'neurones montés chargé avec TMRM utilisant la lumière réfléchie. Examiner la fluorescence TMRM par illumination à 514 nm et la détection à 570 nm. Réglez le gain de détection d'une caméra juste en dessous du niveau de saturation.
- Une fois tous les paramètres qui incluent la résolution, la puissance du laser, le gain de détection d'une caméra, et time-lapse d'intervalle pour obtenir des images sont définies, ne pas modifier ces paramètres entre les expériences. Ensuite, modifiez le champ. Commencer à recueillir des images.
- Pour tester des changements dans ΔΨm, des stimuli tels que 1 uM de FCCP ou 2 ug / ml de oligomycine, peut être appliquée, ce qui va considérablement dépolariser ou hyperpolariser le potentiel de membrane mitochondriale, respectivement. Ces changements seront reflétés par une diminution de l'intensité de fluorescence TMRM par rapport à l'intensité de la fluorescence de base dans le cas du FCCP, ou une augmentation de TMRM intensité de fluorescence dans le cas de oligomycine.
5. Imagerie en direct de neurones incubées avec H 2 DCF-DA ROS pour déterminer
- Pour effectuer l'imagerie en direct de neurones incubées avec H 2 DCF-DA, d'abord, monter la boîte de culture sur la scène d'un microscope. Ajustez la mise au point des cellules-nousING lumière réfléchie. Examinez DCF de fluorescence par excitation à 488 nm et émission à 515 nm.
- Ensuite, régler la puissance du laser à 5-7%, le gain du détecteur, et la résolution de 256 x 256. Ne pas modifier ces paramètres entre les expériences. Ensuite, définissez la fréquence pour obtenir des images en direct en utilisant le programme de séries chronologiques.
- Sélectionner un domaine nouveau et commencer à acquérir des images. Pour détecter les changements dans les niveaux de ROS, traiter avec des cellules 100-200 pm de H 2 O 2. Cela sera reflété par une augmentation de l'intensité de fluorescence DCF par rapport au niveau de base.
6. L'analyse des données
- Utilisez région d'intérêt (Superposition de texte: RCI) l'outil à partir du programme LSM pour sélectionner les domaines. Ensuite, mesurer la TMRM ou ROS intensités de fluorescence. Sélectionnez ROIs de régions mitochondrial ou ROIs du corps cellulaire dans les cellules de toute imagée pour mesurer les intensités de fluorescence de TMRM ou ROS, respectivement.
- Calculer les intensités moyennes de fluorescence de tous les ROIs de chaque cellule pour TMRM ou d'organismes à cellules entières pour toutes les cellules imagé pour ROS pour chaque point de temps. Sélectionnez les régions à côté de la cellules pour calculer l'intensité de fluorescence de fond. Prenez plusieurs mesures et de calculer l'intensité de fond moyenne.
- Soustraire l'intensité de fluorescence de fond moyen de la moyenne des intensités de fluorescence de ROIs dans chaque cellule de chaque point de temps en utilisant Microsoft Excel. Après soustraction de l'intensité de fond, de normaliser l'intensité de fluorescence TMRM ou DCF à la fluorescence de base en utilisant cette formule (Superposition de texte: AF = FF o / o F x 100, où F = intensité de fluorescence à aucun moment, Fo = base de fluorescence). Ensuite, utilisez le programme tracé Sigma pour générer le graphique montrant les changements d'intensité de fluorescence au cours du temps.
7. Les résultats représentatifs
La figure 1A montre une image de fluorescence des neurones corticaux de rat incubées avec TMRM. Ajout de FCCP, un découplant mitochondrial, conduit à une dépolarisation mitochondriale et une perte d'intensité de fluorescence TMRM (Fig. 1B). Le niveau de fluorescence de base TMRM reste stable avant l'addition du FCCP (le premier 350 sec;. Fig 1C). L'analyse quantitative des changements de fluorescence TMRM au fil du temps montre une diminution significative de la fluorescence après ajout de TMRM FCCP (Fig. 1C).
La figure 1D montre l'image de fluorescence des neurones corticaux de rats chargé avec DCF. L'addition de H 2 O 2 résultats dans DCF augmenté l'intensité de fluorescence dans les corps cellulaires (figure 1E). La base de fluorescence DCF niveau est inchangé (le premier 120 sec) avant l'application de H 2 O 2. Time-lapse mesures de fluorescence montrent DCF ses niveaux stables, ce qui augmente après H 2 O 2 de traitement (Fig. 1F).
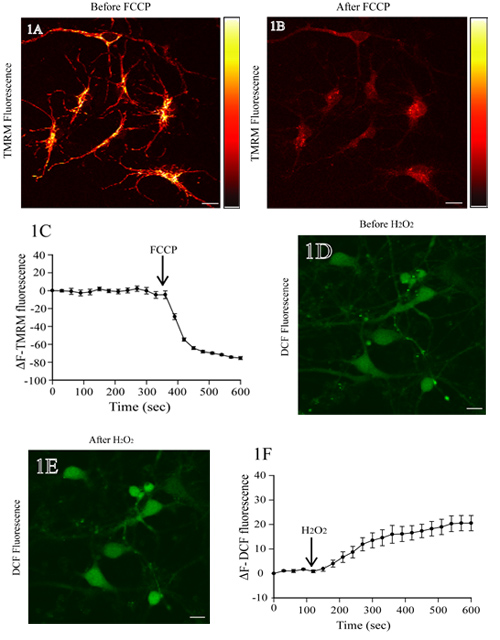
Figure 1. Évaluation du potentiel de membrane mitochondriale et les niveaux de ROS dans des neurones corticaux rat vivant. (A) représentant l'image de fluorescence des neurones corticaux chargés avec TMRM. Après la numérisation de la base TMRM de fluorescence, les neurones ont été traités avec le FCCP protonophore (1 uM). A droite se trouve une barre d'intensité de fluorescence pseudo TMRM vif maximal représentant jaune et noir et une intensité minimale, respectivement. La perte de fluorescence TMRM des régions mitochondrial indique l'effondrement du FCCP ΔΨm sur le traitement (tableau B). La représentation quantitative des changements dans l'intensité de fluorescence TMRM à différents moments avant et après traitement FCCP est montré dans le panneau C (D) image de fluorescence des neurones corticaux de rat chargé avec H2DCF-DA. Après détermination de la base DCF de fluorescence, les cellules ont été traitées avec 200 uM H 2 O 2, et le changement de DCF de fluorescence a été évaluée. Une augmentation de la fluorescence DCF reflète l'augmentation des niveaux de ROS lors de H 2 O 2 de traitement (E). L'analyse quantitative des changements dans la fluorescence DCF, avant et après H 2 O 2 de traitement, est montré dans le panneau de F. Échelle bar = 10 um
Video.7.1 - labmedia 2704_Joshi.avi
Direct imagerie cellulaire des neurones corticaux dans TMRM avant et après addition FCCP utilisant l'objectif 40X. L'intensité pseudo montre un maximum (jaune vif, avant l'addition FCCP) et a diminué (de couleur rouge, après addition FCCP) TMRM intensité de fluorescence après ajout FCCP. Cliquez ici pour voir la vidéo
Vidéo. 7.5 - labmedia 2704_Joshi.avi
Direct imagerie cellulaire du DCF dans les neurones corticaux, avant et après H 2 O 2 en utilisant plus objectif 40X. La base de fluorescence a DCF lumière de couleur verte dans les corps cellulaires et H2O2 ajout augmente le DCF l'intensité de fluorescence à la couleur vert vif. Cliquez ici pour voir la vidéo
Discussion
Nous avons présenté une procédure étape par étape décrivant comment déterminer ΔΨm et ROS dans les neurones corticaux de rat en utilisant les indicateurs fluorescents TMRM et H 2 DCF-DA, respectivement. Pour d'autres types cellulaires, il est important de déterminer empiriquement la concentration finale et le temps de chargement pour TMRM ou H 2 DCF-DA. En général, la gamme des concentrations de TMRM 20-200 nm, et le temps d'incubation des cellules avec des TMRM varie de 20 à 60 min. La concentration finale de H 2 DCF-DA varie de 2 à 10 uM, et l'incubation des cellules dans une solution de chargement contenant cet indicateur varie de 30-45 min.
Il est important pour optimiser la puissance du laser et la vitesse de balayage de prendre les images pour éviter à la fois photo-toxicité pour les cellules et les changements dans l'intensité de fluorescence (par exemple vacillante de TMRM fluorescence) en l'absence de tout stimulus. Les paramètres optimisés optiques devrait se traduire par un signal de fluorescence qui n'est pas plus ou moins saturés (seuil) en l'absence de stimulus. Les conditions optimales pour recueillir les images à partir d'un champ sélectionné à un laser de puissance particulière et une vitesse de balayage sont obtenus lorsque il n'ya pas de changements dans l'intensité de fluorescence de la sonde en l'absence de tout stimulus pendant 10-15 min d'imagerie en temps réel.
Autres sondes de fluorescence pour déterminer ΔΨm comprennent la rhodamine 123 et tétra méthyl ester éthylique de la rhodamine (TMRE). Cependant, ils ont été trouvés pour inhiber les processus respiratoires en 2 mitochondries isolées. Surtout, TMRM n'a aucun effet sur la respiration mitochondriale à de faibles concentrations 2 et a phototoxicité faible et photoblanchiment 3 par rapport à d'autres sondes. H 2 DCF-DA est un bon indicateur de ROS comme elle est bien conservée dans les cellules et reconnaît espèces oxydantes de plusieurs, tels que les peroxydes, oxydes super, et l'oxyde nitrique 4.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par le National Institutes of Health (K22NS050137 à JCB).
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Boîte de culture à fond de verre | MatTek Corporation | P35G-1.5-14-C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF-DA | Invitrogen | C400 | |
| NaCl | Sigma | S6191 | |
| KCl | Sigma | P3911 | |
| CaCl 2 • 2H 2 O | Sigma | C3306 | |
| MgCl 2 • 6H 2 O | Sigma | M2670 | |
| D-glucose | Sigma | G6152 | |
| HEPES | Invitrogen | 15630 |
Références
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon