Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Transplantation mammaires de cellules stromales et les cellules de carcinome chez les souris C57BL/6J
Dans cet article
Résumé
Dans ce rapport, nous démontrons un système pour isoler les cellules du donneur et de la culture de la glande mammaire de la souris, et la transplantation orthotopique ces cellules dans des souris bénéficiaires d'analyser stromales: interactions épithéliales pendant le développement de tumeurs mammaires.
Résumé
L'influence de cellules stromales, y compris les fibroblastes sur la progression de la tumeur mammaire a été bien documenté par l'utilisation de modèles de souris, en particulier grâce à la transplantation de cellules stromales et les cellules épithéliales de la glande mammaire de souris. Modèles de transplantation actuels impliquent souvent l'utilisation de la souris immunodéprimées en raison de la génétique de différentes origines cellules stromales et les cellules épithéliales. Matrices extracellulaires sont souvent utilisés pour intégrer les deux types cellulaires différents pour cohérentes interactions cellule-cellule, mais impliquent l'utilisation de Matrigel ou de collagène de queue de rat, qui sont des substrats immunogène. Le manque de cellules T fonctionnelles des souris immunodéprimées empêche une évaluation précise des cellules stromales sur la progression de la tumeur mammaire in vivo, avec des implications importantes sur le développement de médicaments et d'efficacité. Par ailleurs, les souris immunodéprimées sont coûteux, difficiles à reproduire et exigent des conditions de soins spéciaux. Pour surmonter ces obstacles, nous avons développé une approche de la transplantation orthotopique de cellules stromales et les cellules épithéliales des souris de la même bagage génétique pour induire la formation de tumeurs cohérente. Ce système implique la récolte normale, le carcinome fibroblastes associés, PyVmT cellules de carcinome mammaire et du collagène de souris C57BL/6J donateurs. Les cellules sont ensuite intégrés dans le collagène et transplantées dans les glandes mammaires inguinales des souris C57BL/6J femelles. La transplantation de cellules PyVmT seuls forment des tumeurs palpables greffe 30-40 jours après. Analyse Endpoint moins 60 jours indique que la co-transplantation avec des fibroblastes améliore la croissance des tumeurs mammaires par rapport aux cellules transplantées PyVmT seul. Alors que les cellules et la matrice de souris C57BL/6J ont été utilisées dans ces études, l'isolement de cellules et la matrice et l'approche de transplantation peuvent être appliquées sur des souris de différentes origines génétiques démontrant la polyvalence. En résumé, ce système peut être utilisé pour étudier les interactions moléculaires entre les cellules stromales et les cellules épithéliales, et surmonte les limitations critiques dans les modèles murins immunodéprimés.
Protocole
1. L'isolement et l'extraction de collagène donneur de souris C57BL/6J
- Sacrifice maturité normale des souris femelles C57BL/6J utilisant des méthodes approuvées IACUC.
- Récolter les queues et les tremper dans de l'éthanol à 70% pendant 45 minutes pour stériliser les tissus. Sécher les queues avec du papier absorbant, l'envelopper dans du papier d'aluminium. Stocker les queues de -20 ° C jusqu'à ce que nécessaire.
- Placer les queues dans un environnement stérile, comme une hotte à flux laminaire. Avec des ciseaux, diviser la peau à la base de la queue et de se décoller de la queue. Retirer 0,5 à 1 cm des deux extrémités de la queue et de diviser la queue reste en trois ou quatre morceaux. Disséquer les tendons de la queue et de séparer les tendons en fibres individuelles à l'aide d'un scalpel ou d'un rasoir.
- Transférer les fibres tendineuses dans un récipient stérile et laver avec de l'eau distillée stérile. Tendons Transfert de queue de souris 5-7 pour un tube conique de 50 ml contenant 35 ml stériles de l'eau désionisée contenant 50 unités / ml de pénicilline de pénicilline, 50 pg / ml de streptomycine et 250 ng / ml d'amphotéricine, et 0,034 N d'acide acétique dilué de une solution stock d'acide acétique glacial (17 N). Placez-le sur rocker à 4 ° C pendant une semaine pour en extraire le collagène.
- Isoler les débris dans une centrifugeuse de table en g 3000 pendant 15 minutes. Transférer le surnageant, environ 30 ml à deux tubes en polycarbonate adaptée pour le rotor Beckman 50,2 Ti et tournent à 35 000 g (environ 17 000 rpm) pendant 1 heure.
- Le volume du surnageant devra être réduite pour atteindre une concentration de 1-2 mg / ml. Transférer le surnageant dans une unité de 50 k Ultracel de filtration Amicon et de spin dans une centrifugeuse de table à 3000 rpm pendant 15 à 4 ° C. Transférer le filtrat dans un tube stérile conique et sauver. Répétez la centrifugation jusqu'à ce que le volume est réduit à 5-6 ml.
- Lire la concentration en protéines. Nous utilisons un standard de dosage de Bradford (Biorad), en utilisant les normes de BSA (Biorad) et des échantillons non dilués. Mesurer un échantillon de votre filtrat, comme contrôle négatif.
- En outre vérifier la pureté de l'extraction par la résolution d'un échantillon de collagène purifié sur un gel de polyacrylamide SDS 6%, 10 voies, 1,5 mm d'épaisseur de gel. Préparer 20 g d'échantillon dans 30 tampon 1x chargement ul SDS-PAGE contenant 63 mM Tris HCl 10% glycérol, SDS 2% bleu de bromophénol dans 0,0025% tubes Eppendorf de 1,5 ml. Préparer une quantité équivalente de protéines de collagène de type I de queue de rat comme un contrôle positif. En outre, de préparer un ensemble de normes de BSA à 2,5, 5, 10, 20 ug dilué dans du PBS et le tampon de chargement 1X. Faire bouillir les échantillons à 95 ° C pendant 5 minutes.
- Laissez les frais et les échantillons Micro centrifuger rapidement (vitesse maximale pendant 10 secondes) pour spin-down de la condensation.
- Charger les échantillons des échantillons avec un marqueur de poids moléculaire. Par exemple, la charge de la norme 5 ul de protéines Kaléidoscope Biorad. Électrophorèse à 150 volts pendant environ 1 heure ou jusqu'à ce que le front touche le fond.
- Retirer le gel et la tache dans le bleu de Coomassie tampon. Préparer ce tampon en mélangeant 2 g de bleu de Coomassie, 75 ml d'acide acétique glacial, 500 ml d'éthanol dans un volume total de 1000 ml contenant de l'eau déminéralisée. Préparez aussi la même quantité de mémoire tampon Décolorer en utilisant la recette, sauf, sans bleu de Coomassie réactif. Couvrir le gel avec un volume suffisant pour le bleu de Coomassie et le placer sur un rocker.
- Rocher doucement pendant 1 heure à température ambiante et décanter la tache. Remplacer la solution Décolorer quand il devient bleu foncé. Détenir le gel durant la nuit ou jusqu'à ce que les bandes individuelles sont résolues sur le gel. Repérez deux bandes de collagène (poids moléculaire = 90 kDa et 130 kDa) et la note de la force des bandes contre les normes et les contrôles. Image du gel en utilisant un système de gel doc, si nécessaire.
2. Isolement et culture de cellules du donneur de carcinome mammaire et les fibroblastes de souris C57BL/6J normal et PyVmT
- Sacrifice âge correspond femme normale ou PyVmT souris transgéniques après 10 semaines d'âge lorsque les tumeurs sont évidents et palpables dans PyVmT souris transgéniques en utilisant des méthodes approuvées IACUC.
- Exposer la souris sur le dos sur une surface plane et immobiliser les jambes à l'aide de ruban adhésif.
- Faire une incision en T renversé entre les mamelons de la glande mammaire thoraciques et inguinales et tirez le lambeau de peau pour exposer les glandes mammaires. Enlever les tissus mammaires et émincer en petits morceaux avec des ciseaux chirurgicaux.
- Préparer 100 ml d'un cocktail digestion enzymatique contenant: 200 mg de trypsine, la collagénase de 500 mg, 4 mg DNAse, 100.000 unités de hyaluronidase dans du PBS stérile et des antibiotiques durant la nuit sur la glace, puis pendant 3 h à 37 ° C.
- Ajouter 10 ml de PBS contenant 10% de sérum fœtal bovin (FBS) à chaque échantillon et la cellule de centrifugation le culot dans une centrifugeuse de table à 1500 rpm pendant 5 minutes à 4 ° C.
- Doucement aspirer le surnageant et remettre le culot cellulaire dans 5-7 ml de FBS% PBS/10. Répétez le spin et laver deux fois plus.
- Reprendre le culot cellulaire dans 10 ml de DMEM contenant 10% de FBS contenant 50 unités / ml de pénicilline, 50 pg / ml de streptomycine et 250 ng / ml d'amphotéricine sur les boîtes de 10 cm recouvert d'I. Pour le collagène de type plaques manteau avec du collagène, diluer le collagène 1 ml (à l'aide d'actions de 1,5 mg / ml) en 39 ml de 0,02 N d'acide acétique dilué dans l'eau distillée stérile ou du PBS. Pipeter 5 ml de collagène travaille solution sur des plaques de 10 cm. Incuber à température ambiante pendant un minimum de 10 minutes. Aspirer excès de collagène. Plaques Parafilm inutilisés et conserver à 4 ° C pendant une semaine.
- Changer les médias 2 - 3 fois par semaine. La digestion réussie de tissus sera caractérisée par la présence de foyers épithéliales entouré par la broche en forme de cellules fibroblastiques.
- Séparez les fibroblastes et les cellules épithéliales par tryspinization sélective. Aspirer les médias et laver les cellules avec du PBS fois. Pipeter 1 ml de 0,25% trypsin/0.54 mM EDTA sur les cellules et incuber à température ambiante. Les fibroblastes sont plus faiblement adhérentes que les cellules épithéliales. Vérifier décollement fibroblastes sous le microscope après 2 minutes, les cellules doivent être flottantes en suspension ou en arrondi tout en foyers épithéliales devrait toujours être collé à la surface.
- Frapper légèrement le plat pour desserrer les fibroblastes et doucement la pipette 10 ml de milieu contenant du sérum dans le plat pour enlever les fibroblastes.
- Déposer le support contenant les fibroblastes dans un tube de 15 ml conique et centrifuger comme décrit dans l'étape 5). Replate ces cellules sur revêtues de collagène boîtes de 10 cm et répétez le processus jusqu'à ce trypsination sélective des fibroblastes et des cellules épithéliales sont complètement séparés.
- Vérifier la pureté des cellules par immunofluorescence de marqueurs épithéliaux tels que CK14 et CK18 et des marqueurs fibroblastes tels que l'alpha actine musculaire lisse (α-SMA).
3. Immunofluorescence sur des cellules en culture
- Placez des lamelles de verre dans boîtes de 6 cm. Stériliser par exposition aux UV pendant 5 à 10 minutes dans une hotte à flux laminaire.
- Enduire la lamelle avec 1-2 ml de solution de travail collagène stock pour 10 minutes à température ambiante (TA). Aspirer l'excès.
- Trypsiniser et la plaque de 200 000 cellules épithéliales ou des fibroblastes par échantillon. Ajouter 3-5 ml de milieu complet et incuber pendant 24 heures.
- Aspirer les médias, se laver les cellules avec du PBS et fixer au méthanol froid, la glace à -20 ° C pendant 7 minutes.
- Laver les cellules deux fois avec du PBS pour éliminer l'éthanol, et de bloquer avec 1-2 ml de PBS contenant 1% de FBS pendant 1 heure à température ambiante.
- En utilisant une pince, retirer les lamelles et les placer dans un récipient peu profond recouvert de parafilm ou de surface hydrophobe autre.
- Diluer l'anticorps primaires suivants 1:100 dans une solution de blocage: l'actine anti-muscle lisse (α-SMA, l'anti-CK14 (basal marqueurs épithéliaux), anti-CK18 (luminal marqueurs épithéliaux).
- Pipeter 100 pi d'anticorps directement sur les lamelles pendant 1 heure à température ambiante. Incuber une lamelle séparée des cellules dans une solution de blocage; cet échantillon servira de contrôle anticorps secondaire.
- Aspirer anticorps et une pipette 1 ml de PBS directement sur la lamelle à laver. Aspirer et répéter 3-5 fois.
- Diluer l'anticorps secondaires suivantes en solution de blocage: anti-souris-Alexa 488 à 1:100, anti-souris biotinylé à 1: 500, anti-souris-alexa-568.
- Envelopper le contenant avec les lamelles dans du papier aluminium. Pipeter 100 pi d'anticorps secondaire approprié directement sur les lamelles: α-SMA avec anti-souris-Alexa 568, CK 14 coloration avec anti-souris biotinylé et CK18 avec anti-souris-Alexa 488. Couvrez le récipient pour protéger les échantillons provenant de la lumière visible.
- Aspirer anticorps et laver avec du PBS comme à l'étape 9). Laisser les échantillons dans du PBS, à l'exception des CK14 coloration.
- Diluer la streptavidine conjuguée à Alexa 568 1:500 dans du PBS. Incuber les échantillons colorés avec CK14 strepatividin-Alexa 568 pendant 30 minutes à température ambiante dans l'obscurité. Laver dans du PBS comme à l'étape 9)
- Diluer DAPI 1: 500 dans du PBS. Aspirer le PBS à partir des échantillons et les incuber avec DAPI pendant 10 minutes RT dans l'obscurité.
- Rincer les échantillons avec du PBS. Pipeter 100 pi d'Prolongez anti-fade réactif sur des lames de verre, tourner la lamelle sur de sorte que les cellules sont confrontées à la lame de verre. Inclinez la lamelle à un angle légèrement prendre contact avec les milieux de montage.
- Les échantillons d'image en utilisant un microscope à immunofluorescence. Conserver les échantillons dans l'obscurité pour protéger le signal d'immunofluorescence, qui durera environ 2 semaines.
4. Préparation des cellules de collagène embarqué pour le greffage
- Pour intégrer les cellules dans du collagène, il est nécessaire d'abaisser le pH du collagène pour atteindre la polymérisation en mélangeant du collagène avec une solution de réglage. Préparer la solution mise en en mélangeant 100 ml de solution Earl 10X saline équilibrée (EBSS) avec 2,45 g de NaHCO3, 7,5 ml de NaOH 1 M et 42,5 ml d'eau distillée stérile. En outre stériliser en utilisant un bouchon de bouteille 0,22 unité de microns filtre attaché à un flacon stérile.
- Mélanger le collagène (une concentration mg / ml) à la mise en solution à un 4 de départ: 1 ratio. Pour une greffe, mélanger 100 ul de collagène avec 25 ul de la mise en solution dans un tube Eppendorf. Brièvement au vortex ou une pipette de l'échantillon haut et bas pour le mélanger soigneusement.
- Ajouter collagène ou de la solution mise en incréments à 5-10 ul et bien mélanger jusqu'à ce que le colorant rouge de phénol dans les changements mélange à une lumière rose à la couleur orange, ce qui reflète un pH neutre. Une couleur jaune indique pH acide tandis rose foncé reflète pH basique. Gardez le mélange sur la glace pour empêcher la polymérisation.
- Retirez les fibroblastes et les cellules épithéliales de la plaque par trypsinisation. Premièrement, aspirer les médias et les laver avec 5 ml de PBS. Pipeter 1 ml de 0,25% trypsin/0.54 mM EDTA dans HBSS par plaque. Incuber les fibroblastes à température ambiante pendant 2-5 minutes. Incuber les cellules épithéliales à 37oC pendant 2-6 minutes. Appuyez sur le délicatement les plaques pour desserrer les cellules. Vérifier l'aide d'un détachement de la trypsine microscope.Quench par pipetage 9 ml de milieu complet sur la plaque et le transfert des cellules d'une solution stérile de 15 ml tube conique.
- Retirer 50 ul et de compter les cellules par hémocytomètre. Noter le volume total de cellules dans chaque tube (environ 10 ml).
- Pellet les cellules à 1500 rpm pendant 5 min à température ambiante. Aspirer le culot cellulaire et de remettre les cellules à une concentration de 100 000 cellules/100 ul. Par exemple, resuspendre 500 000 cellules dans un volume total de 500 pl de milieu complet.
- Mélanger 250 000 cellules stromales (250 pi) et 100 000 cellules tumorales (100 pi) dans un tube séparé. Microfuge 10 sec 1000 rpm, éliminer le surnageant par pipetage. Ajouter 50 ul de la solution de collagène ajusté pour les cellules. Pipet haut et bas pour disperser les cellules uniformément. Déposer le 50 ul dans une plaque de culture stérile 6 cm de tissu pour former une goutte circulaire. Incuber la greffe à 37 ° C pendant 10 minutes à se polymériser.
- Ajouter délicatement 5 ml de milieu complet dans la plaque en inclinant la plaque à un angle de pipetage et lentement les médias par un côté de la plaque. Inclinez la plaque autour jusqu'à ce que les médias couvrent la greffe.
- Incuber pendant 24 heures à 37 ° C. Transplant immédiatement.
5. La transplantation de cellules de collagène orthoptique intégrés dans des souris C57BL/6J
- Fabriquer une baguette de verre mince pour la chirurgie de transplantation. Chauffer une pipette Pasteur en verre à l'aide d'un brûleur Bunsen. En utilisant des pinces, étirer la fin de la pipette hors de 2-3 mm d'épaisseur. Laissez refroidir, et stériliser 70% d'éthanol.
- Stériliser les instruments chirurgicaux suivants à l'autoclave et l'éthanol à 70%: amende ciseaux chirurgicaux, émoussé ciseaux chirurgicaux, des forceps émoussé, une pince fine, des clips blessure, la plaie de base
- Anesthetize souris en utilisant avec 2-3% d'isoflurane utilisant une machine à l'isoflurane balayage. Le taux moyen d'écoulement O 2 utilisé est de 1 L / minute à travers le cône de nez.
- Posez la souris sur son dos et immobiliser les jambes avec du ruban adhésif amovible ou un autre. Enlever les cheveux avec épilateur chimiques tels que Nair. Stériliser l'abdomen avec du coton écouvillonnage alternativement entre 70% d'éthanol et de bétadine dans un mode en cible.
- Tenir une partie de la peau par la glande mammaire en utilisant une pince émoussée avec une seule main. Avec l'autre main, en utilisant émoussée ciseaux chirurgicaux pour faire une tête en bas T-incision entre le # 9 et # 10 ou # mamelons 4 et # 5 mamelons des glandes mammaires inguinales pour exposer les glandes mammaires.
- Faire une incision poche sous le ganglion lymphatique ou de l'artère mammaire avec des petits ciseaux à ressort chirurgicale.
- Retirez la greffe de collagène de la boîte de culture tissulaire en utilisant une pince. Retirer l'excès de liquide de la greffe de collagène par les tamponnant délicatement sur une lingette et stériles glisser la greffe de collagène complètement dans la poche en utilisant une baguette de verre mince.
- Suture du lambeau de peau à l'aide n ° 2 sutures absorbables intestinale ou d'agrafes plaie.
- Laissez la souris de récupérer dans la cage.
- Surveiller la souris deux fois par semaine au minimum, la palpation des tumeurs. Sacrifice de la souris lorsque les tumeurs atteignent 1 cm de diamètre. Récolte des tissus pour analyse.
6. Les résultats représentatifs:
L'isolement et l'extraction de collagène chez la souris C57BL/6J
Ces procédures ont été adaptées de 1. Extraction de protéine de collagène à partir des queues de souris 5-7 rendements d'environ 1-1,5 mg / ml dans un volume de 6 ml finale, ou 6 - 9 mg de protéine. Par coommassie tache, bandes correspondant à 90 kDa et 130 kDa sont détectées dans les ruelles chargées d'échantillons prélevés dans la queue de la souris, indiquant la présence de collagène de type I et pro-collagène, respectivement (figure 1).
Isolement et culture des cellules de carcinome mammaire et les fibroblastes de souris C57BL/6J normal et PyVmT.
Les procédures ont été adaptées à partir de 2. Cellules de carcinome PyVmT et les fibroblastes peuvent être distingués par des différences dans la morphologie cellulaire et l'expression de certaines épithéliales et mésenchymateuses MarKERS. Cellules de carcinome PyVmT sont identifiés par la forme pavées et co-exprimer CK18, un marqueur luminal épithélial et CK14, un marqueur basales épithéliales, mais pas d'exprimer α-SMA (figure 2). Fibroblastes mammaires sont plus grandes cellules de phénotype en forme de fuseau et d'exprimer des niveaux élevés de α-SMA mais n'expriment pas CK14 ou CK 18 (figure 2). Ces données indiquent de plus de 95% pour la pureté des cellules fibroblastes et les cellules épithéliales en utilisant les procédures décrites.
La transplantation de cellules de collagène orthoptique intégrés dans des souris C57BL/6J
Ces procédures ont été adaptées à partir de 3, 4. Transplantation souris receveuses sont sacrifiées lorsque les tumeurs dans les deux groupes expérimentaux atteindre 1,0 cm de diamètre, soit environ 60 jours. Alors que la transplantation de cellules PyVmT seuls les résultats dans les tumeurs palpables après 30 - 40 jours, atteignant une masse moyenne de 0,335 grammes de tumeurs moins 60 jours, co-transplantation de cellules de carcinome PyVmT avec des résultats fibroblastes mammaires dans une masse moyenne de 0,630 grammes de tumeurs, indiquant amélioration de la croissance tumorale par les fibroblastes (figure 3).
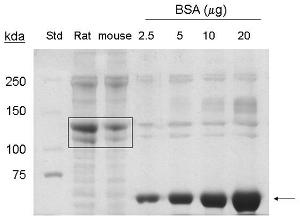
Figure 1. Coomassie analyse tache de collagène de type I d'extraction de la queue de la souris. BSA (~ 66 kDa) est indiqué par la flèche. Commerce de collagène de queue de rat (20 pg de protéine), et purifié collagène de queue de souris (20 pg de protéine) sont indiqués par boîte (~ 130 kDa, ~ 90 kDa protéines). Std = standard de poids moléculaire.
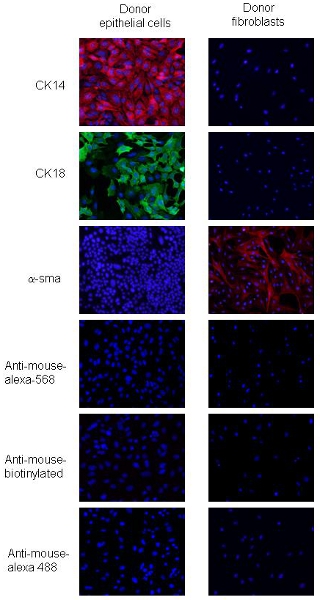
Figure 2. Immunofluorescence des cellules mammaires PyVmT carcinome donateurs et les fibroblastes. Panels A et B représentent PyVmT cellules de carcinome mammaire immunocolorés des anticorps anti-CK14 et CK18. Panneau c représente fibroblastes colorées avec des anticorps à la α-SMA. Les images de superposition avec DAPI à un grossissement de 20x.
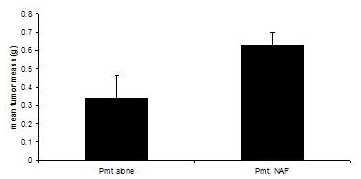
Figure 3. Mammaire développement de tumeurs chez des souris C57BL/6J dans la présence ou l'absence de fibroblastes. Tumeurs mammaires ont été récoltées à partir des souris transplantées avec des cellules de carcinome PyVmT en présence ou en absence de fibroblastes mammaires et pesés. Moyenne + erreur standard de la moyenne. N = 6 par groupe.
Discussion
La contribution fonctionnelle des fibroblastes dans la progression tumorale a été démontrée par des modèles de transplantation, dans lequel le carcinome fibroblastes associés co-transplantés avec bénignes mammaires des résultats des cellules épithéliales dans la croissance tumorale et l'invasivité accrue 5. Approches de transplantation conventionnelle ont impliqué l'utilisation de souris SCID ou nude à la co-transplantation de cellules stromales et épithéliales de différentes origines...
Déclarations de divulgation
Les expérimentations animales:
Expériences sur les animaux ont été effectuées en conformité avec les directives et les règlements énoncés par le comité IACUC à l'Université du Kansas Medical Center.
Remerciements
Ce projet a été financé par le NIH / NCI numéro de subvention R00 CA127357 et l'Université du Kansas cancer dotation Center.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Souris C57BL/6N | Harlan | N / A | |
| MMTV-PyVmT souris transgéniques | Laboratoires Jackson | 002374 | |
| Sérum de veau fœtal | Fisher | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| Pénicilline / streptomycine | Fisher | MT-30-001 | |
| amphotéricine | Fisher | BP2645-20 | |
| Amicon de filtration colonnes Ultracel 50k | Millipore | UFC905008 | |
| Tubes pour Beckman TI du rotor | Beckman | 355618 | |
| Collagène de queue de rat | Fisher | CB 40236 | |
| EBSS 10x | Sigma-Aldrich | E7510-100ML | |
| Trypsine 1X, 0,25% dans HBSS w / o de calcium et de magnésium | Fisher | MT-25-050-CI | |
| L'acide acétique glacial | Fisher | A491-212 | |
| Coomasie bleue | Fisher | BP101 25 | |
| Trypsine | Sigma-Aldrich | T3924-100ml | |
| Une collagénase | Sigma AldrichC0130-50 | ||
| hyalronidase | Sigma-Aldrich | H3884 | |
| DNase | Sigma-Aldrich | D5025 | |
| Standard de protéines Kaléidoscope | Biorad | 1610375 | |
| Lames de verre | Fisher | 12545-78 | |
| Verre lamelles | VWR | 101400-042 | |
| Vimentine anticorps S-20 | Santa Cruz Biotechnology | SC-7558 | |
| α-actine musculaire lisse d'anticorps | Abcam | ab5694 | |
| CK14 d'anticorps | Santa Cruz Biotechnology | sc-53253 | |
| CK18 d'anticorps | Abcam | ab668 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Anti-souris biotinylé | Laboratoires Vecteur | BA9200 | Distribués au travers de Fisher |
| Anti-souris-alexa-568 | Invitrogen | A10037 | |
| Anti-souris-alexa-488 | Invitrogen | A11001 | |
| Streptavidine alexa-488 | Invitrogen | S11226 | |
| DAPI | Invitrogen | D21490 | |
| Prolongez Antifade | Invitrogen | P-36930 | |
| Ciseaux chirurgicaux | Outils Fine Science | 91400-12 | |
| Ciseaux beau printemps | Outils Fine Science | 15000-02 | |
| Blunt pince | Outils Fine Science | 11002-12 | |
| # 5 pinces fines | Outils Fine Science | 11251-10 | |
| De suture chromique Gut | Fisher | NC9326254 | |
| Pasteur en verre pipette | Fisher | 22-042-815 | |
| Éthanol | Fisher | A406P 4 | |
| bétadine | Fisher | NC9386574 | |
| Clips des plaies | Fisher | 12032-07 | |
| Base des plaies | Fisher | 12031-07 |
Références
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon