Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un système de dosage Free Cell Estimation de la capacité de neutralisation de GM-CSF recombinant soluble à l'aide d'anticorps GM-CSF récepteur
Dans cet article
Résumé
Nous avons conçu un dosage des récepteurs cellulaires sans liant en vue d'estimer la liaison de granulocyte-macrophage colony-stimulating factor (GM-CSF) pour les récepteurs. Il nous permet d'évaluer l'inhibition compétitive de biotinylé GM-CSF se liant à des récepteurs solubles de GM-CSF alpha par le GM-CSF d'auto-anticorps avec une excellente reproductibilité.
Résumé
Arrière-plans: Auparavant, nous avons démontré que la capacité de neutraliser, mais pas la concentration de GM-CSF d'auto-anticorps a été corrélée avec la sévérité de la maladie chez les patients atteints protéinose alvéolaire auto-immune pulmonaire (PAP) 1-3. Comme l'abrogation de GM-CSF bioactivité dans le poumon est la cause probable pour PAP auto-immunes 4,5, il est prometteur de mesurer la capacité de neutralisation des anticorps GM-CSF pour évaluer la sévérité de la maladie chez chaque patient avec PAP.
Jusqu'à présent, la capacité de neutralisation de GM-CSF auto-anticorps a été évaluée en évaluant l'inhibition de la croissance de cellules humaines de la moelle osseuse ou cellules TF-1 stimulées par le GM-CSF 6-8. Dans le système de dosage biologique, cependant, il est souvent problématique pour obtenir des données fiables ainsi que de comparer les données de différents laboratoires, en raison des difficultés techniques dans le maintien des cellules dans un état constant.
OBJECTIF: Pour imiter le GM-CSF se liant à des récepteurs du GM-CSF à la surface cellulaire utilisant des cellules sans liaison au récepteur-dosage.
Méthodes: soie transgénique technologie a été appliquée pour obtenir une grande quantité d'alpha recombinant soluble du récepteur GM-CSF (sGMRα) avec une grande pureté 9-13. Le sGMRα recombinante a été contenue dans les couches séricine hydrophile de fils de soie sans être fusionnée à la protéine de soie, et donc, nous pouvons facilement extraire à partir des cocons de bonne pureté avec des solutions aqueuses neutres 14,15. Heureusement, les structures d'oligosaccharides, qui sont critiques pour la liaison avec le GM-CSF, sont plus semblables à des structures de sGMRα humaines que celles produites par d'autres insectes ou les levures.
RÉSULTATS: Le système de dosage sans cellule en utilisant sGMRα donné les données avec une grande plasticité et leur fiabilité. Contraignant pour sGMRα GM-CSF était dose-dépendante inhibée par le GM-CSF polyclonaux auto-anticorps dans une manière similaire à l'essai biologique utilisant cellules TF-1, indiquant que notre nouveau système de dosage sans cellule en utilisant sGMRα est plus utile pour la mesure de l'activité neutralisante de GM-CSF auto-anticorps que le système d'essai biologique utilisant des cellules TF-1 ou de cellules osseuses humaines.
CONCLUSIONS: Nous avons établi un test sans cellule de quantifier la capacité de neutralisation de GM-CSF autoanticorps.
Protocole
1. Production et purification de sGMRα
- Amplifier l'ADNc d'sGMRα du placenta banque d'ADNc humain en chaîne par polymérase (PCR).
- Ajouter de base 50 5'-UTR séquence de fin de polyhédrine de baculovirus et 27 RGS bases codant His-tag à l'extrémité 3 'de l'amplicon PCR PCR par un autre.
- Insérez le produit amplifié par PCR dans un plasmide pMSG1.1MG.
- Injecter l'psGMR/M1.1MG construire avec le vecteur d'aide pHA3PIG dans des œufs de vers à soie PND-w1 souche.
- Arrière de l'éclosion des larves de mites G0 à 25 ° C. Embryons obtenus par G1 écran d'accouplement entre frères et sœurs ou avec PND-W1 pour l'expression MGFP dans les yeux afin d'obtenir des vers à soie transgénique portant le gène sGMRα.
- Extrait recombinante sGMRα partir des cocons de vers à soie transgénique avec du phosphate-tampon contenant NaCl 500mm et agiter à 4 ° C pendant 24h.
- Centrifuger l'échantillon à 20 000 g pendant 15 min pour enlever un précipités.
- Appliquer le surnageant dans une colonne de nickel-affinité.
- Laver la colonne avec 10 mM imidazole, 500mm de NaCl et de phosphate de sodium 20 mM, pH6.3, et éluer avec un dégradé linéaire d'imidazole de 10mm à 250mm. Piscine des fractions contenant le sGMRα purifié et dialyse contre un tampon phosphate salin (pH 7,4) (PBS).
2. Biotinylation de GM-CSF recombinant
- Retirez la préparation du sorbitol par dialyse contre du PBS.
- Ajouter 1ml de 20mM de sodium méta-periodate solution froide à 4 ° C à la solution sur la glace.
- Incuber l'échantillon pendant 30 minutes sur la glace dans l'obscurité.
- Ajouter la glycérine à la solution à une concentration finale de 15 mM.
- Dialyser la solution contre le tampon acétate de sodium 100 mM (pH 5,5)
- Ajouter hydrazide de biotine à la solution à une concentration finale de 5 mM et continuellement agiter la solution pendant 2h à température ambiante.
- Retirez les matériaux n'ayant pas réagi par dialyse contre du PBS, pH 7,4.
3. Une cellule sans GM-CSF récepteur-ligand test de liaison
- Enduire une plaque de microtitration avec 50 pl d'anticorps monoclonaux anti-polyhistidine anticorps nuit à 4 ° C.
- Laver à cinq reprises avec 500μl de PBST.
- Ajouter 100 ul d'une solution de blocage et incuber pendant 3h à 4 ° C.
- Laver à cinq reprises avec 500μl de PBST.
- Ajouter 50 pl d'sGMRα dans la solution de blocage et incuber une nuit à 4 ° C.
- Laver à cinq reprises avec 500μl de PBST.
- Ajouter 25 pi des échantillons contenant du GM-CSF d'autoanticorps et 25 pi de biotinylé GM-CSF. Incuber pendant 1h à 4 ° C pour former sGMRα-GM-CSF complexes.
- Laver à cinq reprises avec 500μl de PBST.
- Ajouter 50 pl de 0.4mm streptavidine phosphatase alcaline pour 1 heure à 4 ° C pour détecter le GM-CSF biotinylé lié sGMRα.
- Laver à cinq reprises avec 500μl de PBST.
- Ajouter 50 pl d'un substrat chimiluminescent à la solution et incubées pendant 1h à température ambiante.
- En utilisant un lecteur de plaques chimiluminescence, de détecter l'activité chimiluminescence.
4. Les résultats représentatifs:
La première étape dans la voie du récepteur GM-CSF de transduction du signal est la liaison du GM-CSF à l'alpha du récepteur GM-CSF à la surface cellulaire. Parce que le GM-CSF d'auto-anticorps se lie spécifiquement le GM-CSF et de bloquer sa liaison au récepteur in vitro, 16,17, nous avons supposé que les auto-anticorps inhibent cette première réaction en se liant directement au GM-CSF. Comme décrit précédemment (Réf. 9-15), nous avons appliqué transgéniques magnanerie technologie pour obtenir une grande quantité de sGMRα recombinant avec une grande pureté.
Lorsque le ver à soie dérivés sGMRα recombinante a été chargé sur SDS-PAGE sous conditions non réductrices, le sGMRα montré à la fois monomère (45 kDa) et dimères (90 kDa) des formes, tandis que la forme monomérique a été détecté dans des conditions réductrices (figure 1B) , indiquant que le sGMRα recombinante a été un mélange de monomères et de ponts disulfure gradateurs 18.
En utilisant le système sans cellule (figure 2A), nous avons évalué l'inhibition de la GM-CSF se liant à sGMRα par le GM-CSF auto-anticorps (figure 2B et fig. 2C). Ces méthodes ont été décrites en référence 19 par Urano et al. L'inhibition de la croissance a été étroitement corrélée avec l'inhibition de la fixation (r = 0,988, p = 0,002) à différentes concentrations de l'auto-anticorps GM-CSF (figure 3A) 19. De même, l'inhibition de la fixation était significativement corrélé avec l'inhibition de la croissance. L'inhibition de la fixation accrue de façon dose-dépendante par le GM-CSF auto-anticorps (figure 3B) 19. Ces deux paramètres pour les fractions IgG sérum provenant de patients différents ont été corrélés entre eux (r = 0,589 p = 0,006, Fig. 3C). Ni d'inhibition de liaison, ni inhibition de la croissance en corrélation avec les valeurs de Kd, et donc, les deux paramètres n'étaient pas affectés par affinité de liaison 19. Par conséquent la reproductibilité des données entre contraignant et gl'inhibition roissance obtenus par trois expériences indépendantes sur trois échantillons différents ont été évaluées. Le coefficient de variation indiqué que le système sans cellule était plus excellent que celui de bioessais (tableau 1).
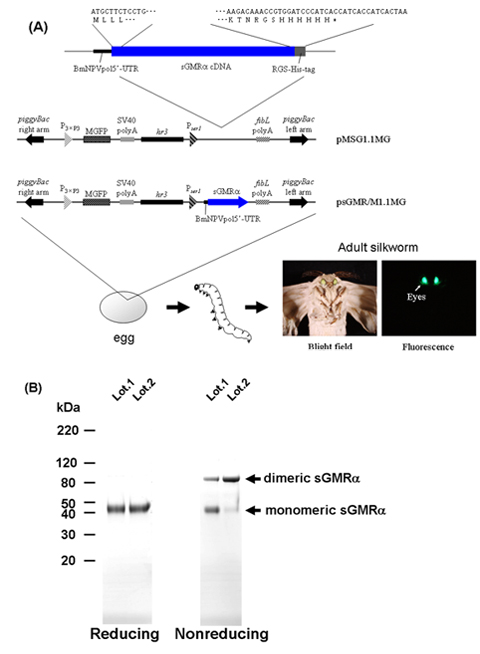
Figure 1. Organigramme de la procédure pour la production de vers à soie transgénique sGMRα aide. A) Structures de les 9-11 vecteurs de transformation. B) SDS-PAGE et Coomassie Brilliant Blue-coloration de la sGMRα purifiée dans la réduction et non des conditions réductrices. sGMRα, soluble dans le GM-CSF récepteurs alpha; MGFP, monstre protéine fluorescente verte; BmNPVpol5'-UTR, séquence de la région 5 'non traduite de Bombyx mori nucléaires polyédrose polyhédrine du virus; SV40 polyA, séquence signal polyA de SV40; P 3xP3, 3xP3 promoteur; P SER1, SER1 promoteur; FiBL polyA, fibroïne de la chaîne L séquence signal polyA; hr3, Bombyx mori nucléaires polyédrose virus hr3 Enhancer.
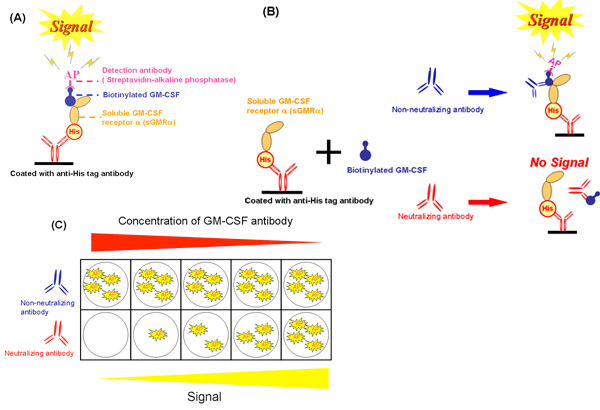
Figure 2. Schéma du système de dosage sans cellule. A) Un essai de liaison compétitive en utilisant sGMRα produites par des vers à soie. B) Effet des anticorps neutralisants et non neutralisants sur l'inhibition de la fixation par les cellules sans système. C) la différence de l'inhibition de liant entre les différentes concentrations d'anticorps neutralisants et des anticorps non neutralisants. GM-CSF, granulocyte-macrophage colony-stimulating factor; sGMRα, soluble dans le GM-CSF récepteurs alpha; Son, RGS-His-tag, AP, la phosphatase alcaline.
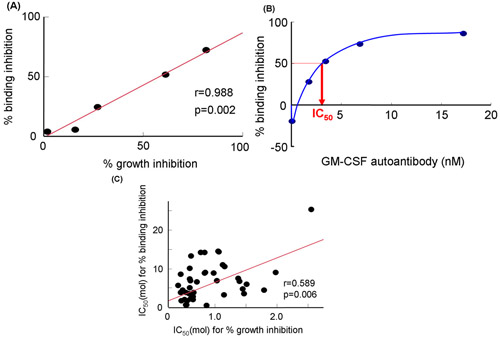
Figure 3. GM-CSF d'inhibition de liaison au sGMRα par effet du GM-CSF anticorps polyclonaux ou les fractions IgG sériques de patients atteints de PAP auto-immunes. A) Relation entre l'inhibition de liaison et d'inhibition de croissance par le GM-CSF autoanticorps. B) inhibition de la fixation à différentes concentrations de GM-CSF autoanticorps. C) La relation entre CI 50 pour cent d'inhibition de liaison et d'inhibition pour cent de croissance par les fractions d'IgG sériques 19. IC 50, concentration inhibitrice 50%; le GM-CSF, granulocyte-macrophage colony-stimulating factor.
| Exemple | Une | B | C |
| Inter-essai | |||
| Nombre de déterminations | 3 | 3 | 3 |
| Valeur moyenne (% d'inhibition de liaison) | 61,6 | 63,8 | 69,7 |
| Valeur moyenne (inhibition de la croissance%) | 21,0 | 73,4 | 82,8 |
| Le coefficient de variation (%) (% d'inhibition de liaison) | 6,0 | 5.6 | 8.3 |
| Le coefficient de variation (%) (% d'inhibition de croissance) | 64,4 | 18,3 | 10,4 |
Les deux analyses ont été effectuées à 5 ng / ml de GM-CSF et une concentration égale à la GM-CSF autoanticorps.
Tableau 1. Comparaison du coefficient de variations entre contraignante pour cent et la croissance des inhibitions obtenues par trois expériences indépendantes.
Discussion
Le test sans cellule estimé la capacité de neutralisation de GM-CSF auto-anticorps avec une excellente reproductibilité et de rapidité. L'inhibition de la fixation par le GM-CSF autoanticorps ou le sérum du patient fractions d'IgG a été évaluée par ce test. Les données ont montré une corrélation entre l'inhibition de la fixation de l'essai sans cellules et l'inhibition de croissance d'un test biologique utilisant cellules TF-1, respectivement. Le bio-essai a été largement utilisé, ...
Déclarations de divulgation
Remerciements
Nous sommes très reconnaissants à K. Nakagaki, le Dr H. Ishii, le Dr K. Suzuki, A. Yamagata, K. Oofusa pour leur précieuse contribution.
matériels

Références
- Arai, T. Serum neutralizing capacity of GM-CSF reflects disease severity in a patient with pulmonary alveolar proteinosis successfully treated with inhaled GM-CSF. Respir Med. 98, 1227-1230 (2004).
- Tazawa, R. Granulocyte-macrophage colony-stimulating factor and lung immunity in pulmonary alveolar proteinosis. Am J Respir Crit Care Med. 171, 1142-1149 (2005).
- Inoue, Y. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteinosis in Japan. Am J Respir Crit Care Med. 177, 752-762 (2008).
- Uchida, K. High-affinity autoantibodies specifically eliminate granulocyte-macrophage colony-stimulating factor activity in the lungs of patients with idiopathic pulmonary alveolar proteinosis. Blood. 103, 1089-1098 (2004).
- Sakagami, T. Human GM-CSF autoantibodies and reproduction of pulmonary alveolar proteinosis. N Engl J Med. 361, 2679-2681 (2009).
- Raines, M. Identification and molecular cloning of a soluble human granulocyte-macrophage colony-stimulating factor receptor. Proc Natl Acad Sci U S A. 88, 8203-8207 (1991).
- Williams, W., VonFeldt, J., Rosenbaum, H., Ugen, K., Weiner, D. Molecular cloning of a soluble form of the granulocyte-macrophage colony-stimulating factor receptor alpha chain from a myelomonocytic cell line. Expression, biologic activity, and preliminary analysis of transcript distribution. Arthritis Rheum. 37, 1468-1478 (1994).
- Prevost, J. Granulocyte-macrophage colony-stimulating factor (GM-CSF) and inflammatory stimuli up-regulate secretion of the soluble GM-CSF receptor in human monocytes: evidence for ectodomain shedding of the cell surface GM-CSF receptor alpha subunit. J Immunol. 169, 5679-5688 (2002).
- Iizuka, M. Production of a recombinant mouse monoclonal antibody in transgenic silkworm cocoons. FEBS J. 276, 5806-5820 (2009).
- Iizuka, M., Tomita, M., Shimizu, K., Kikuchi, Y., Yoshizato, K. Translational enhancement of recombinant protein synthesis in transgenic silkworms by a 5'-untranslated region of polyhedrin gene of Bombyx mori Nucleopolyhedrovirus. J Biosci Bioeng. 105, 595-603 (2008).
- Zou, W., Ueda, M., Yamanaka, H., Tanaka, A. Construction of a combinatorial protein library displayed on yeast cell surface using DNA random priming method. J Biosci Bioeng. 92, 393-396 (2001).
- Tamura, T. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector. Nat Biotechnol. 18, 81-84 (2000).
- Tomita, M. Transgenic silkworms produce recombinant human type III procollagen in cocoons. Nat Biotechnol. 21, 52-56 (2003).
- Ogawa, S., Tomita, M., Shimizu, K., Yoshizato, K. Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. J Biotechnol. 128, 531-544 (2007).
- Tomita, M. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon. Transgenic Res. 16, 449-465 (2007).
- Kitamura, T. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med. 190, 875-880 (1999).
- Tanaka, N. Lungs of patients with idiopathic pulmonary alveolar proteinosis express a factor which neutralizes granulocyte-macrophage colony stimulating factor. FEBS Lett. 442, 246-250 (1999).
- Brown, C., Pihl, C., Murray, E. Oligomerization of the soluble granulocyte-macrophage colony-stimulating factor receptor: identification of the functional ligand-binding species. Cytokine. 9, 219-225 (1997).
- Urano, S. A cell-free assay to estimate the neutralizing capacity of granulocyte-macrophage colony-stimulating factor autoantibodies. J Immunol Methods. 360, 141-148 (2010).
- Hayashida, K. Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor (GM-CSF): reconstitution of a high-affinity GM-CSF receptor. Proc Natl Acad Sci U S A. 87, 9655-9659 (1990).
- Hansen, G. The structure of the GM-CSF receptor complex reveals a distinct mode of cytokine receptor activation. Cell. 134, 496-507 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon