Method Article
Évaluation microinjection des ovocytes de souris, la maturation et de ploïdie
Dans cet article
Résumé
Les ovocytes sont sujettes à une aneuploïdie raison d'erreurs dans la ségrégation des chromosomes lors de la maturation méiotique. Oeufs aneuploïdes peut causer l'infertilité, fausses couches ou des troubles du développement tels que le syndrome de Down. Ici, nous décrivons les méthodes pour introduire des matériaux de choix dans des ovocytes et des méthodes pour étudier la maturation méiotique et évaluer ploïdie.
Résumé
Erreurs dans la ségrégation des chromosomes conduire à des cellules aneuploïdes. Dans les cellules somatiques, l'aneuploïdie est associée au cancer, mais dans les gamètes, conduit à une aneuploïdie infertilité, fausses couches ou des troubles du développement tels que le syndrome de Down. Gamètes haploïdes forme à travers des espèces spécifiques à des programmes de développement qui sont couplés à la méiose. La première division méiotique (MI) est unique à la méiose parce chromatides sœurs restent attachés tout chromosomes homologues sont séparés. Pour des raisons encore mal comprises, cette division réductionnelle est sujette à des erreurs et est plus communément la source de l'aneuploïdie que les erreurs de la méiose II (MII) ou que les erreurs dans le 1,2 méiose mâle.
Chez les mammifères, l'arrestation des ovocytes à la prophase de la MI avec un grand vésicule germinale intacte (GV; noyau) et ne reprendra la méiose quand ils reçoivent des signaux ovulatoire. Reprend la méiose fois, MI ovocytes complet et subir une division cellulaire asymétrique, en arrêtant à nouveau à la métaphase des MII. Oeufs ne sera pas complète MII jusqu'à ce qu'ils soient fertilisés par le sperme. Les ovocytes peuvent également subir une maturation méiotique à l'aide établie dans des conditions de culture in vitro 3. Parce que la génération de mutants de souris transgéniques et le gène ciblé est coûteuse et peut prendre de longues périodes de temps, la manipulation des gamètes femelles in vitro est une stratégie plus économique et gain de temps.
Ici, nous décrivons les méthodes pour isoler prophase arrêté ovocytes de souris et pour la microinjection. Tout matériau de choix peut être introduit dans l'ovocyte, mais parce méiose-compétents ovocytes sont transcriptionnellement silencieux ARNc 4,5, et non de l'ADN, doit être injecté pour les études de l'expression ectopique. Pour évaluer la ploïdie, nous décrivons nos conditions pour la maturation in vitro des ovocytes MII aux œufs. Historiquement, les techniques d'épandage du chromosome sont utilisés pour le comptage de 6 le nombre de chromosomes. Cette méthode est techniquement difficile et est limitée à seulement identifier hyperploidies. Ici, nous décrivons une méthode pour déterminer hypo-et hyperploidies utilisant des oeufs intacts 7-8. Cette méthode utilise monastrol, un inhibiteur de la kinésine-5, qui s'effondre fuseau bipolaire dans un fuseau monopolaire 9 chromosomes séparant ainsi de telle sorte que kinétochores individuels peuvent être facilement détectées et comptées en utilisant un sérum anti-CREST auto-immunes. Parce que cette méthode est réalisée dans des oeufs intacts, les chromosomes ne sont pas perdues en raison d'une erreur de l'opérateur.
Protocole
1. La collecte des ovocytes de souris
- Pour maximiser le nombre de follicules antraux isolés les uns des souris, par voie intrapéritonéale d'injecter sexuellement matures des souris femelles (nous utilisons de 6 semaines, âgé de souris CF-1 de Harlan) avec 5 UI de sérum de jument gravide gonadotrophine (PMSG).
- Préparer le milieu de collecte (MEM / PVP) (3 ml / souris) en ajoutant la milrinone à 2,5 um et chaude à 37 ° C. La milrinone est un inhibiteur de la phosphodiestérase qui maintient l'arrêt méiotique fois les ovocytes sont retirés de follicules. Sinon, la 3-isobutyl-1-méthylxanthine (IBMX) (0,2 mM) ou dibutyryl-adénosine monophosphate cyclique (dbcAMP) (100 pg / ml) peuvent être utilisés. Préparer le milieu de culture par l'ajout de glutamine (1 mM) et la milrinone (2,5 M) à 1 ml de CZB et lui permettre de s'équilibrer dans l'incubateur pendant au moins une heure. Mettre en place les microgouttes de chacun dans une boîte de Pétri et la superposition avec l'huile minérale. Le plat CZB est placé dans la couveuse alors que le plat MEM / PVP reste à l'extérieur sur un réchauffement de diapositives. Collecte des autres et de milieu de culture qui sont commercialement disponibles (M2 et M16 du support spécial ou Sigma) sont également utilisés en routine.
- Environ 48 heures après l'amorçage PMSG, le sacrifice de la souris utilisant du CO 2 sédation suivie par dislocation cervicale, disséquer les ovaires et les placer dans un verre de montre contenant préchauffé MEM / PVP + milrinone (MEM / PVP + M).
- En utilisant une seringue de 1 ml d'insuline, ancre les ovaires à l'antenne et la libération des follicules antraux en perforant plusieurs fois avec de calibre 27 (ou coudre) aiguilles qui sont fixées ensemble.
- Tout en regardant à travers un microscope de dissection, de recueillir complexes cumulus-ovocytes en utilisant un bouche-exploité pipette en verre. Il est utile d'avoir un microscope avec beaucoup de contraste. Alternativement, le support contenant le tissu et les cellules peuvent être pipetés à un couvercle d'une boîte en plastique de Pétri. Ne recueillir grands follicules antraux et non moins pré-antraux follicules ou des ovocytes dénudés. Une fois collectés, les transferts complexes à une microgoutte de MEM / PVP + M qui est sur le réchauffement de diapositives et dans l'huile.
- Avec une pipette de petite taille (légèrement plus grand que le diamètre de l'ovocyte), une pipette de haut en bas les complexes de détacher les cellules du cumulus. Transférer les ovocytes dénudés avec un plus grand pipette dans une microgoutte de CZB + milrinone (CZB + M) et le placer dans l'incubateur.
- Autoriser ovocytes de récupérer au moins 1 h dans l'incubateur avant la manipulation.
2. Microinjection d'ovocytes
- Faire des pipettes d'injection en tirant verre borosilicate tube capillaire dans un extracteur mécanique. Nous utilisons un Flaming-Brown micropipette extracteur (modèle P-97) avec les paramètres suivants: P = 500, la chaleur = 300, Pull = 150, Vel = 100, temps = 150.
- Préparer la plate-forme de micro-injection en plaçant une goutte 5 ul de MEM / PVP + M aussi près que possible à une baisse de 0,5 pi de matériel d'injection de choix (par exemple siARN, ARNc, oligonucléotides morpholino, etc) sur une lame de chambre 1-bien que a la chambre des médias enlevés. Couvrir avec de l'huile minérale et le placer sur la platine du microscope (fig. 1).
- Placez l'injection et les pipettes de maintien dans les titulaires et la position dans la goutte de MEM / PVP + M. Tournez sur les réservoirs d'azote qui sont connectés à la picoinjector et anti-vibrations table. Ouvrez la pointe de la pipette d'injection en douceur le tapotant contre la pipette de maintien tout en le remplissant avec support. Si l'ouverture est trop grande, la moyenne se déplacer dans et hors vite et l'aiguille va tuer la cellule. Pipettes avec trop peu d'une ouverture se bloquent souvent facilement.
- Ovocytes Transfert (5-10) de l'incubateur à la baisse de MEM / PVP + M sur la plate-forme. Avant d'injecter, la configuration de l'picoinjector. Nous utilisons les paramètres suivants sur notre picoinjector (modèle PLI-100 de Harvard Apparatus): 2.5 à 3.5 psi = PBal, Pinj = 7,8 psi, PClear = 10-12 psi, le temps = 3s. Il en résulte un volume d'injection de 5-10 pL.
- Tout en appuyant sur CLEAR, déplacer l'aiguille d'injection à la baisse de matériel et de remplissage. Rapportez-le à la baisse à moyen terme.
- Utilisez la pipette de maintien de capturer un ovocyte et à aligner l'aiguille d'injection, l'ovocyte et pipette de maintien le long de l'axe x.
- Sous un plus fort grossissement, l'avance de la pipette d'injection par l'ovocyte en faisant attention à éviter le noyau. Une fois la membrane plasmique est percé, la presse injecter. Après l'injection, retirer l'aiguille. Communiqué de l'ovocyte et répéter. Une fois que tous les ovocytes sont injectés, les retourner à l'incubateur. Tenez-le dans CZB + M pour la quantité désirée de temps, ce temps dépend de l'objectif expérimental (ie siARN et démontable morpholino (jusqu'à 24 h), la surexpression (3-12 h)). S'il vous plaît noter que les incubations de plus de 24 h compromettrait la maturation méiotique.
3. La maturation des ovocytes
- Après incubation, laver les ovocytes travers plusieurs gouttes de CZB (milieu de maturation) et le transfert à une microgoutte de milieu de maturation dans l'huile et le placer dans l'incubateur.
- Prévoir 16 h pour t maturation complète o métaphase de la méiose II.
4. Analyse de ploïdie
- Préparer CZB + monastrol (100 pM) et le lieu 750 ul dans le puits d'une boîte de culture organe qui a de l'eau dans l'anneau extérieur.
- Laver les œufs à travers plusieurs gouttes de CZB + monastrol et les transférer dans la boîte de culture d'organes. Placer dans l'incubateur pendant 1 h.
- Fixer les œufs en les transférant dans un verre de montre contenant 2% de paraformaldéhyde dans du PBS pendant 20 minutes à température ambiante. Transfert dans un autre verre de montre avec une solution de blocage. Ce plat peut être conservé à 4 ° C jusqu'à leur transformation.
- Transfert à la solution de perméabilisation (PBS + 0,3% de BSA + TritonX-100 0,1% + 0,02% NaN 3) dans un verre de montre pendant 15 minutes à température ambiante. Rincer à travers plusieurs grands volumes de solution de blocage (PBS + 0,3% de BSA + 0,01 Tween-20 + 0,02% NaN 3).
- Le reste de la procédure est exécutée sur le couvercle d'une plaque de 96 puits dans une chambre humidifiée à température ambiante qui est protégé de la lumière. Les gouttes (~ 25 pl) sont placés à l'intérieur des empreintes circulaires. Transfert des œufs à la solution de blocage pendant 15 minutes.
- Pour centromères étiquette, oeufs transfert à une goutte de solution de blocage contenant CREST anti-sérum à 1:40. Incuber pendant au moins 1 h. Laver à 3 gouttes de solution de blocage, l'incubation de 15 minutes chacune.
- Transfert des œufs d'une goutte de solution de blocage contenant Cy5 ou Alexa Fluor-594-conjugué anti-IgG humaine (1:200) et incuber pendant 1h. Répétez des étapes de lavage comme ci-dessus, sauf pour la dernière étape, notamment Sytox vert (1:5.000) dans la solution de blocage afin de détecter les chromosomes. Mont de 5 pi d'Vectashield. Pour éviter l'écrasement des oeufs, mettre 4 petits points de gelée de pétrole dans les coins de l'endroit où la lamelle sera. Placer une lamelle sur le dessus et sceller avec du vernis à ongles. Conserver dans une boîte à lames à 4 ° C jusqu'à leur traitement par microscopie confocale.
- Alors que l'imagerie avec un objectif 100X, la capture 0,4 um étapes dans le plan Z et l'image de toute la région de la broche en métaphase. Comptez centromères en utilisant le logiciel d'imagerie telles que Image J (NIH).
5. Les résultats représentatifs:
La figure 2 est une projection de Z-à partir d'un oeuf euploïde. A la métaphase de MII, des œufs de souris euploïde contiennent 20 paires de chromosomes et donc avoir 40 centromères. Parfois les chromosomes ne parviennent pas à propager malgré un traitement monastrol. Cette situation rend difficile la fiabilité comptent centromères et nous ne comprennent donc pas ces œufs dans nos analyses. Occasionnellement, il peut être difficile de déterminer si une CREST-immunoréactive «spot» est 1 ou 2 centromères. En utilisant des programmes tels que Image J est utile car on peut analyser chaque Z-section tout en notant soigneusement l'orientation des chromosomes, le nombre de sections dans lesquelles une «tache» est détectée et l'intensité du pixel «spots» ont. Selon l'endroit où la broche méiotique est positionné par rapport au corps polaires, les régions de l'ADN peuvent se chevaucher et ces échantillons ne devraient pas être inclus dans l'analyse.
Non manipulée, in vivo chez la souris oeufs ovulés reproductivement jeunes ont de faibles taux d'aneuploïdie (~ 1-2%). Toutefois, pour des raisons de ne pas comprendre, microinjection et dans les procédures de maturation in vitro peut augmenter cette hausse de taux de 10%. Par conséquent, il est essentiel que les ovocytes injectés de contrôle sont inclus dans une étude micro-injection.

Figure 1. Vaisselle microinjection mis en place. Une diapositive de chambre avec 5 gouttes ul de MEM / PVP + M juste au-dessus des chutes 0.5μl solution injectable. Couvrir avec de l'huile minérale. Dans cet exemple il ya 3 gouttes pour 3 solutions d'injection différents et la lame est assis sur la scène d'un microscope. Pour la gauche est l'aiguille de microinjection et à droite est la pipette de maintien. Notez qu'il ya un reflet de la porte-aiguilles.
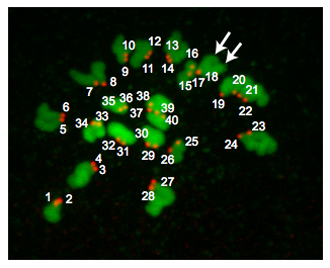
Figure 2. Résultats de ploïdie. Un Z-projection d'un oeuf euploïde métaphase II. L'ADN est coloré en vert et kinétochores sont colorés en rouge. Les flèches indiquent les deux bras distincts chromatides indiquant que kinétochores (# 17 et # 18) se chevauchent. Des œufs de souris euploïde contiennent 20 paires kinétochore (40 au total "spots"). Un œuf aneuploïdes contiendrait toute variation de ce nombre. Si cette procédure ont été réalisées sur les ovocytes MI métaphase, il y aurait 40 paires kinétochore (80 au total "spots").
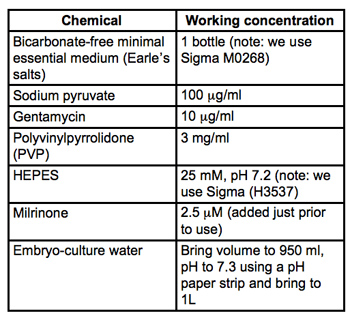
Tableau 1. Recette pour les moyennes de collecte et de la micro-injection (MEM / PVP + M). Tous les matériaux sont l'embryon de culture de qualité et de Sigma-Aldrich. Stériliser par filtration à travers des filtres PVDF 0.22μm (nous utilisons Stericups Milipore) et stocker à 4 ° C.
iles/ftp_upload/2851/2851table2.jpg "alt =" Tableau 2 "/>
Tableau 2. Recette pour les moyennes CZB. Tous les matériaux sont l'embryon de culture de qualité et de Sigma-Aldrich. Stériliser par filtration à travers des filtres PVDF 0.22μm (nous utilisons Stericups Milipore) et stocker à 4 ° C.
Discussion
Microinjection d'ovocytes est une méthode puissante pour étudier les mécanismes qui régulent la maturation méiotique 10,11, 12, 13. Cette méthode offre un moyen économique pour tester les hypothèses avant de faire un investissement important dans le développement de modèles de souris transgéniques et ciblée. La collecte des ovocytes et des techniques de micro-injection nécessitent plus de temps à maîtriser que les procédures typiques de biologie cellulaire. Obstacles spécifiques à la collecte comprennent souvent le contrôle de la pipeter à la bouche, tirer la pipette en verre taille appropriée pour la collecte et le décapage des cellules somatiques et augmente la vitesse de collecte afin de minimiser le temps pendant lequel les ovocytes sont en dehors de l'incubateur. Nous vous recommandons de pratiquer plusieurs fois avant de faire des expériences. Transfert entre les ovocytes microgouttes tout en conservant le même nombre de cellules est une excellente façon de se familiariser avec cette méthode.
La mort cellulaire survient fréquemment, tout en apprenant la microinjection. Cela pourrait se produire pour un certain nombre de raisons, y compris l'injection d'un trop grand d'un volume de matière (c'est à dire l'ouverture de l'aiguille d'injection est trop grand), frapper le noyau avec l'aiguille d'injection, perçant le côté opposé de l'ovocyte ou que le matériau injecté est toxique pour l'ovocyte. Pratiquer avec injection de tampon dans des ovocytes jusqu'à ce que votre taux de survie est d'au moins 50% est la clé pour maîtriser cette technique. Si ovocytes ne parviennent pas à maturité, il est probable que la milrinone n'a pas été diluée suffit. Nous recommandons de rincer à travers de nombreux ovocytes de grosses gouttes de milrinone sans CZB avant la maturation.
L'analyse de la micro-injection ploïdie dessous un des nombreux tests pour évaluer la maturation méiotique. Autres analyses de routine que nous utilisons dans le laboratoire incluent la surveillance de la cinétique par lequel le progrès à travers la méiose des ovocytes, l'immunofluorescence pour analyser la formation du fuseau et l'alignement des chromosomes et l'activation d'oeuf ou de fécondation in vitro pour évaluer les conséquences du développement de la manipulation des ovocytes 14,15, 16, 17.
Déclarations de divulgation
Remerciements
Ce travail a été effectué dans le laboratoire de Richard M. Schultz. Les auteurs tiennent également à remercier Michael Lampson pour conceptualiser le dosage centromère comptage et l'accès à son microscope confocal. Teresa Chiang et Francesca Duncan a aidé à optimiser le dosage centromère comptage. Paula Stein est soutenu par HD022681 (RMS) et Karen Schindler est soutenu par HD055822.
matériels
Table des réactifs spécifiques:
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Milrinone | Sigma-Aldrich | M4659 | Remettre en suspension dans le DMSO à 2,5 mm |
| L'huile minérale | Sigma-Aldrich | M5310 | Seule l'utilisation d'embryons testés, filtration stérile |
| CREST autoserum | Immunovision | HCT-0100 | |
| Sytox vert | Invitrogen | 57020 | |
| Anti-homme Alexa 594 | Invitrogen | A-11014 | |
| Vectashield | Vector Laboratories | H-100 | |
| Paraformaldéhyde | Polysciences | 577773 | |
| L'albumine de sérum bovin | Sigma-Aldrich | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | Sigma-Aldrich | M8515 | Remettre en suspension dans le DMSO à 100 mM |
| Tween-20 | Sigma-Aldrich | 274348 | |
| TritonX-100 | Sigma-Aldrich | X-100 |
Table des équipements spécifiques:
| Nom de l'équipement | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Porte-parole | Biodiseno | MP-001-Y | |
| Verre de montre | Sciences Electron Microscopy | 70543-30 | |
| Seringue | BD | 309623 | 1ml, 27G 1 / 2 |
| 60 mm boîte de Pétri | Falcon | 351007 | |
| Verre pipettes Pasteur | Fisher Scientific | 13-678-200 | |
| Côté chaud | Fisher Scientific | Tout modèle standard | |
| Microscope à dissection | Tout modèle standard | ||
| Glissez Chambre | Nunc | 177372 | |
| Tubes capillaires | Drummond | 1-000-0500 | Microcaps |
| Pipeter Puller | Flaming-Brown micropipette extracteur | Modèle P-97 | |
| Microscope inversé | Nikon | Tout modèle standard | |
| Micromanipulateurs | Eppendorf | Tout modèle standard | |
| Picoinjector | Harvard Apparatus | Modèle PLI-100 | Tout modèle standard |
| CO 2 réservoirs | Pour incubateur | ||
| N2 réservoir | Pour le tableau et l'injecteur | ||
| Anti-vibration de table | Techniques de fabrication | Tout modèle standard | |
| Incubateur | Tout modèle standard | ||
| PIPETTES de contention | Eppendorf | 930001015 | Vacutip |
| Microscope confocal | Leica | Tout modèle standard | |
| Des outils de dissection | Outils des sciences de beaux | Tout modèle standard | |
| Chambre humide | Nous utilisons tupperware | ||
| Couvercle de la plaque de 96 puits | Nunc | 263339 | |
| Lames de microscope | Fisher Scientific | 12-544-3 | |
| Lamelles | Thomas scientifiques | 6663-F10 | Epaisseur variera notamment pour les microscopes |
| Centre plat bien de la culture d'organe | Fisher Scientific | 353037 | 60 X 15mm |
Références
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon