Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
ReAsH / Flash d'étiquetage et d'analyse d'images de protéines dans les cellules du capteur Tetracysteine
Dans cet article
Résumé
Les colorants biarsenical Flash et ReAsH se lient spécifiquement aux motifs tetracysteine en protéines et peut sélectivement l'étiquette protéines dans les cellules vivantes. Récemment, cette stratégie d'étiquetage a été utilisé pour développer des capteurs pour les conformations de protéines différentes ou des états oligomériques. Nous décrivons la méthode d'étiquetage et des méthodes pour analyser quantitativement contraignant.
Résumé
Les protéines fluorescentes et les colorants sont des outils essentiels pour l'étude du trafic des protéines, la localisation et la fonction des cellules. Alors que les protéines fluorescentes telles que la fluorescence protéine verte (GFP) ont été largement utilisés en tant que partenaires de fusion aux protéines de suivre les propriétés d'une protéine d'intérêt de 1, les développements récents avec de petites balises permettent de nouvelles fonctionnalités de protéines pour être examinés dans les cellules, comme le changement conformationnel et en protéines d'association 2, 3. Un système de petite étiquette comporte un motif tetracysteine (CCXXCC) génétiquement inséré dans une protéine cible, qui se lie aux colorants biarsenical, ReAsH (rouge fluorescent) et Flash (vert fluo), avec une spécificité élevée même dans des cellules vivantes 2. Le système TC / biarsenical colorant offre beaucoup moins de contraintes stériques de la protéine de l'hôte que les protéines fluorescentes qui a permis à plusieurs nouvelles approches pour mesurer les changements de conformation et d'interactions protéine-protéine 4-7. Nous avons récemment développé une nouvelle application de balises TC que les capteurs d'oligomérisation dans les cellules exprimant la huntingtine mutante, qui, lorsqu'il est muté agrégats dans les neurones dans la maladie de Huntington 7. La huntingtine a été marqué avec deux colorants fluorescents, un pour une protéine fluorescente pour suivre la localisation des protéines, et le second un tag TC qui ne lie que les colorants biarsenical dans les monomères. Par conséquent, les changements dans colocalisation entre la protéine et la réactivité de teinture biarsenical permis teneur en oligomères submicroscopiques à être spatialement cartographié l'intérieur des cellules. Ici, nous décrivons comment étiqueter TC-protéines étiquetées fusionné à une protéine fluorescente (Cherry, la GFP ou PCP) avec le flash ou ReAsH en direct les cellules de mammifères et de la façon de quantifier la fluorescence à deux couleurs (Cherry / Flash, CFP / Flash ou GFP / combinaisons ReAsH).
Protocole
1. Préparation des cellules pour le marquage avec ReAsH / Flash
- En utilisant des méthodes standard de culture cellulaire pour votre lignée cellulaire d'intérêt, de préparer une culture de cellules adhérentes directement dans une diapositive imagerie des cellules vivantes prêtes pour la transfection.
- Transfecter votre plasmide contenant TC-taggés gène d'intérêt en fonction de votre méthode de transfection de choix.
Notez qu'il est important d'utiliser des contrôles positifs et négatifs afin d'évaluer l'ampleur de la liaison spécifique aux balises de TC et d'évaluer des bleedthrough de fluorescence entre les canaux lors de la collecte micrographies confocale. Ainsi, pour deux couleurs (par exemple Flash / cerisier ou ReAsH / CFP ou ReAsH / GFP combinaisons), s'assurer que les échantillons sont préparés pour une seule couleur (par exemple protéine fluorescente seul ou si possible une protéine TC-taggés lié à Flash / ReAsH mais sans fluorescentes protéines)
- Un à deux jours après la transfection, les rincer doucement les cellules avec 300 ul préchauffé (à 37 ° C) HBSS.
- Doucement plonger les cellules avec 1 uM flash (ou ReAsH) dans 300 ul de HBSS préchauffée et 10 uM 1,2-éthanedithiol (HAE).
Il est important d'ajouter HAE abord avant d'ajouter Flash / ReAsH et faire le tampon juste avant de l'ajouter aux cellules. Incuber pendant exactement 30 minutes à 37 ° C dans le tissu de la culture incubateur. De nos jours l'expérience d'incubation plus longues augmente de manière significative la fluorescence de fond. Nouvelles constructions devraient également être optimisés pour l'étiquetage du temps et Flash / ReAsH de concentration (0,5-2 uM).
- Aspirer doucement étiquetage solution à partir de cellules et ensuite le remplacer par 300 ul de HBSS préchauffé + 250 uM 2,3-dimercaptopropanol (BAL) pendant 15 min à 37 ° C.
- Retirer la solution de lavage par aspiration douce et la remplacer par 300 ul de HBSS préchauffé.
Après ce lavage, les cellules peuvent être fixées avec du paraformaldéhyde (15 min avec une solution de 3,2%), bien que nous avons constaté que cela augmente la fluorescence non-spécifique de teinture biarsenical. Ainsi nous avons l'habitude d'image des cellules vivantes à la température ambiante. (Notez que la fixation des cellules avant l'étiquetage empêche la liaison de teinture biarsenical.)
2. Imagerie des cellules sur un microscope confocal
- Sur le microscope confocal, mis en place des paramètres pour l'imagerie des fluorophores individuels (voir tableau 1) et s'assurer qu'il n'y a bleedthrough négligeables entre les canaux. Ceci peut être réalisé en vérifiant fluorophores individuels (dans les échantillons de contrôle) contre chaque paramètre d'acquisition fluorescents différents pour la fluorescence. Réglage de la longueur d'onde d'émission peut aider à minimiser bleedthrough (bien que cela peut également réduire le rapport signal / bruit).
- Aussi régler les paramètres afin que les photomultiplicateurs de la fluorescence maximale dans l'échantillon ne pas saturer le détecteur. (Ceci peut être détecté en utilisant le réglage de Q-LUT sur le SP2 confocale Leica). Une fois les meilleurs paramètres d'imagerie sont déterminées, ne modifiez pas l'un d'eux entre les échantillons.
- D'autres paramètres nous utilisons habituellement (bien que ceux-ci peuvent être optimisés) sont une vitesse de balayage de 200 Hz et de recueillir 4 moyennes de ligne et d'un diamètre de 1 unité sténopé Airy. Le diamètre sténopé peut être étendu si le signal / bruit est un problème, cependant, cela peut entraîner une certaine perte de l'imagerie.
- Recueillir les images confocales en 12 bits (ou supérieur) de format si possible. 12-bit de format capte une plus grande dynamique de valeurs (de 0 à 4095) pour chaque intensité d'un pixel de 8 bits (0-255). Ceci est important pour assurer le plus riche ensemble de données est enregistrée, ce qui maximise la qualité de l'analyse des données quantitatives.
- Collecter des images pour le canal protéine fluorescente (Cherry, la GFP ou PCP) et aussi pour le canal biarsenical colorant (Flash ou ReAsH) pour tous les échantillons.
3. L'analyse des données
- Installez le logiciel ImageJ sur votre ordinateur 8. http://rsbweb.nih.gov/ij/
- Assurez-vous que votre version d'ImageJ a les plugins suivants:
- Ouvrez ImageJ, et si vous utilisez une version antérieure à v1.32c, cliquer sur les options suivantes pour activer des images multiples pour être ouverts en même temps (ce qui peut être fait en maintenant enfoncé le bouton de contrôle pendant que vous cliquez sur des fichiers différents):
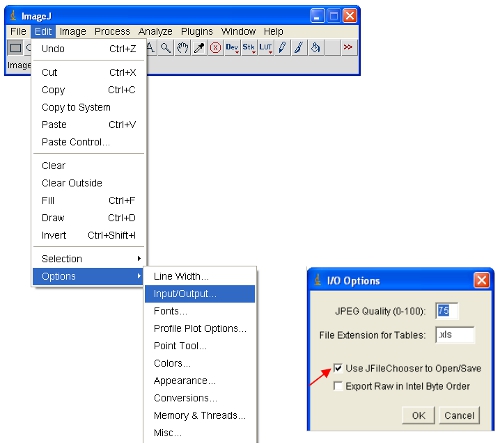
- Ouvrez les images d'intérêt dans ImageJ.
ImageJ va définir automatiquement les intensités des pixels maximum et minimum qui sont affichés à l'écran pour chaque image séparément. Étant donné que les différentes images auront dintensités des pixels DIFFÉRENTES, cela signifie que les images affichées ne sont pas comparables comme affichés. - Afin de s'assurer que les images ouvertes sont tous sur la même échelle, vous pouvez définir le physique supérieure et inférieure intensités des pixels à afficher (cela ne changera pas le contenu des données réelles des images comme ce serait le cas dans certains autres logiciels). Ces valeurs peuvent être mis sous le menu suivant:
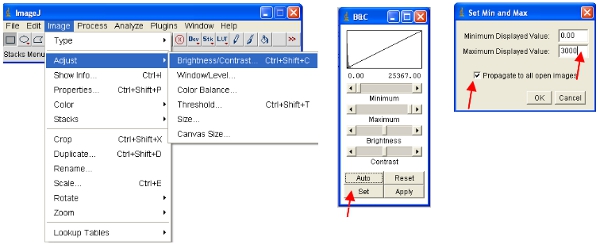
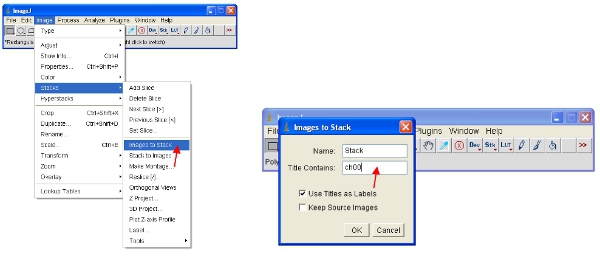
- Une approche alternative est de travailler avec des piles, ce qui met toutes les images ensemble en un seul fichier et automatiquement à l'échelle (pour la visualisation) toutes les images dans la pile à la même échelle. La meilleure façon de travailler avec les données est de convertir chaque canal d'une pile. Ainsi, pour le canal protéine fluorescente convertir tous à la pile comme indiqué. Vous pouvez facilement sélectionner un canal par l'empilement de toutes les images contenant un nom commun (par exemple "CH00") dans le titre.
- Maintenant convertir toutes les images ouvertes à 8 bits pour l'analyse. Ce sera effectivement redimensionner la gamme considérée dans une gamme 0-255 (qui définit 8-bit).
IMPORTANT: Ne pas économiser plus de l'original 12-bits (ou supérieur) de format ou vous perdrez le contenu de l'information. Notez que certains logiciels ne peuvent afficher des images 8 bits pour ce format est utile pour faire des figures etc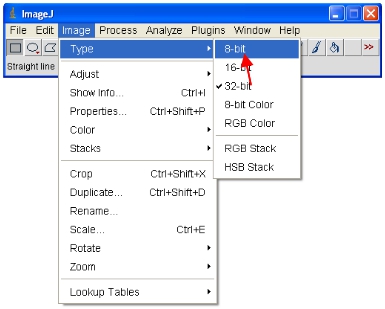
- Enregistrer une copie dans un nouveau dossier appelé «8-bits convertis» en utilisant l'option "Enregistrer sous ..." option.
- Une méthode pour examiner l'étendue de liaison de teinture biarsenical dans une image entière est d'effectuer une parcelle d'intensité des pixels de corrélation. Cette parcelles chaque valeur de pixel dans un canal par rapport à la valeur du pixel correspondant dans un deuxième canal. D'où une position de pixel élevé dans la fluorescence de la PCP sera aussi élevé dans la fluorescence ReAsH s'il y est élevé contraignant.
- Pour analyser le pixel co-corrélation, assurez-vous que l'ReAsH 8-bit et Cerulean / GFP images sont ouvertes dans ImageJ.
- Ouvrez le "corrélateur d'image" plugin comme indiqué ci-dessous. Sélectionnez "Image1" comme la pile ReAsH ou Flash et "Image2" comme la pile protéine fluorescente.
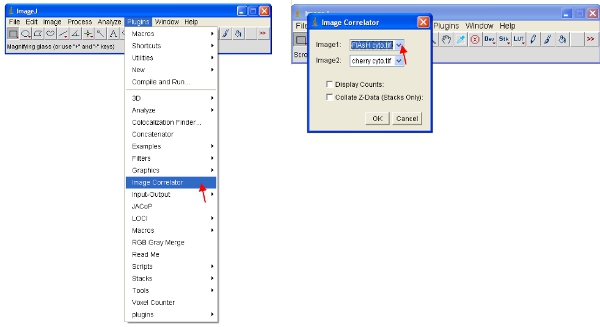
- La pile qui en résulte peut pas afficher toutes les informations détaillées - ce qui est normal. Enregistrer la pile dans un nouveau dossier appelé "Les diagrammes de dispersion" et donnez lui le nom de fichier que l'échantillon, il se réfère à (par exemple "courbe de corrélation Flash-cerise")
- Pour afficher les données de manière significative que vous pouvez faire une des deux options. D'abord transformer les données afin qu'il soit au format journal. Ensuite visuellement redimensionner les données comme suit:
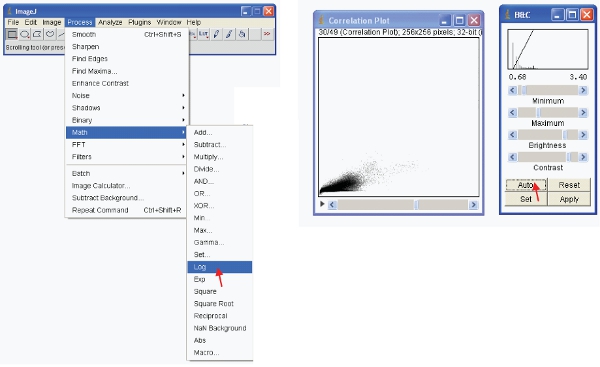
- Alternativement, vous pouvez redimensionner les données visuelles pour ne montrer que de faibles valeurs (par exemple 1-255) et afficher les données en utilisant une LUT spéciaux. Une LUT (Look Up Table) représente une table de couleurs qui sont assignés à chaque valeur de pixel dans une image . Ceci peut être utilisé pour définir un schéma pseudo pour une image et est utile pour définir certaines caractéristiques dans une image. Pour créer un clic LUT personnalisé sur "éditeur LUT» et en faire un nouveau comme celui montré (ce qui peut être sauvé et utilisé plus tard).
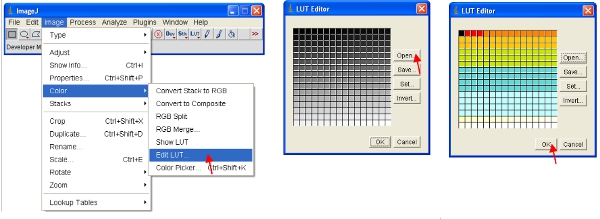
- Régler la plage de luminosité / contraste de 0-255 (comme décrit dans l'étape 13 ci-dessus). Pour «verrouiller» l'image comme à celle indiquée sur l'écran, l'image peut être convertis au format RVB qui enregistre une valeur de 8 bits pour chacune des couleurs rouge, vert et bleu de chaque pixel.
Pour copier et coller des images à d'autres programmes d'abord ouvrir les images 8-bit ou 16-bit. Comme décrit dans l'étape 14 ci-dessus, attribuer une palette de couleurs LUT à l'image. Pour la PCP, d'attribuer le "Cyan" LUT comme décrit ci-dessous ...
- Sélectionnez l'image et le copier dans le presse-papiers, sélectionnez ...
4. Les résultats représentatifs:
Le succès des cellules de l'étiquetage avec des colorants biarsenical dépend de quelques paramètres clés. Tout d'abord, le calendrier de l'étiquetage avec des colorants est cruciale. Nous avons constaté que de longues périodes de l'étiquetage (plus de 30 min) se traduit par un niveau élevé de coloration de fond non spécifique. La figure 1 montre un résultat typique d'une forme sauvage du fragment huntingtine (25Q) fusionnée à la CFP Cerulean dérivé contenant une balise de TC, comme décrit précédemment 7. Cet échantillon a été coloré pendant 30 min avec ReAsH et il ya peu de fond de l'échantillon manque la balise TC. Nous avons constaté que la fixation des cellules au paraformaldéhyde augmente de fond tout en fixant avec du méthanol abroge la fluorescence de la balise protéine fluorescente. Ainsi là où c'est possible, nous l'image des cellules vivantes. Il est important de noter également que la fixation avantà l'étiquetage avec des colorants biarsenical empêche leur liaison, vraisemblablement dues à des modifications du motif TC.
Un autre facteur essentiel pour des résultats constants est la densité de cellules. Nous avons trouvé qu'il était essentiel pour les cellules d'image qui sont vaguement distribuées et aussi que l'agglutination vaste peut conduire à coloration inégale des colorants biarsenical dans différentes cellules.
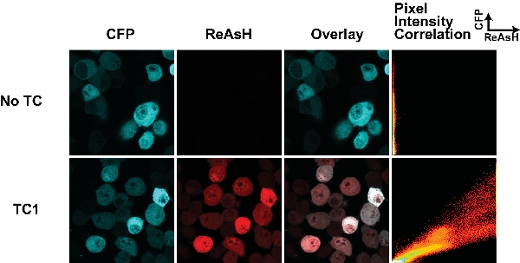
Figure 1. Balises Tetracysteine et coloration ReAsH dans les cellules vivantes transfectées avec la huntingtine (exon1-25Q)-Cerulean fusions. La balise TC est situé à la jonction de la fusion huntingtine-Cerulean (telle que décrite au point 7). L'intrigue de corrélation d'intensité des pixels permet une évaluation des différences de ReAsH contraignante à travers la cellule et peuvent être utilisées pour cartographier les changements dans ReAsH contraignante en raison du changement de conformation ou d'interactions ligand.
Discussion
L'approche de la localisation de la protéine étiquette avec une protéine fluorescente et les propriétés conformationnelles avec un second colorant offre beaucoup de potentiel pour la cartographie où les différentes conformations de protéines s'accumulent dans les cellules et les événements qui changent la dynamique de la conformation des protéines. ReAsH / Flash a été d'abord utilisé comme un capteur de cellules pour le repliement des protéines cellulaires de mammifères de l'acide rétino...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été financé par des subventions aux DMH et TDM (NHMRC subventions de projet). DMH est Fellow Grimwade, financé par la Fiducie Miegunyah.
matériels
| Name | Company | Catalog Number | Comments |
| Le nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| 8-même μ-diapositives | Ibidi | 80826 | Nous trouvons ces diapositives de chambre pour être particulièrement utile pour la culture de cellules pour l'imagerie. |
| TC-Flash II dans la cellule de détection Tag Tetracysteine Kit * * * fluorescence verte pour imagerie des cellules vivantes | Invitrogen | T34561 (Flash) ou T34562 (ReAsH) | |
| Hanks Balanced Salt Solution | Invitrogen | 14175-103 | |
| 2,3-dimercapto-1-ol | Sigma-Aldrich | D1129-5ML | |
| 1,2-éthanedithiol | Sigma-Aldrich | 02390-25ML |
Références
- Tsien, R. Y. The green fluorescent protein. Ann. Rev. Biochem. 67, 509-544 (1998).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-2672 (1998).
- Uttamapinant, C. A fluorophore ligase for site-specific protein labeling inside living cells. Proc. Natl. Acad. Sci. USA. 107, 10914-10919 (2010).
- Ignatova, Z., Gierasch, L. M. Monitoring protein stability and aggregation in vivo by real-time fluorescent labeling. Proc. Natl. Acad. Sci. USA. 101, 523-528 (2004).
- Coleman, B. M. Conformational detection of prion protein with biarsenical labeling and FlAsH fluorescence. Biochem. Biophys. Res. Commun. 380, 564-568 (2009).
- Luedtke, N. W., Dexter, R. J., Fried, D. B., Schepartz, A. Surveying polypeptide and protein domain conformation and association with FlASH and ReAsH. Nat. Chem. Biol. 3, 779-784 (2007).
- Ramdzan, Y. M. Conformation sensors that distinguish monomeric proteins from oligomers in live cells. Chem. Biol. 17, 371-379 (2010).
- Abramoff, M. a. g. e. l. h. a. e. s., PJ, S. J. R. a. m. Image processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Hearps, A. The biarsenical dye Lumio exhibits a reduced ability to specifically detect tetracysteine-containing proteins within live cells. J. Fluor. 17, 593-597 (2007).
- Adams, S. R. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. J. Am. Chem. Soc. 124, 6063-6076 (2002).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Meth. 2, 905-909 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon