Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Polymères à mémoire de forme pour la Culture cellule active
Dans cet article
Résumé
Une méthode de développement de substrats de culture cellulaire avec la possibilité de changer la topographie lors de la culture est décrite. La méthode permet l'utilisation de matériaux intelligents connus comme les polymères à mémoire de forme qui ont la capacité de mémoriser une forme permanente. Ce concept est adaptable à une large gamme de matériaux et d'applications.
Résumé
Polymères à mémoire de forme (PSM) sont une classe de matériaux «intelligents» qui ont la capacité de changer à partir d'un fixe, forme temporaire à une forme pré-déterminé permanente sur l'application d'un stimulus comme la chaleur 1-5. Dans un cycle de mémoire de forme typique, le SMP est d'abord déformé à une température élevée qui est supérieure à sa température de transition, T trans [soit la température de fusion (T m) ou la température de transition vitreuse (Tg)]. La déformation est élastique dans la nature et conduit principalement à une réduction de l'entropie conformationnelle des chaînes du réseau constitutifs (suivant la théorie de l'élasticité du caoutchouc). Le SMP est déformée, puis refroidi à une température inférieure à son T trans, tout en maintenant la souche externe ou un stress constant. Pendant le refroidissement, les transitions d'un état du matériel plus rigide (semi-cristallins ou vitreux), ce qui cinétique des pièges ou «gèle» la matière dans cet état de faible entropie conduit à fixer la forme macroscopique. Récupération de forme est déclenchée par le chauffage du matériau en continu à travers T trans sous une contrainte-libre (sans contrainte) condition. En permettant les chaînes du réseau (à mobilité retrouvé) pour se détendre à leur thermodynamiquement favorisée, maximum d'entropie état, les changements importants de la forme temporaire de la forme permanente.
Les cellules sont capables d'arpentage des propriétés mécaniques de leur environnement 6. Les mécanismes par lesquels les interactions mécaniques entre les cellules et leur comportement physique des cellules environnement de contrôle sont des domaines de recherche très actif. Les substrats de la topographie définie sont apparus comme des outils puissants dans l'enquête sur ces mécanismes. Méso-échelle, microscopique, et les schémas de la topographie nanométrique substrat a été démontré directement l'alignement des cellules, l'adhésion cellulaire, et des forces de traction cellulaire 7-14. Ces conclusions ont souligné le potentiel de la topographie du substrat de contrôler et de doser les interactions mécaniques entre les cellules et leur environnement physique pendant la culture cellulaire, mais les substrats utilisés à ce jour ont été généralement passive et ne pouvait pas être programmé pour changer de façon significative au cours de la culture. Cette stase physiques a limité le potentiel de substrats topographique pour contrôler les cellules en culture.
Ici, actif sur culture cellulaire (ACC) substrats SMP sont introduits, qui emploient à mémoire de forme de surface pour fournir un contrôle programmé de la topographie du substrat et de déformation. Ces substrats démontrer la capacité de transition d'une topographie temporaires rainurée pour une seconde, la topographie mémorisé presque plat. Ce changement dans la topographie peut être utilisé pour contrôler le comportement des cellules dans des conditions standard de culture cellulaire.
Protocole
1. Isotherme UV du NOA63
- Une chambre de durcissement personnalisé a été développé en utilisant une lame de verre (75 mm x 25 mm x 1 mm), de 1 mm d'épaisseur entretoise en téflon et une plaque d'aluminium (75 mm x 25 mm x 3 mm) comme le montre la figure 1. La chambre est maintenu par des clips liant petits.
- Injecter l'NOA63 dans la chambre à travers un trou dans l'entretoise en téflon en utilisant une aiguille de calibre 18. Le NOA63 peut être chauffé doucement à la facilité d'injection.
- Placer la chambre sur une plaque chauffante à 125 ° C et laisser chauffer à une température uniforme pendant 5 min.
- Pré-traitement du NOA63 dans une chambre de la lampe UV (λ max = 365 nm; voir tableau) pendant 20 min avec la lampe de 6,5 cm de la surface du verre.
- Retirez le NOA63 de la chambre à chaud en utilisant une lame de rasoir.
- Post-traitement de la NOA63 sous la lumière UV pendant 3 h 40 m sur la plaque chauffante à 125 ° C.
- Stocker le NOA63 desséchée à -20 ° C.
2. Caractérisation mémoire de forme de NOA63
- Préparer un spécimen d'haltère par pressage à chaud une guéri NOA63 film avec un poinçon personnalisé (voir tableau), dont les dimensions sont indiquées dans la figure 2.
- Chargez le spécimen dans un analyseur mécanique dynamique (DMA, voir le tableau) avec fixation à la traction. Régler l'instrument à la "force contrôlée" mode, puis programmez la procédure de test comme suit:
- S'équilibrer à 95,00 ° C
- Isotherme pour 10,00 min
- Rampe vigueur 0.300 N / min à 2.500 N
- Isotherme pour 5,00 min
- Rampe 2,00 ° C / min à 20,00 ° C
- Isotherme pour 10,00 min
- Rampe vigueur 0.300 N / min à 0,015 N
- Isotherme pour 5,00 min
- Rampe 2,00 ° C / min à 95,00 ° C
- Répétez les étapes 2-9 deux fois plus
3. Préparation des substrats de culture cellulaire active
- Les échantillons individuels peuvent être préparés à partir de la pellicule isotherme guéri SMP. Couper le film SMP avec un rasoir à la taille de l'échantillon désiré. Placez le SMP sur une plaque chauffante réglée à une température supérieure à la Tg de réduire le module et la facilité de découpe.
- La forme temporaire peut être fixé à un certain nombre de façons différentes. Ici, nous utilisons un banc de presse Top hydraulique avec chauffage / refroidissement plateaux pour gaufrer une topographie temporaire. Réglez la température des plateaux à une température supérieure à la Tg.
- Une embosseuse a été faite par Epoxy sur un disque vinyle. Ceci va produire une forme temporaire de rainures parallèles. Ici, l'embosseuse avait pics triangulaires de 35 à 40 um et 60 um haute gamme, espacés 80 um d'intervalle. Le gaufrage peut être fabriqué à partir d'autres matériaux et aux topographies différentes, mais doit être plus rigide que NOA63 à la température de gaufrage. Placer les échantillons SMP face cachée sur l'embosseuse et le lieu des échantillons et embosseuse dans la presse.
- Appliquer une précharge ~ 100 kPa à prendre contact entre les plaques chauffantes et les échantillons et maintenez pendant environ 5 minutes pour permettre les échantillons pour atteindre une température uniforme.
- Appliquer 1-6 MPa à des échantillons et maintenir pendant 1 minute. Un stress de 4,7 MPa conduit à la réplication incomplète de la topographie embosseuse. La topographie temporaires produit a arrondi des pics de 25 à 35 um et 150 um haute gamme. Le SMP fracture si une plus grande contrainte est appliquée. Appliquer petites contraintes d'introduire des topographies avec de petites amplitudes.
- Réduire la température en dessous de la T g. Ici, nous utilisons la capacité de refroidissement d'eau des plateaux de presse.
- Lorsque la température est inférieure à la Tg, retirez la force appliquée.
- Les échantillons peuvent être conservés desséchée à -20 ° C. Lorsqu'elles sont stockées dans ces conditions, nous avons observé une baisse inférieure à 1 um dans la récupération d'amplitude après deux mois pour les échantillons de relief avec l'embosseuse disque vinyle.
4. Actif expérience de culture cellulaire
- La lumière UV d'une enceinte de sécurité biologique (BSC) est utilisé pour stériliser les échantillons. Disposer les échantillons face vers le bas dans des boites stériles sans couvercle et allumez la lumière UV BSC pendant 6 h.
- Échantillons Flip nouvelles boites stériles face. Allumez la lumière UV BSC pendant 6 h.
- Les échantillons doivent maintenant être équilibrée à un état relativement stable avant l'étalement des cellules. Placer les échantillons dans une plaque de 96 puits et ajouter 150 ul de milieu de croissance complet.
- Mettez la plaque dans un incubateur à 30 ° C avec 5% de CO 2 jusqu'à la récupération souhaité partielle. Ici, nous utilisons 30 h pour produire des échantillons avec une amplitude assez grande pour aligner les cellules.
- Les échantillons peuvent maintenant être plaqués avec des cellules. Placer les échantillons dans une nouvelle plaque de 96 puits.
- Ajouter 150 pi de solution de cellule pour les échantillons. Ici, nous utilisons C3H/10T1/2 fibroblastes embryonnaires de souris à 20.000 cellules / ml pour atteindre des cellules isolées (généralement pas en contact avec d'autres cellules).
- Pour permettre aux cellules d'attacher et de répandre sur la topographie temporaires, placer dans un incubateur à 30 ° C pendant 9,5 h.
- Pour Morphol cellules testgie avant la transition, prélever des échantillons et effectuer des taches et l'imagerie de fluorescence des échantillons. Ce matériau présente l'autofluorescence à travers la plupart de la gamme UV et visible. Fluorophores dans l'extrémité rouge du spectre, comme Alexa Fluor 647 sont recommandés pour réduire de fond.
- Pour déclencher des échantillons de récupérer, déplacer la plaque à un incubateur à 37 ° C et continuer la culture pendant 19 h pour permettre au matériel de récupérer et de permettre aux cellules de s'adapter à leur morphologie la nouvelle topographie.
- Retirer les échantillons et appliquer la couleur appropriée (pour la phalloïdine filamenteuses actine imagerie) et l'imagerie des procédures.
5. Les résultats représentatifs:
Guéri NOA63 est transparent, solide vitreux qui possède d'excellentes propriétés de mémoire de forme comme le montre la figure 3. Dans ce cas, le matériel a été guéri comme dans le protocole 1 ci-dessus et montre un uniforme Tg de 51,1 ° C (déterminée à partir de l'apparition de la chute de E '). Il est observé de l'un des cycles de manière à mémoire de forme (chauffage, déformant, le refroidissement, la récupération, la figure 3) qui, un grand pourcentage de souche a été fixée après le déchargement à 20 ° C, correspondant à un ratio de 15 fixation (Rf) de 89,3 % (moyenne sur trois cycles: le dessous de même pour R r). La souche fixes récupérés à un taux de récupération (R r) de 84,4% dans une plage de température relativement faible pendant le chauffage. En outre, les performances de mémoire de forme n'a montré aucune altération jusqu'à trois cycles, en ce que toutes les courbes suivent presque exactement avec l'autre.
NOA63 a été utilisé dans ce protocole, car il est facilement disponible chez le fabricant et fourni comme une facilement guéries sans solvant prépolymère avec photoamorceur. Cependant, sa composition n'est pas divulguée par le fournisseur. Il a été trouvé pour permettre la fixation des cellules de haute et de la viabilité. Enfin, la température de transition pourrait être réglé pour permettre une magnitude significative de récupération entre les deux températures de cellules compatibles. Un certain nombre d'autres systèmes polymères pourrait également être utilisé avec ce protocole, si la température de transition est compatible avec la culture cellulaire et si elles favorisent l'adhérence et la viabilité cellulaire.
L'amplitude de la topographie temporaire (rainures) diminue au fil du temps à 30 ° C. En 30 h à 30 ° C, l'amplitude a été réduite d'environ 50% (figure 4, le temps 0) 16. Il réduit de 10% supplémentaires au cours des prochaines 9,5 h. Lorsque la récupération est déclenchée par l'augmentation de la température à 37 ° C, l'amplitude se réduit à 0,5% de l'amplitude initiale dans 9,5 h. Pour l'embosseuse utilisée et un stress gaufrage de 4,9 MPa, ce qui correspond à un changement fonctionnel des rainures 13 um d'une surface presque plate.
Un exemple d'un comportement cellulaire contrôlée par l'utilisation des actifs substrats de culture cellulaire est un changement dans l'organisation du cytosquelette. Sur temporaires substrats rainurés avant la récupération est déclenchée, le microfilaments d'actine s'alignent le long de la direction des rainures (figure 5a) 16. Après la récupération par l'augmentation de la température, les microfilaments sont réorganisés et sont orientés de façon aléatoire. Les échantillons de contrôle qui ont des rainures statique ou une surface plane statiques ne réorganise après l'augmentation de la température (figure 5b, c).
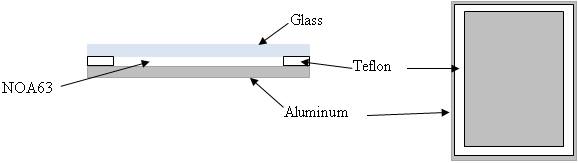
Figure 1: Schéma d'NOA63 chambre de durcissement. Vue en coupe (à gauche) et top-down vue sans couvercle en verre (à droite).
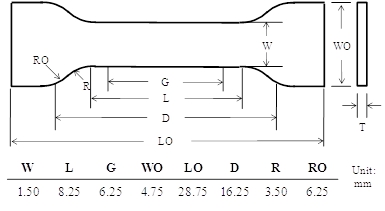
Figure 2: La géométrie d'haltères utilisées pour la caractérisation à mémoire de forme en vrac W:. Largeur de section étroite, L: longueur de section étroite, G: longueur de jauge, WO: largeur hors tout, LO: la longueur totale, D: distance entre les poignées, R: rayon de filet, et RO: rayon extérieur.
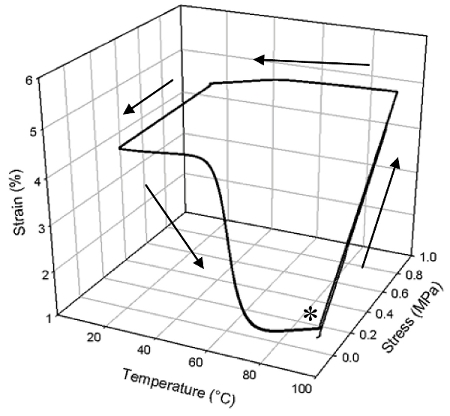
Figure 3: La mémoire de forme en vrac unidirectionnelle d'un seul NOA63 guérir, répété 3 fois (l'astérisque indique le début d'expérimentation). Au point marquées d'un astérisque, le polymère a été chauffé et est ensuite déformé en appliquant une contrainte de définir sa forme provisoire. Cette souche est maintenue constante, et la température est réduite à fixer la forme ci-dessous temporaires à la Tg du polymère. La température est alors augmentée, et le matériau récupère sa forme permanente que la souche temporaire est réduite.
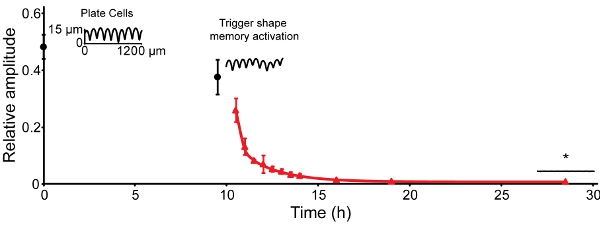
Figure 4: récupération SMP peut être déclenchée en vertu de culture cellulaire compatible températures. L'amplitude de 25,6 ± 0,8 um présents suivantes rec gaufrageovered à 12,6 ± 1,5 um après 30 équilibration h à 30 ° C (temps 0, les cercles noirs). Après les échantillons ont été déplacés vers un incubateur à 37 ° C (9,5 h), l'amplitude récupérés à 1,1 ± 0,2 um à moins de 3,5 h. L'amplitude récupérés à ~ 0,3 ± 0,1 um dans les 9,5 h et aucune diminution détectable au cours de la dernière 9,5 h ont été observés (triangles rouges). Les barres d'erreur représentent un écart type (n = 4-6). Les traces sont de contact scans profilométrie d'échantillons représentatifs.
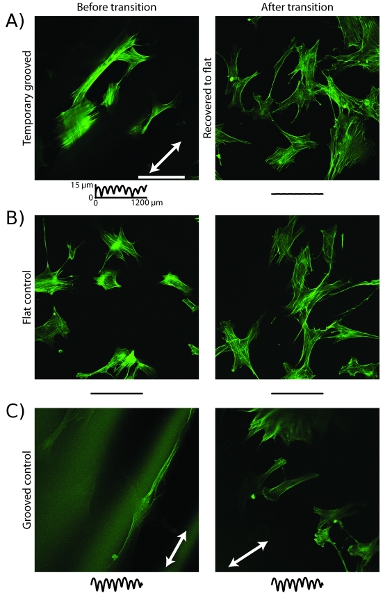
Figure 5: cytosquelette d'actine cellulaire réorganise suite de la transition topographique une des images, confocale de cellules marquées avec la phalloïdine sur des substrats en relief montrent microfilaments aligné avec la direction rainure (flèche blanche) avant de transition et d'augmenter la température.. Après la transition, les microfilaments sont réarrangés sont orientées de façon aléatoire. B, les cellules sur des substrats de contrôle plate montrent microfilaments orientés de façon aléatoire, avant et après augmentation de la température. C, les cellules sur des substrats de contrôle rainuré montrent microfilaments aligné avec la direction sillon avant et après augmentation de la température. La barre d'échelle est de 100 um. Les traces sont comme dans la Figure 4.
Discussion
La T g de NOA63 peut être facilement contrôlée via la température de cuisson. Nous avons utilisé ce pour générer des substrats SMP qui peut être déclenchée dans une plage de cellules compatibles. NOA63 est plastifié par l'eau qui abaisse le sèche T g, donc nous avons augmenté le sec T g par cuisson à 125 ° C pour déplacer la plage mouillée Tg entre 30 et 37 ° C.
Les substrats de culture de cellules actives démontré sont capables de con...
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier Kelly A. Burke pour une assistance technique à la préparation du substrat ACC. Basé sur l'article publié dans les biomatériaux, Davis KA, et al, le comportement des cellules à mémoire de forme dynamique sur substrats polymères, biomatériaux, doi:. 10.1016/j.biomaterials.2010.12.006, Copyright Elsevier (2011). Ce matériel est basée sur des travaux soutenus par la NSF sous Grant No. DMR-0907578.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif ou d'un instrument | Société | Numéro de catalogue | Commentaires (optionnel) |
| NOA63 | Norland Products Inc | NOA63 | Numéro de lot 111 |
| Dogbone punch | TestResource, Inc Shakopee, MN | À échelle réduite de type IV DogBone (ASTM D638-03) | |
| Benchtop presse hydraulique | Sculpteur | 3851 | |
| C3H10T1 / 2 Souris fibroblastes embryonnaires | ATCC | CCL-226 | |
| Cabinet de sécurité biologique | Thermo Fisher | 1357 | |
| Lampe UV | Spectroline | SB-100PC | |
| Dynamique Analyseur mécanique (DMA) | TA Instruments, Inc | Q800 | |
| Microscope à fluorescence inversé | Leica | Leica DMI 4000B | |
| Microscope confocal à balayage laser | Zeiss | LSM 710 | 20x/0.8 NA air ou un objectif 40x/1.30 huile NA |
Références
- Liu, C., Qin, H., Mather, P. T. Review of progress in shape-memory polymers. J. Mater. Chem. 17, 1543-1543 (2007).
- Mather, P. T., Luo, X. F., Rousseau, I. A. Shape Memory Polymer Research. Annu. Rev. Mater. Res. 39, 445-445 (2009).
- Lendlein, A., Kelch, S. Shape Memory Polymers. Angew. Chem. Int. Edit. 41, 2034-2034 (2002).
- Ratna, D., Karger-Kocsis, J. Recent advances in shape memory polymers and composites: a review. J. Mater. Sci. 43, 254-254 (2008).
- Rousseau, I. A. Challenges of shape memory polymers: A review of the progress toward overcoming SMP's limitations. Polym. Eng. Sci. 48, 2075-2075 (2008).
- Pelham, R. J., Wang, Y. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad. Sci. U. S. A. 94, 13661-13661 (1997).
- Addae-Mensah, K. A., Kassebaum, N. J., Bowers, M. J., Reiserer, R. S., Rosenthal, S. J., Moore, P. E., Wikswo, J. P. A flexible, quantum dot-labeled cantilever post array for studying cellular microforces. Sensor Actuat. a-Phys. 136, 385-385 (2007).
- du Roure, O., Saez, A., Buguin, A., Austin, R. H., Chavrier, P., Siberzan, P., Ladoux, B. Force mapping in epithelial cell migration. Proc. Natl. Acad. Sci. U. S. A. 102, 2390-2390 (2005).
- Lam, T., Clem, W. C., Takayama, S. Reversible on-demand cell alignment using reconfigurable microtopography. Biomaterials. 29, 1705-1705 (2008).
- Stevens, M. M., George, J. H. Exploring and engineering the cell surface interface. Science. 310, 1135-1135 (2005).
- Tan, L., Tien, J., Pirone, D. M., Gray, D. S., Bhadriraju, K., Chen, C. S. Cells lying on a bed of microneedles: an approach to isolate mechanical. 100, 1484-1484 (2003).
- Teixeira, A. I., Nealey, P. F., Murphy, C. J. Responses of human keratocytes to micro- and nanostructured substrates. J. Biomed. Mater. Res. A. 71A, 369-369 (2004).
- Yang, M., Sniadecki, N., Chen, C. Geometric Considerations of Micro- to Nanoscale Elastomeric Post Arrays to Study Cellular Traction Forces. Adv. Mater. 19, 3119-3119 (2007).
- Zhao, Y., Zhang, X. Cellular Mechanics Study in Cardiac Myocytes Using PDMS Pillars Array. Sensor Actuat. a-Phys. 125, 398-398 (2006).
- DiOrio, A. M., Luo, X., Lee, K. M., Mather, P. T. A Functionally Graded Shape Memory Polymer. Soft Matter. 7, 68-68 (2011).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32, 2285-2285 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon