Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Criblage à haut débit activité endoglucanase fongique dans les Escherichia coli
Dans cet article
Résumé
Nous décrivons un faible coût, la méthode à haut débit pour le dépistage de l'activité endoglucanase fongiques E. coli. La méthode repose sur une lecture visuelle simple de la dégradation de substrat, ne nécessite pas de purification de l'enzyme, et est très extensible. Cela permet pour le dépistage rapide des grandes bibliothèques de variants enzymatiques.
Résumé
Cellulase enzymes (endoglucanases, cellobiohydrolases, et β-glucosidases) cellulose en sucres hydrolyser composante, qui à leur tour peuvent être convertis en une alcools carburants. Le potentiel d'hydrolyse enzymatique de la biomasse cellulosique pour fournir l'énergie renouvelable a intensifié ses efforts pour concevoir des cellulases pour 2 à combustible de production économique. D'intérêt particulier sont les cellulases fongiques 3-8, qui sont déjà utilisées industriellement pour les aliments et le traitement des textiles.
Identifier les variantes actives parmi une bibliothèque de cellulases mutant est critique pour le processus d'ingénierie; mutants actifs peuvent encore être testés pour des propriétés améliorées et / ou soumis à une mutagenèse supplémentaire. Ingénierie efficace des cellulases fongiques a été entravée par un manque d'outils génétiques pour les organismes indigènes et par des difficultés à exprimer les enzymes dans des hôtes hétérologues. Récemment, Morikawa et collègues a développé une méthode pour exprimer dans E. coli les domaines catalytiques des endoglucanases de H. jecorina 3,9, un champignon industriel important avec la capacité à sécréter de grandes quantités de cellulases. Fonctionnelle E. l'expression coli a aussi été rapportés pour des cellulases à partir d'autres champignons, y compris Macrophomina phaseolina 10 et Phanerochaete chrysosporium 11-12.
Nous présentons une méthode de criblage à haut débit de l'activité endoglucanase fongiques dans E. coli. (Fig 1) Cette méthode utilise la commune microbienne colorant rouge Congo (RC) pour visualiser la dégradation enzymatique de la carboxyméthylcellulose (CMC) par les cellules en croissance sur milieu solide. Le dosage de l'activité nécessite des réactifs peu coûteux, une manipulation minimale, et donne des résultats sans ambiguïté que les zones de dégradation («halos») sur le site de la colonie. Même si une mesure quantitative de l'activité enzymatique ne peut être déterminé par cette méthode, nous avons constaté que la taille de halo est corrélée avec l'activité enzymatique totale dans la cellule. Une caractérisation plus poussée des différents clones positifs déterminera, fitness relative des protéines.
Bactériens traditionnels dosages toute l'activité des cellules MCC / CR 13 impliquent versant CMC sur gélose contenant des colonies, qui est soumis à la contamination croisée, ou des cultures en incubation dans les puits d'agar CMC, qui se prête moins à grande échelle d'expérimentation. Nous rapportons ici un protocole amélioré qui modifie les méthodes de lavage existants 14 pour l'activité cellulase: cellules cultivées sur gélose CMC sont retirés avant la coloration CR. Notre protocole réduit considérablement la contamination croisée et est hautement évolutive, permettant le dépistage rapide de milliers de clones. En plus de H. enzymes jecorina, nous avons exprimé et projeté variantes endoglucanase de la aurantiacus Thermoascus et Penicillium decumbens (figure 2), ce qui suggère que ce protocole est applicable à partir d'enzymes une gamme d'organismes.
Protocole
1. La préparation des plaques de dépistage
- Ajouter 25g de milieu de croissance LB, l'agar 15g, et 1.5g carboxyméthylcellulose (CMC) substrat à l'eau distillée 1L, et autoclave pour stériliser.
- Après autoclavage, permettra à moyen et à refroidir et ajouter des antibiotiques appropriés, et IPTG à une concentration finale de 100 microns.
- Verser 200 ml chacun en moyenne cinq grandes boîtes de Pétri carrées / plateaux bioessai (240 x 240 x 20mm ou plus). Laisser sécher complètement les plaques.
2. Génération de bibliothèques et de l'écran endoglucanase
- Générer une bibliothèque de domaine catalytique endoglucanase (s). Ceci peut être accompli de plusieurs façons (par exemple, dirigée vers un site ou de mutagenèse aléatoire, la recombinaison, etc) et est déterminé par le chercheur.
- Clone de la bibliothèque dans un vecteur de telle sorte qu'ils sont sous le contrôle du promoteur T7 avec l'opérateur lac, et contiennent une séquence signal pelB pour cibler le périplasme. Un exemple d'un vecteur approprié est pET22b (+) de Novagen.
- Transformez la bibliothèque endoglucanase en E. coli souche BL21 (DE3) et la plaque pour les colonies isolées.
- Incuber la transformation nuit à 37 ° C.
- En utilisant des cure-dents stérile, inoculer des clones en plaques de 96 puits profonds puits contenant du milieu LB 400μL complétée par des antibiotiques appropriés. Incuber à 37 ° C pendant une nuit sous agitation à 250 rpm.
- Ajouter du glycérol stérile à 96 cultures et nuit à une concentration finale de 10% pour stockage à long terme à -80 ° C. Ce sera la plaque maître.
- En utilisant un timbre de 96 broches, de reproduire les cultures plaque de nuit sur les plaques de dépistage contenant IPTG et CMC. Jusqu'à 5 ensembles de cultures d'une nuit peut être estampillé sur chaque plaque de blindage.
- Étiquette les plaques de dépistage afin que l'identité et l'orientation de chaque plaque 96 puits est connu.
- Incuber les bibliothèques estampillé à la température ambiante (17-25 ° C) pendant la nuit ou jusqu'à ce que des colonies visibles sont formées.
- Rincer la plaque avec de l'eau distillée jusqu'à ce que toutes les traces des colonies sont supprimés.
- Verser le rouge Congo (RC, 0,5% dans l'eau) sur la plaque de lave. Assurez-vous d'ajouter juste assez pour couvrir les CR de la plaque.
- Incuber 15 minutes à température ambiante. Ne pas dépasser 15 minutes d'incubation CR. Temps d'incubation plus longue se traduira par des halos moins distinctes.
- Décanter CR et ajouter une quantité généreuse (plus que suffisant pour couvrir la plaque) de NaCl 1M.
- Incuber 15 minutes à température ambiante.
- Décanter NaCl à révéler des halos de dégradation de CMC. Pour une meilleure résolution des halos, des temps d'incubation plus longue avec du NaCl ou plusieurs lavages de NaCl peut être nécessaire.
- Utiliser un cure-dent stérile, prélever actifs clones enzymes de la plaque de maître pour une caractérisation plus poussée.
3. Les résultats représentatifs:
Un exemple de l'affichage de cet écran à haut débit est montré dans la figure 3. Les clones peuvent être identifiés comme inactifs, peu active, et très active basée sur la taille des zones de dégradation. Ceci est particulièrement utile si une enzyme d'activité connue est inclus dans la bibliothèque comme une référence. Comme illustré ici, l'identification des enzymes actives est robuste et reproductible. Toutefois, s'il vous plaît être conscient que l'étiquetage adéquat des plaques de blindage est extrêmement important. Le chercheur doit être capable d'identifier des variants actifs après le lavage des colonies de suite, afin de les ramasser de la plaque de master stocké à -80 ° C pour une caractérisation plus poussée. Enfin, il est difficile d'évaluer a priori la relation entre les activités sur des substrats artificiels vs naturel. Par conséquent, le chercheur doit tester tous les clones positifs sur le matériel industriellement pertinents pour déterminer l'aptitude des protéines.
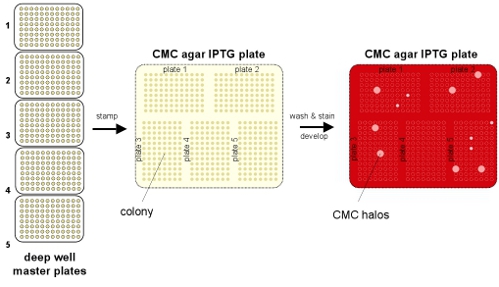
Figure 1. Aperçu schématique de la procédure de dépistage. Les cellules sont transformées avec une bibliothèque de endoglucanase et plaquées de manière sélective pour des colonies isolées. Les clones choisis et cultivés pendant une nuit dans 96 puits profond plaques bien pour (1) de stockage à -80 ° C et (2) placage de réplique sur des plaques contenant des CMC et IPTG pour induire l'expression endoglucanase. Clones actifs sont repris de la plaque de master stocké à -80 ° C.

Figure 2. Clonage et l'expression de champignons domaines catalytiques dans E. coli. (A) vecteur d'expression endoglucanase. Les gènes ont été clonés dans pET22b (+) (Novagen) sous le contrôle du promoteur T7. (B) Panneau de droite: endoglucanase exprimant BL21 (DE3) colonies. Panneau de gauche: des halos de dégradation de CMC après le lavage et le développement avec le Congo-Rouge.
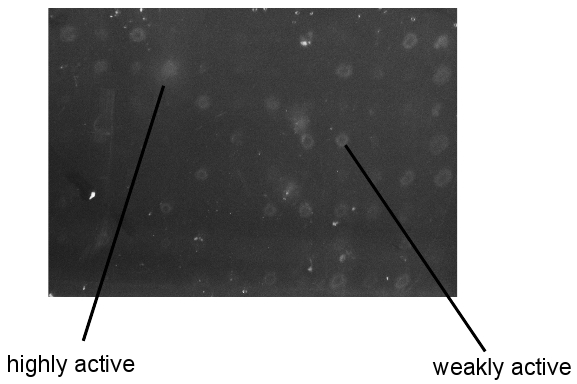
Figure 3. Exemple de résultats CMC / Congo écran rouge. Photos prises de plaques de dépistage après le lavage et le Congo-Rouge de développement. Toutes les colonies sur splaques creening étaient de taille similaire.
Discussion
Le protocole décrit ici permet l'identification rapide et de haute débit d'enzymes actives, avec une manipulation minimale. Détection d'activité est assez sensible, et reflète qualitativement la quantité d'activité au sein de la cellule. Sa facilité d'utilisation rend cette méthode convient à un large éventail de bibliothèques enzyme, seulement limité par l'expression fonctionnelle dans E. coli. Par ailleurs, le dépistage de ce type d'activité n'est pas limitée au...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été financé par la Gordon and Betty Moore Foundation, et par l'Initiative UNCF / Merck sciences.
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs | Société | Numéro de l'article | |
|---|---|---|---|
| IPTG | Sigma | I1284 | |
| Rouge Congo | Sigma | C6277 | |
| Carboxyméthylcellulose | Sigma | 360384 | |
| NaCl | Sigma | S1679 | |
| Bacto-agar | BD Biosciences | 214030 | |
| Plaques d'essais biologiques | Thermo Scientific | 240845 |
Références
- Atsumi, S., Hanai, T., Liao, J. C. Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. Nature. 451, 86-89 (2008).
- Wilson, D. B. Cellulases and biofuels. Curr Opin Biotechnol. 20, 295-299 (2009).
- Qin, Y. Engineering endoglucanase II from Trichoderma reesei to improve the catalytic efficiency at a higher pH optimum. J Biotechnol. 135, 190-195 (2008).
- Nakazawa, H. Directed evolution of endoglucanase III (Cel12A) from Trichoderma reesei. Appl Microbiol Biotechnol. 83, 649-657 (2009).
- Heinzelman, P. A family of thermostable fungal cellulases created by structure-guided recombination. Proc Natl Acad Sci. 106, 5610-5615 (2009).
- Heinzelman, P. SCHEMA recombination of a fungal cellulase uncovers a single mutation that contributes markedly to stability. J Biol Chem. 284, 26229-26233 (2009).
- Lantz, S. E. Hypocrea jecorina CEL6A protein engineering. Biotechnol Biofuels. 8, 3-20 (2010).
- Mahadevan, S. A. Site-directed mutagenesis and CBM engineering of Cel5A (Thermotoga maritima). FEMS Microbiol Lett. 287, 205-211 (2008).
- Nakazawa, H. Characterization of the catalytic domains of Trichoderma reesei endoglucanase I, II, and III, expressed in Escherichia coli. Appl Microbiol Biotechnol. 81, 681-689 (2008).
- Wang, H., Jones, R. W. Properties of the Macrophomina phaseolina endoglucanase (EGL 1) gene product in bacterial and yeast expression systems. Appl Biochem Biotechnol. 81, 153-160 (1999).
- Howard, R. L. Enzyme activity of a Phanerochaete chrysosporium cellobiohydrolase (CBHI.1) expressed as a heterologous protein from Escherichia coli. Afr J Biotechnol. 2, 296-300 (2003).
- Howard, . Characterisation of a chimeric Phanerochaete chrysosporium cellobiohydrolase expressed from Escherichia coli. Afr J Biotechnol. 3, 349-352 (2004).
- Teather, R. M., Wood, P. J. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl Env Microbiol. 43, 777-780 (1982).
- Gilkes, N. R. Mode of action and substrate specificities of cellulases from cloned bacterial genes. J Bio Chem. 259, 10455-10459 (1984).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon