Method Article
Micro-ondes assistée diagnostic rapide des maladies virales des plantes par microscopie électronique à transmission
Dans cet article
Résumé
Cette étude décrit une méthode qui permet le diagnostic rapide et claire des maladies à virus des plantes en une demi-journée à l'aide d'une combinaison de micro-ondes usine de préparation d'échantillons assistée par microscopie électronique à transmission et les méthodes de coloration négative.
Résumé
Les enquêtes sur les modifications ultrastructurales induites par les virus sont souvent nécessaires pour identifier clairement les maladies virales chez les plantes. Avec une préparation d'échantillon conventionnel pour microscopie électronique à transmission (MET) de telles enquêtes peut prendre plusieurs jours 1,2 et ne sont donc pas adapté pour un diagnostic rapide des maladies à virus des plantes. Fixation à micro-ondes peut être utilisé pour réduire considérablement le temps de préparation d'échantillons pour les enquêtes TEM avec des résultats similaires à ceux observés ultrastructurales après préparation des échantillons conventionnelle 3-5. Beaucoup de différents dispositifs sur mesure à micro-ondes faites sont actuellement disponibles qui peuvent être utilisés pour la fixation réussie et l'intégration des échantillons biologiques pour les enquêtes TEM 5-8. Dans cette étude, nous montrons sur le virus de la mosaïque du tabac (TMV) infecté plantes de Nicotiana tabacum qu'il est possible de diagnostiquer des altérations ultrastructurales dans les feuilles en une demi-journée à l'aide de la préparation des échantillons à micro-ondes assistée pour TEM. Nous avons choisi de réaliser cette étude avec un appareil à micro-ondes disponible dans le commerce car il effectue la préparation des échantillons presque entièrement automatiquement 5 à la différence des autres appareils disponibles, où de nombreuses étapes doivent encore être effectuées manuellement 6-8 et sont donc plus de temps et beaucoup de travail. En préparation de l'échantillon est effectuée de manière entièrement automatique coloration négative de particules virales dans la sève des autres TMV feuilles infectées et l'examen suivant de l'ultrastructure et la taille peut être effectuée lors de la fixation et l'inclusion.
Protocole
Préparation de l'échantillon à micro-ondes assistée
- Avant le début de la préparation des échantillons doit programmer le processeur micro-ondes automatique des tissus pour la microscopie électronique (EM AMW Leica, Leica Microsystems, Vienne, Autriche) avec les protocoles suivants (tableau 1) pour la préparation d'échantillons pour le TEM micro-ondes assistée:
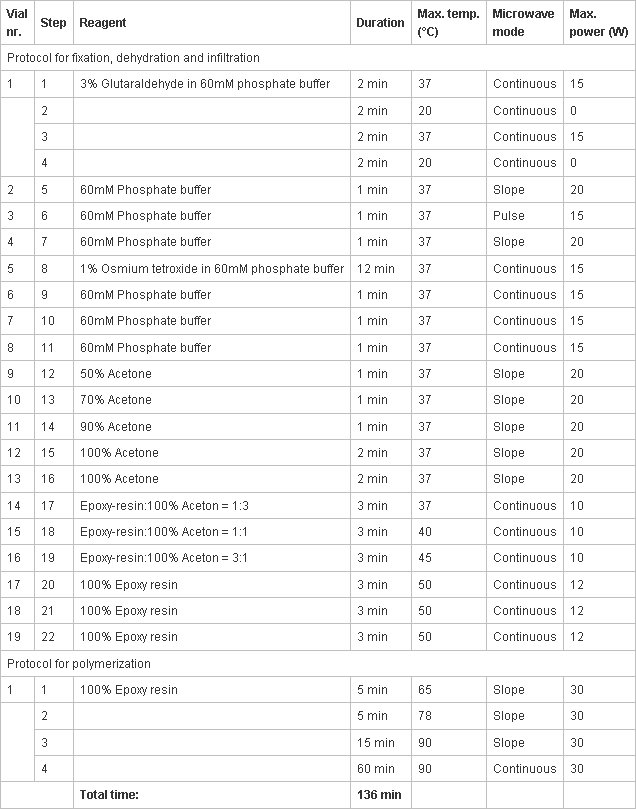
Tableau 1. Protocole de préparation de l'échantillon en utilisant un rayonnement micro-ondes. Les différentes colonnes indiquent (de gauche à droite):- Nombre flacon (nr Vial.) Représente l'ordre dans lequel le flacon est chargé dans le carrousel du processeur.
- Étape du processus réel.
- Réactifs dans les flacons.
- Durée de l'étape actuelle.
- La température maximale qui est atteinte dans le flacon avant l'irradiation micro-ondes est mis hors tension.
- Réglage irradiation micro-ondes: Continu = incrément rapide de la températurease, maintien de la température de consigne; Pente = augmentation de la température douce, la température finale atteinte à la fin; pulsé = augmentation rapide de la température, il s'est éteint jusqu'à ce que la température baisse de 5 ° C, la puissance repris pour atteindre la température.
- Puissance maximale de l'irradiation micro-ondes.
- Fraîchement préparer les solutions pour les différentes étapes décrites dans le protocole de préparation d'échantillon (pour résine époxy Agar 100 voir 1.7), les remplir dans les flacons désignés selon le protocole programmé (tableau 1), charger les flacons sur le carrousel, puis insérez le carrousel dans le traitement des tissus à micro-ondes, et finalement charger le premier flacon dans la chambre de mono-mode.
- Découpez de petites sections de feuilles (1mm 2) de Nicotiana tabacum infectée par le virus de la mosaïque du tabac (TMV) avec une lame de rasoir sur une plaque de cire à modeler dans une goutte de glutaraldéhyde à 3% (Agar Scientific Ltd, Stansted, Angleterre) dans 60 mM Sørensen tampon phosphate (pH 7,2) à la température ambiantetérature.
- Transférer les sections fines avec des pincettes tout de suite dans les paniers désignés avec une largeur de maille d'environ 200 um. Empiler les paniers les uns sur les autres et de les insérer dans la chambre de mono-mode. Il faut veiller à ce que les échantillons sont constamment couvertes de la solution de fixation pendant le chargement et l'empilage des paniers afin qu'ils ne se dessèchent pas.
- Démarrer le micro-ondes préalablement programmé assistée protocole de préparation des échantillons pour la fixation, la déshydratation et l'infiltration.
- Alors que la préparation des échantillons est effectuée automatiquement par le processeur tissu micro-ondes continuer avec coloration négative avec la matière végétale restante comme décrit dans la section 3 (coloration négative).
- Fraîchement préparer résine époxy Agar 100 en mélangeant les composants suivants comme décrit: remplissage 24g Agar 100, 16g d'anhydride succinique dodécényle, et 10 g d'anhydride méthyl nadique (pour toutes les composantes voir Agar Scientific Ltd, Stansted, Angleterre) dans un gobelet en plastique, chaleur elle à40 ° C et bien mélanger. Ajouter 1,2 g de benzyldiméthylamine et bien mélanger. Remplir de résine époxy Agar 100 dans la polymérisation désigné se forme juste avant le protocole de préparation de l'échantillon arrive à son terme (par exemple, lors de l'étape 22 dans le tableau 1).
- Une fois le protocole terminé (après l'étape 22 dans le tableau 1) libérer les paniers empilés contenant les échantillons infiltrés à partir de la chambre de mono-mode dans le dernier flacon du carrousel. Retirez le carrousel de l'appareil à micro-ondes, dépiler les paniers et les charger à l'aide de pinces fines dans les formes polymérisation désignés. Il faut veiller à ce que les échantillons sont toujours recouverts de résine époxy Agar 100 au cours de dépilage et le chargement de sorte qu'ils ne se dessèchent pas.
- Empiler les formulaires de polymérisation au-dessus de l'autre. Il faut veiller à ce que les échantillons sont toujours recouverts de résine époxy Agar 100 lors de l'empilage et de chargement afin qu'ils ne se dessèchent pas.
- Retirer les flacons utilisés précédemment dans le carrousel de la micro-onde tissue processeur, chargez-le avec les paniers empilés et insérez le carrousel dans le traitement des tissus à micro-ondes.
- Démarrez le protocole de polymérisation précédemment programmé (tableau 1).
- Alors que la polymérisation est effectuée automatiquement par le processeur tissu micro-ondes, d'examiner les grilles colorées négativement avec un microscope électronique à transmission [par exemple Philips CM10 TEM, FEI (anciennement Philips), Eindhoven, Pays-Bas] et effectuez l'analyse d'image comme décrit dans la section 3 et 4 ( coloration négative et analyse d'image).
- Après le protocole est terminée, retirez les formes de polymérisation de la chambre de mono-mode, dépiler les formes de polymérisation et enlever les blocs polymérisés contenant les échantillons. Ils sont maintenant prêts à être sectionné avec un microtome.
2. Découper et de sectionnement
- Insérez un ou plusieurs blocs dans des porte-échantillons distincts pour la coupe ultra fin avec l'échantillon sur le collage supérieure d'environ 1 cm de la porte.
- Coupez le bloc avec une tondeuse échantillon pour TEM (par exemple Leica Reichert Ultratrim; Leica Microsystems) de sorte qu'une face du bloc de max. 1 mm de longueur et 200 um de largeur, qui contient du matériel foliaire autant que possible est atteint (la taille du bloc visage pourrait être nécessaire d'ajuster à la taille du couteau de diamant).
- Section du bloc avec un ultramicrotome (par exemple Reichert Leica Ultracut S; Leica Microsystems) à l'aide d'un couteau de diamant à un angle de 45 ° couteau (p. ex Diatome Ultra 45, Gröpl, Tulln, Autriche). L'épaisseur de coupe doit être réglé à environ 70 à 90 nm et la vitesse de coupe doit être d'environ 1 mm / s. Procurez-vous plusieurs sections avec un formvar (Agar Scientific Ltd) recouvert de cuivre ou de nickel 200 grille à mailles carrées.
- Post-tacher les sections sur la grille avec du citrate de plomb (Agar Scientific Ltd; citrate de plomb dissous dans 42ml 1.1g eau bidistillée et 8ml NaOH 1N) pendant 5 minutes dans une boîte de Pétri partiellement remplis avec du NaOH pour créer une émission de CO 2 l'environnement et pour 15 kmnutes avec de l'acétate d'uranyle 1% (Agar Scientific Ltd) dissous dans de l'eau distillée à température ambiante. Laver les grilles avec de l'eau distillée pendant 1 minute entre chaque étape de post-coloration. Sécher à l'air les grilles dans une maille.
- Examiner les sections avec un microscope électronique à transmission (TEM par exemple Philips CM10, FEI, Eindhoven, Pays-Bas).
3. Coloration négative
- Récolte environ 100 mg de TMV-infecté des feuilles et préparer sève brute en homogénéisant le matériel pendant 2 minutes avec une lame de rasoir sur une lame de microscope dans 100 ul de 60 mM de tampon phosphate Søfrensen (pH 7,2).
- Transfert 20 pi de l'homogénat obtenu sur le premier puits d'une lame de microscope enduite de téflon avec 4 ou plusieurs puits (en variante, il est également possible de transférer le broyat sur un morceau de parafilm).
- Placer une grille formvar revêtu sur le dessus de l'homogénat avec la formvar (Agar Scientific Ltd) côté enduit tournée vers la goutte et incuil bate de 5 minutes.
- Laver la grille 2 fois pendant 2 minutes chacun en plaçant la grille au-dessus de deux gouttes de 200 pl 60 mM Sørensen tampon phosphate (pH 7,2).
- Incuber la grille pendant 1 minute avec un acide phosphotungstique fraîchement préparée de 2% (Agar Scientific Ltd) en solution dans 60 mM Sørensen tampon phosphate (pH 6,5).
- Retirez la grille et le laisser sécher à l'air dans une maille.
- Examinez la grille avec un microscope électronique à transmission (par exemple Philips CM10 TEM; FEI, Eindhoven, Pays-Bas). Prendre au moins 10 images de virions choisis au hasard coloration négative (au moins 10 ou plus virions doit être visible sur chaque image) avec le microscope électronique à transmission à un grossissement primaire de 21000X ou plus. Il faut veiller à ce que toutes les images ont le même grossissement.
4. L'analyse d'image
- Mesurer la longueur et la largeur d'au moins 100 particules de virus choisis au hasard simples sur les micrographies réalisées à partir deles échantillons colorées négativement à l'aide de n'importe quel logiciel d'analyse d'images [Cell par exemple D (Olympus, Vie et Sciences des Matériaux Europe GmbH, Hamburg, Allemagne) avec l'outil d'analyse de particules ou Optimas 6.5.1-(Media Cybernetics Inc, Bethesda, Maryland, USA)].
- Calculer les moyennes et les écarts types pour atteindre une longueur moyenne et la largeur des particules virales visualisés par coloration négative méthodes et TEM.
- Comparer la longueur et des caractéristiques ultrastructurales (obtenu en 2.5) avec des tailles de virus et des altérations ultrastructurales induites par les maladies virales connues dans la littérature afin d'identifier clairement les maladies virales.
5. Les résultats représentatifs:
Après avoir assisté à micro-ondes de préparation des échantillons typiques TMV-induites modifications ultrastructurales tels que grandes surfaces contenant des virions alignés sous forme parallèle a pu être observée au microscope électronique à transmission dans le cytosol des personnes infectées Nicotianquelques cellules tabacum (figure 1A). En outre, dans la sève brute de TMV-infecté laisse particules TMV a pu être observé que flexueux, en forme de bâtonnets structures après coloration négative (figure 1B). Analyse de l'image de 100 particules virales ont révélé une taille moyenne de 280 nm pour TMV en longueur et en largeur 17Nm (figure 2). L'ultrastructure de cellules infectées par le TMV et la taille des virions observés dans cette étude ont été jugés en conformité avec TMV propriétés induites par le tabac et ultrastructurales dans la gamme de taille de particules TMV précédemment rapportés dans la littérature 9-15.
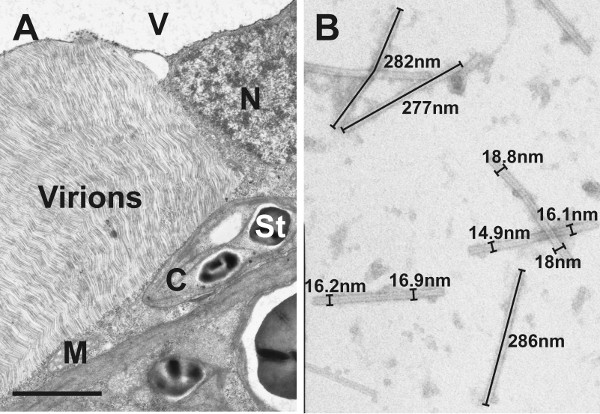
Figure 1. Micrographies électroniques à transmission de cellules infectées par le TMV feuilles et des virions. A) L'image montre l'ultrastructure des cellules infectées par le TMV feuilles mésophylle de Nicotiana tabacum après-ondes usine de préparation d'échantillons assistée. Notez la grande région de virions parallèles alignés qui se sont accumulés dans le cytosol.C = chloroplastique avec de l'amidon (St), M = mitochondrie, N = noyau, V = vacuole, Bar = 2 pm. B) L'image montre des virions qui ont été détectées par coloration négative dans la sève des feuilles infectées.
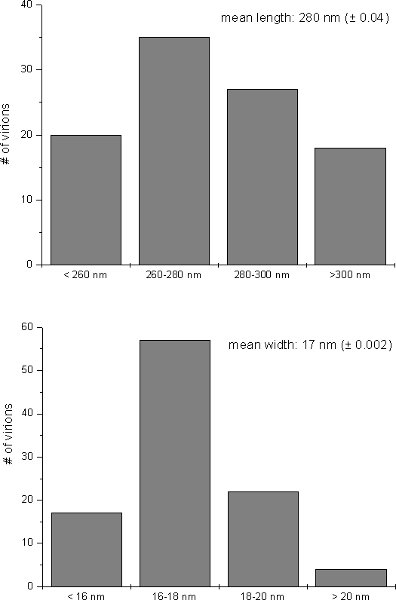
Figure 2. Taille relative des virions. Distribution relative de la longueur et la largeur de TMV-particules après coloration négative la sève des feuilles infectées telles qu'elles figuraient dans le microscope électronique. Les valeurs moyennes (moyenne longueur / largeur ± écart-type) ont été calculés à partir de 100 virions.
Discussion
Micro-ondes préparation assistée échantillon de plante pour le TEM a été prouvé à fournir des données rapide et fiable ultrastructurales dans les quelques heures 3,4,16. La préservation structurale fine des organites et membranes obtenus avec la méthode utilisée dans cette étude était similaire aux échantillons conventionnels et cryofixed 5,15 avec l'avantage d'une réduction massive de la fixation de l'échantillon et l'incorporation de temps de 3 jours ou plus pour environ 2 heures. Cela représente le protocole le plus rapide de préparation des échantillons pour le TEM actuellement disponibles dans la littérature. La méthode décrite dans cette étude a combiné micro-ondes préparation assistée échantillon de plante pour le TEM aux méthodes de coloration négative qui a permis une identification claire et rapide de TMV-induites modifications ultrastructurales et l'agent viral lui-même. TMV modifications ultrastructurales induites pourraient être étudiés après la coupe, de sectionnement et de post-marquage pendant environ 4 heures après le début de la fixation de la transmission électron microscope. Utilisation de la manière entièrement automatique en mode de préparation des échantillons libéré le chercheur pour mener coloration négative dans l'intervalle afin de déterminer la taille et la largeur de l'agent viral. Ainsi, nous pouvons conclure que cette méthode permet un diagnostic clair et rapide des maladies à virus des plantes en une demi-journée qui est d'une grande importance pour une utilisation future dans des expériences agricoles et scientifiques des plantes phytopathologie. Comme cette méthode pourrait également être utilisée pour le diagnostic rapide des maladies animales et humaines qu'il a un grand potentiel pour des applications futures dans le domaine médical et de pathologie vétérinaire.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par le Fonds autrichien pour la science (FWF, P20619 P22988 et à BZ).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipement | Entreprise | Numéro de catalogue | Commentaires |
| Glutaraldéhyde | Agar Scientific Ltd | R1312 | |
| Tétroxyde d'osmium | Agar Scientific Ltd | R1022 | |
| 100 agar résine | Agar Scientific Ltd | R1043 | |
| L'anhydride dodécénylsuccinique | Agar Scientific Ltd | R1051 | |
| L'anhydride méthyl nadique | Agar Scientific Ltd | R1081 | |
| Benzyldiméthylamine | Agar Scientific Ltd | R1060 | |
| Citrate de plomb | Agar Scientific Ltd | R1210 | |
| L'acétate d'uranyle | Agar Scientific Ltd | R1260A | |
| L'acide phosphotungstique | Agar Scientific Ltd | R1213 | |
| Formvar | Agar Scientific Ltd | R1202 | |
| Leica EM AMW | Leica Microsystems | ||
| Leica (Reichert) Ultratrim | Leica Microsystems | Modèle plus récent est disponible | |
| Leica (Reichert) Ultracut S | Leica Microsystems | Modèle plus récent est disponible | |
| Diatome Ultra 45 | Gröpl | ||
| Philips CM10 TEM | FEI (anciennement Philips) | Modèle plus récent est disponible | |
| La cellule D | Olympus Inc | ||
| Optima 6.5.1 | Media Cybernetics Inc | Une version plus récente est disponible | |
Références
- Bozzola, J. J., Russell, D. . Electron Microscopy. , (1999).
- Kuo, J., Kuo, J. Processing plant tissues for ultrastructural study. Methods in Molecular Biology, Electron Microscopy, Methods and Protocols. 369, 47-65 (2007).
- Schroeder, J. A., Gelderblom, H. R., Hauroeder, B., Schmetz, C., Milios, J., Hofstaedter, F. Microwave-assisted tissue processing for sameday EM-diagnosis of potential bioterrorism and clinical samples. Micron. 37, 577-590 (2006).
- Webster, P., Kuo, J. Microwave-assisted processing and embedding for transmission electron microscopy. Methods in Molecular Biology, Electron Microscopy, Methods and Protocols. 369, 47-65 (2007).
- Zechmann, B., Zellnig, G. Microwave assisted rapid plant sample preparation for transmission electron microscopy. J. Microsc. 233, 258-268 (2009).
- Lería, F., Marco, R., Medina, F. J. Structural and antigenic preservation of plant samples by microwave-enhanced fixation, using dedicated hardware, minimizing heat-related effects. Micr. Res. Techniq. 65, 86-100 (2004).
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastruct. Pathol. 27, 187-196 (2003).
- Cavusoglu, I., Minbay, F. Z., Temel, S. G., Noyan, S. Rapid polymerisation with microwave irradiation for transmission electron microscopy. Eur. J. Morph. 39, 313-317 (2001).
- Ermolina, I., Morgana, H., Greena, N. G., Milnerb, J. J., Feldmanc, Y. Dielectric spectroscopy of tobacco mosaic virus. Biochim. Biophys. Acta. 1622, 57-63 (2003).
- Maeda, H. An atomic force microscopy study for the assembly structures of tobacco mosaic virus and their size evaluation. Langmuir. 13, 4150-4161 (1997).
- Milne, R. G. Multiplication of tobacco mosaic virus in tobacco leaf palisade cells. Virology. 28, 527-532 (1966).
- Reunov, A. V., Gnutova, I. V., Lapshina, L. A. Effect of tobacco mosaic virus strains on the ultrastructure of tobacco leaf parenchymal cells. Biol. Bull. 33, 409-415 (2006).
- Sachse, C., Chen, J. Z., Coureux, P. D., Stroupe, M. E., Fändrich, M., Grigorieff, N. High-resolution electron microscopy of helical specimens: a fresh look at tobacco mosaic virus. J. Mol. Biol. 371, 812-835 (2007).
- Smith, M. L., Lindbo, J. A., Dillard-Telm, S., Brosio, P. M., Lasnik, A. B., McCormick, A. A., Nguyen, L. V., Palmer, K. E. Modified tobacco mosaic virus particles as scaffolds for display of protein antigens for vaccine applications. Virology. 348, 475-488 (2006).
- Zechmann, B., Zellnig, G. Rapid TEM diagnosis of plant virus diseases. J. Virol. Meth. 162, 163-169 (2009).
- Giberson, R. T., Demaree, R. S. Microwave processing techniques for electron microscopy: a four-hour protocol. Meth. Molec. Biol. 117, 145-158 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon