Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Introduction à l'échographie destruction des microbulles ciblées Technique
Dans cet article
Résumé
Échographie destruction ciblée des microbulles (UTMD) peut être utilisé pour diriger spécifique au site de livraison de molécules bioactives, notamment des gènes thérapeutiques, pour cibler les organes accessibles à l'échographie, comme le cœur et le foie 1-6.
Résumé
En UTMD, molécules bioactives, comme chargée négativement vecteurs ADN plasmidique codant pour un gène d'intérêt, sont ajoutés à la coquille de lipides cationiques agents de contraste microbulles 7-9. Chez les souris ces microbulles vecteur de transport peut être administré par voie intraveineuse ou directement dans le ventricule gauche du cœur. Dans les grands animaux qu'ils peuvent aussi être perfusé par un cathéter intracoronaire. La livraison ultérieure de la circulation à un organe cible se fait par cavitation acoustique à une fréquence de résonance des microbulles. Il semble probable que l'énergie mécanique générée par les résultats de destruction des microbulles dans la formation de pores transitoires dans ou entre les cellules endothéliales de la microvascularisation de la région ciblée 10. En conséquence de cet effet sonoporation, l'efficacité de la transfection dans et à travers les cellules endothéliales est augmentée, et transgène vecteurs codant sont déposés dans les tissus environnants. L'ADN plasmidique restant dans la circulation est rapidement dégradé par les nucléases dans le sang, ce qui réduit encore la probabilité de la livraison à la non-soniqué tissus et conduit à très spécifique des organes cibles de la transfection.
Protocole
1. Préparation de la pâte de microbulles
- Dans 10 ml de PBS mélange de 200 mg de 1,2-dipalmitoyl-sn-glycéro-3-phosphatidylcholine et 50 mg 1,2-dipalmitoyl-sn-glycéro-3-phosphatidyléthanolamine avec 1 g de glucose.
- Chauffez le mélange au bain d'eau bouillante 20-30 minutes, une pipette mélangeant toutes les 5 minutes.
- La solution peut être conservé à 4 ° C pour un maximum de 6 mois.
2. Préparation des microbulles
- Prenez un ul 250 de la solution stock de microbulles préparée et incuber à 40 ° C pendant 15 minutes.
- La solution pré-chauffé microbulles est ensuite transféré dans un microtube de 1,5 ml contenant 50 ul de glycérol.
- 1-2 mg d'ADN plasmidique purifié codant pour une construction d'expression pour le gène d'intérêt (dans cet exemple purifiée par Qiagen endotoxines libres Bluetooth Megaprep, Qiagen, Germantown, MD, avec une concentration optimale de 4mg/ml). 2.4) du tampon phosphate salin est ajouté à un volume final de 500 pl. Endotoxines gratuitement maxipreps Qiagen sont utilisés, ainsi que du PBS stérile afin d'en garantir la stérilité.
- L'air dans le microtube est alors remplacé par du gaz Octafluoropropane.
- Le microtube est alors secoué vigoureusement dans un amalgamateur dentaire pour 20 secondes.
- Le subnatant ADN contenant résiduelle et le tampon qui n'a pas forcément les microbulles est ensuite soigneusement enlevé et la couche de microbulles est lavé trois fois avec du PBS stérile pour éliminer l'ADN seules, et placé sur la glace entre chaque cycle de lavage. Nous généralement atteindre une efficacité de liaison de 30-40%. Tous les réactifs sont stériles et les soins sont faits pour minimiser la contamination.
- Le plasmide d'ADN liés microbulles sont ensuite placés sur la glace pendant près de deux heures jusqu'à l'utilisation.
- Le subnatant retiré de la microtube après mélange et le PBS lavages, peut être utilisé pour déterminer la concentration de l'ADN non lié, et également le montant lié basé sur la concentration initiale connue, en mesurant la densité optique de cette solution à une longueur d'onde de 260 nm à l'aide un spectrophotomètre.
3. Étalonnage de l'équipement
- Avant la première utilisation, un transducteur de 1 MHz cavitation doit être calibré pour assurer un bon indice de mécanique et de répétition des impulsions. Un submersible de 1 MHz, 13mm, capteur flou est connecté à une fonction 20 MHz / Générateur de signaux arbitraires à travers un amplificateur de puissance.
- Le transducteur est placé dans un récipient en plastique rempli d'eau, visant directement à un hydrophone, qui a été relié à un oscilloscope 500 MHz via un amplificateur de charge.
- Waveform, fréquence, amplitude, le cycle de l'éclatement, et l'amplification de puissance peuvent tous être modifiés pour obtenir le cycle de travail approprié et index mécanique optimale à la cavitation des microbulles. Pour cette expérience particulière, nous avons calibré le système à un index mécanique équivalente à ~ 1,3 à 1 MHz.
4. Livraison & microbulles UTMD
- Avant la livraison de microbulles et UTMD, des souris C57BL / 6 ont été anesthésiés avec 100mg/kg kétamine et xylazine 5mg/kg par injection IP.
- La livraison des microbulles a été administré par voie intraveineuse par une injection directe dans le ventricule gauche du cœur ou par cathétérisme de la veine de la queue. Pour l'injection directe cardiaque, un volume de 100 ul du plasmide ADN chargés solution de microbulles est injecté par une aiguille de calibre 30 insérées à la partie antérieure 4 ème espace intercostal, sous visualisation par ultrasons dans le ventricule gauche du cœur.
- Le bolus solution de microbulles résultant de l'injection interventriculaire gauche est visualisée à l'aide de Visual Sonics 38 MHz de fréquence à ultrasons transducteur haute placée dans une position stationnaire sur le thorax de la souris dans une vue à long axe en utilisant VisualSonics système Vevo Imaging 2100. Toutes les seringues et les aiguilles sont stériles, assurant l'environnement le plus stérile possible pour ces injections.
- Immédiatement après l'injection, la destruction des microbulles est effectuée pour ~ 5 minutes à l'aide d'une seconde, plus petite taille basse fréquence 1,0 MHz transducteur lieu directement sur l'organe désiré, en ciblant la destruction de cette région. Dans cet exemple, l'échographie a été administré pour le foie à une fréquence de répétition des impulsions de 1,0 MHz, avec un équivalent de l'indice à environ 1.3 à 1.5 mécaniques, et la période de répétition des impulsions de 100 ms pour 20 cycles. Alternativement, le pouls peut être fermée à l'ECG de la souris (non montré dans cette expérience) pour une rafale de 3 images de l'échographie, tous les 4-6 cycles cardiaques. Nous obtenons une plus grande efficacité de la transfection avec des protocoles qui permettent au lit capillaire à recharger avec des bulles entre les salves d'ultrasons.
5. Livraison Méthode alternative
Nous avons choisi de mettre en évidence l'injection interventriculaire en raison de la complexité de la procédure, mais dans de nombreux cas, comme une perfusion prolongée de microbulles, une veine de la queue deprojection est la méthode préférée. Pour la méthode de la queue-veineuse de la livraison de microbulles, la souris est anesthésiée de la même façon. Une seringue contenant le plasmide d'ADN liés microbulles est relié à un cathéter de calibre 27 veine d'aiguille / queue. Le cathéter veine de la queue est insérée dans le tiers distal de la veine soit droite ou gauche latéral qui le long de la queue de la souris. La seringue contenant les microbulles est placée dans une pompe à perfusion qui administre automatiquement un volume uniforme prédéfini de solution sur une période de temps prédéterminée. En général, nous infuser 200-300μl à un taux de 3ml/hour.
L'utilisation d'animaux
Tous les animaux ont été traités conformément à la pratique des animaux de bonnes telles que définies par l'autorité nationale et / ou organismes locaux de protection des animaux, et tous les travaux d'animaux a été approuvé par le comité approprié (Université de Hawaï Soins des animaux et du Comité institutionnel utilisation, 07-100 numéro d'agrément -3). L'anesthésie appropriée (la kétamine / zylazine) a été utilisé et des analgésiques (bupivicaïne et buprénorphine) étaient disponibles, mais pas nécessaire.
6. Les résultats représentatifs:
L'efficacité de la livraison UTMD médiée par ADN plasmidique peut être évalué à travers une variété de méthodes selon les gènes codés dans la construction, tels que, mais non limité à, la luciférase imagerie in vivo, B-gal ex vivo coloration, et / ou immunohistologie. En particulier, dans l'imagerie par bioluminescence in vivo permet de surveiller la présence et la durée de l'expression des gènes chez les souris série transfectées avec un plasmide codant pour un gène rapporteur bioluminescent (luciférase). Le Xenogen l'imagerie in vivo du système (IVIS) (Caliper Life Sciences, Hopkinton, MA) est utilisé pour l'imagerie de bioluminescence. Les images sont généralement prises de toutes les souris du premier jour après la transfection médiée UTMD et est répété tous les trois à quatre jours jusqu'à l'expression des gènes de bioluminescence n'est plus détectable visuellement par le système (figure 1). Pour préparer les souris pour l'imagerie de bioluminescence, des souris d'abord recevoir une injection IP de la reporter de la luciférase de sonde D-luciférine (Caliper Life Sciences) et sont ensuite anesthésiés ~ 3 minutes plus tard. Biodistribution du substrat D-luciférine est autorisé à procéder pour ~ 10 minutes avant que l'animal est placé dans la chambre IVIS imagerie et un scan complet du corps image est prise. Lors de l'acquisition, les photons émis par la luciférase de luciole / D-luciférine réaction photochimique sont mesurés. La Figure 1 illustre également similaire IVIS imagerie bioluminescente du foie suivantes UTMD, et la figure 2 est une épifluorescence (100X) l'image du foie transfectées en utilisant un anticorps anti-luciférase primaire (Sigma-Aldrich) et AlexFluor-568 anticorps secondaire conjugué (Invitrogen) . Il est évident de voir que la transfection médiée UTMD foie a affecté non seulement les cellules endothéliales, mais le hepatocyes ainsi.
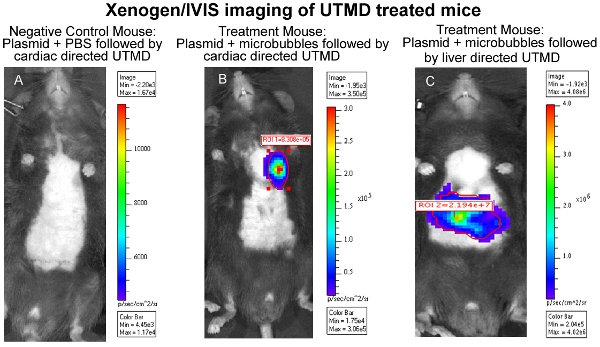
Figure 1 Xenogen / IVIS imagerie cardiaque UTMD souris traitées (A) Souris Contrôle négatif:.. Plasmidique + PBS suivie cardiaques dirigé UTMD, Souris traitement (B): Plasmide + microbulles suivie cardiaques dirigé UTMD, et la souris de traitement (C) : + microbulles plasmidique suivie par le foie dirigé UTMD.
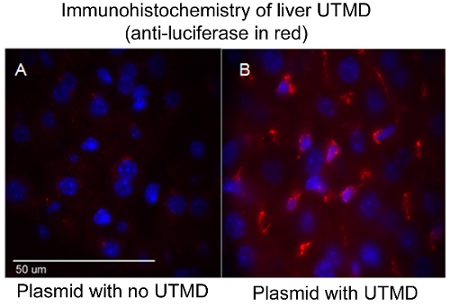
Figure 2. Immunohistochimie de foie UTMD (anti-luciférase en rouge) (A). Plasmidique sans UTMD, et (B) plasmide avec UTMD. Image confocale (100X); noyaux sont DAPI bleue tachée.
Discussion
UTMD représente une nouvelle approche pour la livraison de gènes. Comme une plateforme technologique qu'elle peut être combinée avec l'une des nombreuses stratégies possibles de la thérapie génique, pour offrir une multitude de molécules bioactives où un degré élevé de spécificité tissulaire est souhaitée. La principale limitation biologique de la technique est la faible efficacité de la transfection. Un autre facteur important est l'accessibilité de l'organe cible à l'échographie,...
Déclarations de divulgation
Remerciements
Subvention de soutien a inclus NHLBI HL080532, NHLBI HL073449, NCRR RR16453, et une nationale AHA Grant-in de l'aide (aux RVS). Un merci tout spécial est étendu à la conception de cours à distance et de conseil (DCDC) du groupe, dcdcgroup.org, pour leur aide à la production vidéo et à l'US Department of Education Grant No. P336C050047 qui a fondé la DCDC.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipements | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| 1,2-dipalmitoyl-sn-glycéro-3-phosphatidylcholine | Sigma-Aldrich | P-5911 | composante de l'enveloppe lipidique de microbulles |
| 1,2-dipalmitoyl-sn-glycéro-3-phosphatidyléthanolamine | Sigma-Aldrich | P-3275 | composante de l'enveloppe lipidique de microbulles |
| le glucose | Sigma-Aldrich | G5400 | pensé pour stabiliser les microbulles |
| tampon phosphate salin | Sigma-Aldrich | P5368 | |
| glycérol | Sigma-Aldrich | G5516 | cru pour empêcher des microbulles d'coalescence |
| De gaz Octafluoropropane | Airgas | N / A | gaz inerte utilisé dans les applications cliniques |
| Vialmix dentaires amalgamateur | Bristol-Myers Squibb | N / A | |
| 1 MHz, 13mm, capteur flou | Olympus | A303S-SU | |
| 20 Fonction MHz / Générateur de signaux arbitraires | Agilent | 33220A | |
| Amplificateur de puissance | Krohn-Hite Co. | Modèle 7500 | |
| Hydrophone | Bruel et Kjaer | Tapez 1803 | |
| Amplificateur de charge | Bruel et Kjaer | Tapez 2634 | |
| 500 MHz Oscilloscope | LeCroy | 9354L | |
| VisualSonics système Vevo Imaging 2100 avec 34 capteur MHz | VisualSonics | 2100 | |
| 27G d'un pouce cathéters veine de la queue | VisualSonics | N / A | |
| Genie plus une pompe à perfusion | Kent scientifique | GENIE |
Références
- Bekeredjian, R., Chen, S., Frenkel, P. A., Grayburn, P. A., Shohet, R. V. Ultrasound-targeted microbubble destruction can repeatedly direct highly specific plasmid expression to the heart. Circulation. 108, 1022-1026 (2003).
- Bekeredjian, R., Katus, H. A., Kuecherer, H. F. Therapeutic use of ultrasound targeted microbubble destruction: a review of non-cardiac applications. Ultraschall Med. 27, 134-140 (2006).
- Chen, S. Regeneration of pancreatic islets in vivo by ultrasound-targeted gene therapy. Gene Ther. 17, 1411-1420 (2010).
- Miao, C. H. Ultrasound enhances gene delivery of human factor IX plasmid. Hum Gene Ther. 16, 893-905 (2005).
- Shimoda, M., Chen, S., Noguchi, H., Matsumoto, S., Grayburn, P. A. In vivo non-viral gene delivery of human vascular endothelial growth factor improves revascularisation and restoration of euglycaemia after human islet transplantation into mouse liver. Diabetologia. 53, 1669-1679 (2010).
- Shohet, R. V. Echocardiographic destruction of albumin microbubbles directs gene delivery to the myocardium. Circulation. 101, 2554-2556 (2000).
- Sirsi, S., Borden, M. Microbubble Compositions, Properties and Biomedical Applications. Bubble Sci Eng Technol. 1, 3-17 (2009).
- Li, H. L. Ultrasound-targeted microbubble destruction enhances AAV-mediated gene transfection in human RPE cells in vitro and rat retina in vivo. Gene Ther. 16, 1146-1153 (2009).
- Lindner, J. R. Microbubbles in medical imaging: current applications and future directions. Nat Rev Drug Discov. 3, 527-532 (2004).
- Newman, C. M., Bettinger, T. Gene therapy progress and prospects: ultrasound for gene transfer. Gene Ther. 14, 465-475 (2007).
- Vancraeynest, D. Myocardial injury induced by ultrasound-targeted microbubble destruction: evidence for the contribution of myocardial ischemia. Ultrasound Med Biol. 35, 672-679 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon