Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie en temps réel des axones de la racine dorsale après Rhizotomie
Dans cet article
Résumé
Une In vivo Imagerie protocole à suivre axones sensoriels primaires suivantes écraser la racine dorsale est décrite. Les procédures utilisent à grand champ microscopie par fluorescence et Thy1-YFP souris transgéniques, et permettent une imagerie répétée de la régénération des axones plus de 4 cm dans le SNP et les interactions avec l'interface axone du SNC.
Résumé
Les axones sensoriels primaires blessés par des blessures profondes épinière ne parviennent pas à régénérer dans la moelle épinière, entraînant des douleurs chroniques et permanents perte sensorielle. Régénération de la racine dorsale (DR) axones dans la moelle épinière est empêché à la dorsale d'entrée de zone racine (DREZ), l'interface entre le SNC et du SNP. Notre compréhension des événements moléculaires et cellulaires qui empêchent la régénération au DREZ est incomplète, en partie parce que les changements complexes associées à des lésions nerveuses ont été déduites à partir d'analyses post-mortem. Dynamique des processus cellulaires, telles que la régénération des axones, sont les mieux étudiés avec les techniques que la capture en temps réel des événements avec de multiples observations de chaque animal vivant. Notre capacité à surveiller les neurones en série in vivo a augmenté de façon spectaculaire grâce à des innovations révolutionnaires en matière d'optique et de la souris transgénique. Plusieurs lignes de souris transgéniques Thy1-GFP, dans les sous-ensembles de neurones sont génétiquement distincts étiquetés dans des couleurs fluorescentes, permis de neurones individuels à imager in vivo 1. Ces souris ont été largement utilisés pour l'imagerie in vivo de muscle 2-4 et le cerveau 5-7, et ont fourni de nouvelles connaissances sur les mécanismes physiologiques qui analyse statique ne pouvait pas résolu. Les études d'imagerie des neurones dans la moelle épinière de vie n'ont commencé que récemment. Lichtman et ses collègues ont d'abord démontré leur faisabilité par le suivi des blessés dorsale colonne (CC) avec de larges axones microscopie à champ 8,9. Multi-photon dans l'imagerie in vivo des axones CC profondément positionnée, la microglie et les vaisseaux sanguins ont également été accomplis 10. Au cours des dernières années, nous avons été les premiers à appliquer l'imagerie in vivo pour contrôler la régénération des axones DR utilisant la microscopie à champ large et la ligne H du Thy1-YFP souris. Ces études nous ont conduit à une nouvelle hypothèse sur les raisons axones DR sont empêchés de régénération dans la moelle épinière 11.
Dans la ligne H du Thy1-YFP souris, distincte YFP axones + sont superficiellement placés, ce qui permet plusieurs axones être surveillés simultanément. Nous avons appris que les axones DR arrivant à DREZ sont mieux imager dans lombaire que dans la moelle épinière cervicale. Dans le présent rapport, nous décrivons plusieurs stratégies que nous avons trouvé utile d'assurer avec succès l'imagerie à long terme et répétées des axones régénérant DR. Il s'agit notamment de méthodes qui éliminent l'intubation et l'interruption répétée des voies respiratoires, de minimiser la chirurgie associée stress et la formation de cicatrices, et acquérir des images stables à haute résolution sans phototoxicité.
Protocole
1. Microscope mis en place et la préparation d'imagerie
- Notre kit se compose d'imagerie d'un stéréomicroscope Leica MZ16 fluorescent avec une vitesse d'obturation rapide et une caméra CCD refroidie contrôlé par un logiciel Metamorph.
- Préparer un coussin chauffant thermostaté et d'ajuster la sortie à 32,5 ° C pour maintenir la température du corps de l'animal pendant et après la chirurgie.
- Chaud solution de Ringer stérile ou artificielle liquide céphalo-rachidien (ACSF) à 32,5 ° C à l'avance pour l'irrigation de la moelle épinière pendant la chirurgie.
- Anesthésier les animaux avec une injection intrapéritonéale de xylazine (8 mg / kg) et la kétamine (120 mg / kg) à cocktail.
- Rasez le haut du dos avec une tondeuse pour petits animaux et la propagation une petite goutte de lotion d'épilation sur la zone rasée avec un coton-tige tampons. Quelques minutes plus tard, retirer la lotion appliquée en utilisant 70% d'éthanol d'éponges de gaze imbibée.
2. Laminectomie et l'exposition chirurgicale de la racine L5 dorsale
- Placez l'animal sur une chauffée (32,5 ° C) pad et désinfecter la peau avec des tampons imbibés d'éthanol à 70%.
- Sous un éclairage en champ clair sur le stéréomicroscope, effectuer une incision médiane (2 - 3 cm) dans la peau du dos. Si nécessaire, utilisez un coton-tige tampons pour arrêter le saignement.
- Refléter la musculature vertébrale afin d'exposer les vertèbres lombaires sous-jacentes.
- Exposer les segments L3-S1 épinière par côté droit hémi-laminectomie utilisant rongeurs de petite taille. Une laminectomie partielle exposant 4-6 segments de la moelle épinière lombaire et sacrée est créée en supprimant la partie droite dorsale des vertèbres L5 au niveau de la crête iliaque de la hanche (l'emplacement des DRG L5) rostralement aux vertèbres L2 (2 vertèbres caudales et la dernière côte). Perfuser la cavité avec une solution chaude Ringer stérile.
- Position de l'animal sur un coussin de soutien (gaze de coton roulé) pour aplatir la colonne vertébrale. Utilisez des crochets de rétraction pour élargir la zone exposée.
- A ce point (environ 30 minutes après la première injection ip d'anesthésique, un supplément (0.5X) doit être injecté par voie sous cutanée afin de garder l'animal totalement anesthésié. Alternativement anesthésie gazeuse, (2-4% d'isoflurane dans de l'oxygène 0.5L/min ) peuvent être utilisés pour l'anesthésie répétée lors des séances d'imagerie plus de 1 heure.
3. Rhizotomie / écraser racine dorsale
- Interrupteur à l'excitation de fluorescence de visualiser YFP étiquetés (+) des axones.
- En utilisant la pointe d'un sous-Q (26ga.) aiguille, effectuer une petite incision dans la durée recouvrant la racine L5 dorsale (DR). Perfuser à plusieurs reprises avec une solution de Ringer et nettoyer délicatement avec un coton-tige tampons.
- Identifier le site pour être écrasés et insérez un côté d'une pince fine (Dumont # 5) sous-durale.
- Fermer la pince doucement mais fermement, en tenant la partie médiale de la racine L5 pendant 10 secondes, puis relâchez doucement la pince.
- Laver à plusieurs reprises avec une solution physiologique et nettoyez doucement avec un coton-tige tampons.
4. L'acquisition des images et des post-op procédures
- Obtenir des images multiples de toute la zone exposée, y compris le site de l'écrasement et DREZ avant et juste après l'écraser à la fois un grossissement faible et élevé.
- Les images sont acquises soit comme des instantanés unique ou de multiples flux de 10 à 20 images acquises dans les 30 - du temps d'exposition de 40 ms. En-focus images sont ensuite sélectionnés, et un montage aperçu est créé ultérieurement en utilisant Photoshop.
- Afin de minimiser la formation de cicatrices, bien appliquer un morceau de membrane fine matrice synthétique (Biobrane), suivie par artificielle-mère, au sommet de la moelle épinière exposées. Veillez à couper des morceaux pour s'adapter précisément dans la fenêtre de la moelle épinière exposés afin qu'elles soient adhérentes à la moelle épinière.
- Fermer la musculature avec des sutures stériles 5-0 et fermer l'incision médiane avec des clips plaie.
- Injecter la solution de Ringer (0,3 à 0,5 ml par voie sous cutanée), et d'administrer la buprénorphine comme analgésie postopératoire (0,05 mg / kg) par voie sous cutanée toutes les 12 h pendant 2 jours.
- Gardez l'animal sur un coussin chauffant (34 ° -35 ° C) jusqu'à ce récupérés.
5. Imagerie répétés
- Anesthésier les animaux et enlever les clips de la plaie et des sutures.
- Retirer artificielle mère et fine membrane synthétique patchs matrice et les conserver dans un tube stérile contenant une solution de Ringer pour une réutilisation ultérieure.
- Retirez doucement la cicatrice conjonctifs accumulés tissu avec la pointe d'une aiguille pliée sous-Q et une pince fine. Perfuser fréquemment avec une solution de Ringer au chaud en.
- Re-exposer le champ opératoire, y compris le site écraser et DREZ, relocaliser YFP + axones imagé dans les sessions précédentes, et répéter les procédures décrites dans la section 4.
6. Les résultats représentatifs:
Nous avons observé que, alors qu'ils ne se régénèrent pas après une blessure transection, presque tous les axones + YFP grandi à travers le site deblessures en 3 jours après l'écrasement (Figure 1) 11. Typiquement, le lendemain, après écrasement, nous avons observé meurent-back dégénérescence des axones moignon proximal et de la fragmentation / dégénérescence des axones mêmes distale à l'écrasement, qui a confirmé que les axones avaient été endommagés de manière appropriée (par exemple, la Figure 1; Jour 3 et 5) . Plusieurs critères supplémentaires sont appliqués à distinguer sans ambiguïté les axones repoussent à partir des axones qui ont été épargnés ou avait récupéré de sa blessure. Ces sont les suivants: (1) axones régénérant montrent une expansion de la partie non-fluorescent de la YFP + axone au site écraser due à la dégénérescence proximales et distales (par opposition à un rétrécissement de l'écart non étiquetés en raison de cytoplasme fluorescentes remplissage du site écraser si les axones ont survécu à la blessure), (2) régénération des axones sont beaucoup plus minces, moins vives fluorescentes, et plus vallonné que les axones qui ont survécu à la blessure, (3) neurites de régénération sont plus minces et plus faiblement fluorescentes que les fragments ne dégénère fluorescentes des axones à travers lequel ils ont étendu; (4) contrairement à survivre ou épargné les axones, les axones régénérant arrêt à la DREZ, et (5) contrairement aux survivants ou épargné les axones, les axones régénérant ne présentent pas de nœuds de Ranvier. La figure 1 montre quatre superficielle axones + YFP immédiatement après l'écrasement (A1; flèches colorées). Trois jours après l'écrasement, les quatre axones prolonger une seule neurites qui pousse à travers le site d'écrasement (A2). Cinq jours après écraser, neurites rester stable et il n'ya pas de croissance supplémentaire d'axones de ces ou d'autres proximale (A3).
Les neurites régénérant qui traversait le site écraser allongée grâce à beaucoup plus épais et plus lumineux fragments fluorescents d'un axone dégénère (ie, les tubes endoneurial), et arriver à l'DREZ dès 4 jours après l'écrasement (environ 3mm / 2 jours) 11. Imagerie répétée de ces axones et leurs conseils tous les deux ou trois jours pour deux semaines de plus (Figure 2) a révélé qu'ils ne poussent pas vers l'avant ou se rétracter, mais il est resté immobile. Le seul changement notable a été le gonflement des conseils et des puits de certains axones. Ces observations montrent donc l'immobilisation étonnamment rapide et chroniques des axones régénérant à l'DREZ.
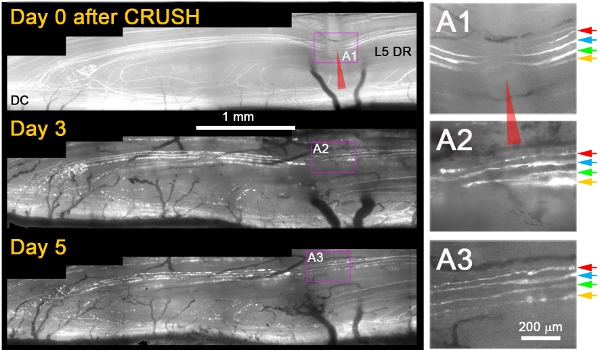
Figure 1: imagerie répétés de L5 + DR YFP axones sur le site d'écrasement de la racine dorsale de plus de 5 jours. La partie médiale de la racine L5 a été écrasé (rouge pointe de flèche) et imagé aux jours 0, 3 et 5 après l'écrasement. La zone de l'écrasement est amplifié dans les panneaux de droite (A1-A3).

Figure 2:. Imagerie répétés des axones est arrivé à l'DREZ plus de 20 jours après écraser la racine L5 Jour 4, trois axones (flèches colorées) sont arrivés à la DREZ. Les pointes de ces axones restent au même endroit et ont une apparence semblable à des sessions ultérieures sur l'imagerie Jours 7, 9, 13, 15 et 20. Positions d'une pointe axone par rapport à d'autres trucs axone et les repères (astérisques) ont été utilisées pour déterminer la motilité axone entre les séances d'imagerie.
Discussion
Imagerie DR directement dans la régénération de vie des souris est particulièrement difficile car il nécessite une laminectomie dorsale substantielle pour surveiller la croissance des axones sur une large zone suivie par plusieurs interventions chirurgicales effractives et anesthésiques à des séances d'imagerie ultérieurs. Plusieurs stratégies ont aidé à surmonter ces défis. Premièrement, l'imagerie réussie nécessaire de réduire la mortalité de la souris (environ 25%) en minimisant la durée de...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous remercions le Dr Alan Tessler pour les commentaires et l'aide éditoriale. Ce travail a été soutenu par le NIH NS062320.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Ligne H Thy1-YFP (2-4 mois, soit le sexe) | Jackson Laboratory (Bar Harbor, ME) | 003782 | |
| Xylazine (injection AnaSed, solution stérile) | Laboratoires Lloyd, (Shenandoah, LA) | 4811 | 8 mg / kg |
| La kétamine (chlorhydrate de kétamine par injection, USP) | Hospira, Inc (Lake Forest, IL) | 2051 | 120 mg / kg |
| La buprénorphine (injectable Buprenex) (0,05 mg / kg) | Reckitt Benckiser Pharmaceuticals Inc (Richmond, VA) | 7571 | |
| Petite tondeuse poils | Oster Professional, (McMinnville, TN) | 76059-030 | |
| Lotion Épilation | Church & Dwight Co. (Princeton, NJ) | NAIR avec Baby Oil | |
| Compresses de gaze | Fisher Scientific, (Pittsburgh, PA) | 22-362-173 | |
| Coton-tige tampons | Fisher Scientific, (Pittsburgh, PA) | 14 à 960-3Q | |
| Seringues de 1 ml | Becton, Dickson et Société Franklin Lakes, NJ) | 309602 | |
| Sous-cutanée (sous-Q) aiguilles, Calibre 26. | Becton, Dickson and Company (Franklin Lakes, NJ) | 305115 | |
| Des ciseaux et des pinces à ressort | Outils Fine Science, (Foster City, CA) | ||
| 2,5 mm Rongeurs courbes | Outils Fine Science, (Foster City, CA) | 16221-14 | |
| Injection de Ringer lactate USP | B. Braun Medical Inc (Irvine, CA) | BBR-L7502 | |
| Une solution saline stérile | APP Pharmaceuticals (Schaumburg, IL) | 918610 | |
| Mince membrane matrice synthétique (Biobrane) | Pharmaceuticals Bertek, (Morgantown) | 62794-096-251 | |
| Artificial durée | Gore Empêcher MVP Dura substitution, WL Gore and Associates, (Flagstaff, AZ) | 1MVP40 | |
| 5-0 sutures de soie | Ethicon, Inc (Somerville, NJ) | K-580 | |
| Clips des plaies | Parfait - Ets Bruneau, (Burnea, France) | A75 | |
| Stéréomicroscope fluorescent | Leica Microsystems, (Wetzlar, Allemagne) | MZ16 | |
| La caméra CCD | Hamamatsu, de Bridgewater (NJ) | ORCA-Rx2 | |
| Régulateur de température | World Precision Instruments (Sarasota, Floride) | ATC 1000 | |
| Metamorph logiciels | Molecular Devices (Sunnyvale, Californie) | ||
| Photoshop | Adobe Systems, San Jose, CA |
Références
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i. in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon