Method Article
Étude du cytosquelette d'actine dans les cellules endothéliales en direct exprimant la GFP-actine
Dans cet article
Résumé
Imagerie microscopique des cellules endothéliales direct exprimant la GFP-actine permet la caractérisation des changements dynamiques dans les structures du cytosquelette. Contrairement aux techniques qui utilisent des échantillons fixés, cette méthode fournit une évaluation détaillée des changements temporels dans le cytosquelette d'actine dans les mêmes cellules, avant, pendant, et après divers stimuli physiques, pharmacologiques ou inflammatoires.
Résumé
L'endothélium microvasculaire joue un rôle important comme une barrière sélective perméable aux fluides et des solutés. Les jonctions d'adhérence entre les cellules endothéliales régulation de la perméabilité de l'endothélium, et de nombreuses études ont montré la contribution importante du cytosquelette d'actine à la détermination de l'intégrité jonctionnelle 1-5. Une ceinture d'actine corticale est pensé pour être important pour le maintien de la stabilité des jonctions 1, 2, 4, 5. En revanche, les fibres de stress d'actine sont censés générer des tensions centripètes dans les cellules endothéliales qui affaiblit les jonctions 2-5. Une grande partie de cette théorie a été basée sur des études dans lesquelles les cellules endothéliales sont traités avec des médiateurs inflammatoires connus pour augmenter la perméabilité endothéliale, puis fixer les cellules et l'étiquetage de F-actine à l'observation microscopique. Cependant, ces études fournissent une compréhension très limitée du rôle du cytosquelette d'actine, car des images de cellules fixes fournissent des instantanés seulement danstemps avec aucune information sur la dynamique des structures d'actine 5.
Imagerie des cellules vivantes permet l'incorporation de la nature dynamique du cytosquelette d'actine dans les études des mécanismes de détermination intégrité de la barrière endothéliale. Un avantage majeur de cette méthode est que l'impact de divers stimuli inflammatoires sur les structures d'actine dans les cellules endothéliales peuvent être évalués dans le même ensemble de cellules vivantes avant et après traitement, en supprimant le biais potentiel pouvant survenir lors de l'observation des échantillons fixés. Les cellules humaines endothéliales de veine ombilicale (HUVEC) sont transfectées avec GFP-β une actine plasmide et cultivées jusqu'à confluence sur lamelles de verre. Time-lapse images de GFP-actine dans confluentes HUVEC sont capturés avant et après l'ajout de médiateurs inflammatoires qui provoquent des changements dépendant du temps dans l'intégrité de barrière endothéliale. Ces études permettent une observation visuelle de la séquence fluide de changements dans le cytosquelette d'actine qui contribuent à des endothéliumsrupture de la barrière l et de restauration.
Nos résultats montrent constamment locale, riche en actine formation de lamellipodes et le roulement dans les cellules endothéliales. La formation et le mouvement des fibres de stress d'actine peuvent également être observés. Une analyse de la fréquence de la formation et la rotation de la section locale lamellipodes, avant et après traitement avec des stimuli inflammatoires peuvent être documentés par des analyses kymographe. Ces études fournissent des informations importantes sur la nature dynamique du cytosquelette d'actine dans les cellules endothéliales qui peuvent servir à découvrir les mécanismes moléculaires non identifiés auparavant important pour le maintien de l'intégrité barrière endothéliale.
Protocole
1. La transfection de cellules HUVEC avec GFP-actine
- Différentes méthodes peuvent être utilisées pour transfecter HUVEC. Notre laboratoire utilise le système Nucleofector (Lonza, Bâle, Suisse) décrites ci-dessous. En général, les travaux rapidement pour améliorer la viabilité des cellules et l'efficacité de la transfection. Chaque transfection nécessite 5 x 10 5 HUVEC qui sera ensemencé sur deux lamelles de verre (Corning n ° 1, 22 x 50 mm). Le Nucleofector combine réactifs chimiques électroporation et à transfecter l'ADN plasmidique, et réalise généralement une efficacité d'expression> 50%. Réactifs de transfection chimiques sont une méthode alternative. Un groupe a réussi transfectées cellules endothéliales bovines avec GFP-actine en utilisant le réactif GenePORTER 6. Le protocole que nous utilisons est Nucleofector décrit ci-dessous.
- Préstérilisés lamelles cultureware ou ordinaire peut être utilisé, selon le type de chambre. Pour lamelles de verre, stériliser dans une hotte de sécurité biologique en plaçant le leur dans une plaque de culture de 10 cmcontenant environ 5 ml d'éthanol à 70% pendant 2 min. Ramassez-les avec une pince stérile et sécher à l'air en les appuyant contre le côté d'une plaque de culture séparée.
- Une fois sèche, placer chaque lamelle dans sa propre plaque de culture 10 cm. Pipeter 300 uL une goutte de solution de gélatine chaude (1,5% en NaCl 0,9%) sur le centre de la lamelle et laisser reposer pendant 5 min., Puis aspirer. Garder ce revêtement de matrice dans le centre, sans toucher les bords, fera en sorte que les cellules seront ensemencées dense et permettra d'atteindre la confluence rapidement.
- Préparer un tube de 1,5 ml par microcentrifugation transfection avec 500 ul de EGM2MV médias (Lonza) et mis de côté dans un 37 ° C, 5% de CO 2 incubateur.
- Détachez HUVEC avec 0,25% de trypsine-EDTA et recueillir dans un tube de 15 ml conique. Compter les cellules. 5 x 10 5 cellules sont nécessaires pour chaque transfection. Réglez le volume de suspension cellulaire pour obtenir un culot qui va contenir 5 x 10 5 cellules, multiplié par le nombre de transfections à effectuer.
- Centrifuger la suspension de cellules dans une centrifugeuse clinique à 5000 rpm pendant 3 minutes à température ambiante. Aspirer le surnageant en inclinant le tube pour enlever les médias autant que possible.
- Reprendre le culot avec la solution de base Nucleofector soit de la HUVEC ou primaire de cellules endothéliales Nucleofector Kit (Lonza). Utiliser 100 pi par 5 x 10 5 cellules. En raison de la toxicité de cette solution, il est important de travailler rapidement tandis que les cellules sont suspendues dans cette solution.
- Ajouter le vecteur GFP-β-actine plasmidique (0.2-2 mg par 100 pi de suspension Nucleofector) à l'échantillon de la transfection. 0,2 à 2 mg de GFP-actine ADN plasmidique par 5 x 10 5 cellules par transfection.
- Transférer 100 ul de suspension cellulaire dans une cuvette Nucleofector. Couvrez et appuyez sur la cuvette quelques reprises pour s'assurer de la suspension cellulaire est tout le chemin vers le bas.
- Placer la cuvette dans la fente Nucleofector II cuvette périphérique et exécuter la dprogramme d'électroporation esired. Nous utilisons le programme A-034 pour les HUVEC.
- Retour de la cuvette de la hotte de sécurité biologique. Apportez un des tubes de microcentrifugation de l'incubateur à 37 ° C qui contient 500 pi de EGM2MV à la hotte. En utilisant l'un des transferts les pipettes fournies dans le kit Nucleofector, ajouter doucement la chaleur 500 ul de médias à la suspension cellulaire dans la cuvette. Transfert de tous les contenus de l'arrière de la cuvette de tube de centrifugeuse et le placer dans l'incubateur pendant 15 min. pour permettre aux cellules de se rétablir.
- Répétez les étapes 9 à 11 que nécessaire si plusieurs cellules sont à transfecter.
- Un tube de centrifugeuse contenant 600 uL de suspension HUVEC transfectées peuvent être ensemencées sur deux lamelles. Sous le capot, et avec une micropipette 1000 ul, délicatement la pipette haut et en bas une fois pour mélanger la suspension, puis placez 300 ul de la suspension directement sur une lamelle de gélatine-enduit. Ne laissez pas la suspension toucher le bord de la lamelle. Placer dans les 37 ° C / 5% de CO 2 incubateur pour 1-4 h pour permettre la fixation des cellules.
- Après 1-4 h, inspecter les cellules transfectées pour confirmer qu'ils ont attaché à la lamelle. Ensuite, ajoutez 10 ml de EGM2MV médias, et revenir à la plaque pour les 37 ° C / 5% de CO 2 incubateur. GFP-actine expression peut généralement être observé dans les 4-8 heures. Les expériences sont généralement effectuées dans les 24-48 h.
2. Mise en place de la chambre de l'imagerie des cellules vivantes et chauffe étape
- Pour la plupart de nos études, nous avons utilisé un Warner Instruments ouverte diamants bain (RC22) placé dans un PH-1 chauffe-scène, alimentés par un système à écoulement par gravité. Cependant, plusieurs options sont disponibles pour vivre les étapes d'imagerie cellulaire, y compris les chambres qui peuvent accueillir des plats en verre à fond la culture, des chambres ouverts ou fermés, et diverses combinaisons de chauffe microincubator / objectif et les grands systèmes incubateur. Finalement, la sélection de chambre dépend de facteurs y compris la nécessité d'accéder à la salle de bain d'ajouter un agent de test ou de drogue, wheil ya le support sera statique ou sous flux, et la durée de l'expérience. En outre, parfois des facteurs comme l'instabilité de température peuvent provoquer une dérive de discussion, et peut être minimisé par des systèmes de contrôle qui peuvent maintenir stable et des températures de bain objectif.
- Moyennes Aliquoter suffisante pour l'expérience. Nous aliquote de 50 ml de solution salée physiologique d'albumine (APSS; tableau 1) pour chaque heure de l'expérience va durer.
- Soit un système de pompe ou par gravité peut être utilisé pour offrir à moyen et à la chambre. Pour notre système, nous ajoutons APSS à un simple écoulement par gravité à partir d'un système intégré de ligne de flux par voie intraveineuse, reliée à un radiateur en ligne (Warner Instruments modèle SH-27A). Nous appliquons débit à environ 40 ml / h.
- Si une chambre de bain ouverte comme la nôtre seront utilisés, appliquer de la graisse à vide sur le bord extérieur sur la partie inférieure de la baignoire et de diamants avec un coton-tige. Ensuite, nous obtenons une cellule recouverte de la lamelle de l'incubateur, et soulevez doucement la lamelle à l'aide des pinces. GentlY toucher le dos à un Kimwipe pour absorber l'excès moyennes tout en gardant le côté pile couvert humide. Avec les cellules face, placez le bain diamant sur la lamelle pour former une chambre.
- Placer rapidement la chambre dans le chauffe-scène et serrer les pinces sur la chambre. Une préoccupation majeure à ce stade est la possibilité que les cellules se dessèchent. Il est donc important de travailler rapidement et une fois fait, immédiatement pipette ~ 1 mL de milieu dans la chambre pour empêcher les cellules de se dessécher.
- Notre chambre permet un débit constant du milieu sur les cellules. Juste avant de tourner sur le débit, il est important de brancher un tuyau d'aspirateur pour son titulaire sur la chambre pour permettre l'évacuation de milieu de culture en excès (APSS). Le chauffe-eau et chauffe-bains en ligne devrait également être tourné sur un point de cette (à 37 ° C). Notre système a également une sonde à thermistance pour surveiller la température, ce qui devrait être mis sur le bord de la baignoire.
- Essuyez soigneusement le dessous de la coopérationverslip avec un Kimwipe imbibé d'EtOH à 70% pour enlever les médias et l'accumulation EGM2MV sel. Essuyez une seconde fois avec un Kimwipe sec ou du papier pour objectif.
- Après la chambre a été mis en place, le flux est en marche, et la température est constante à 37 ° C, permettent aux cellules d'au moins 30 minutes pour ajuster et stabiliser avant de commencer l'expérience.
- En attendant, mettez tous les composants du microscope d'imagerie des cellules vivantes (lampes, contrôleur de roue à filtres, caméra, ordinateur).
3. Acquisition de données avec le microscope d'imagerie des cellules vivantes
- Divers systèmes de microscopie cellulaire direct sont disponibles. Notre système est un Nikon Eclipse TE-2000U avec les composants suivants:
- Sutter Instruments Lambda LS 300 W lampe au xénon
- Sutter Instruments Lambda roues d'excitation 10-3 filtre avec SmartShutter et S492 filtre (D350 et S572 filtres d'excitation sont également disponibles pour des applications UV et DP)
- Dichroïque émetteur 2002bs (Nikon 61002M)
- CI plan Fluor Objectif DLL 10X, NA 0,30 (Nikon MRH10100)
- Plan de Fluor ELWD objectif 40x DM, NA 0,60 (Nikon MRH08420)
- Plan d'Apo VC Objectif 100x, NA 1,40 (Nikon MRD01901)
- Photometrics Coolsnap HQ2 caméra, 1392 x réseau d'imagerie 1040, 6,45 x 6,45 pixels um
(Roper Scientific) - Nous avons également deux logiciels qui peuvent être utilisés pour l'acquisition de l'image. Éléments-AR Nikon 3.0 et 6.1 Metamorph.
- Après avoir visionné les cellules et trouver un endroit approprié pour l'étude, verrouiller le bouton de mise grossier et vérifier les paramètres du logiciel d'acquisition de telle sorte que:
- La roue à filtres est réglé pour le filtre S492 (étiqueté «FITC» dans notre configuration)
- Dans le logiciel d'acquisition, l'objectif est réglé pour correspondre à l'agrandissement désiré (notre microscope n'est pas motorisé, mais cela fixe le ratio um / pixel). Vérifiez également que l'objectif Optivar sur le microscope est réglé au grossissement 1.0X. Réglage de la Optivar à 1.5X peut augmenter le grossissement, toutefois au détriment de perdre l'intensité du signal.
Le grossissement à utiliser dépend objectifs de l'étude. Pour le meilleur détail, un objectif 100X avec une grande ouverture numérique fournira une meilleure résolution spatiale et la transmission du signal. Notre microscope est également équipé d'un objectif 40x longue distance de travail destiné à une autre application qui nécessite la distance supplémentaire. Toutefois, cet objectif peut être utile lorsque l'on souhaite observer plusieurs cellules simultanément, et fonctionne très bien pour la visualisation des organites des structures de taille, cependant, au coût de perte de résolution spatiale et d'intensité du signal. Pour toute étude dans laquelle l'intensité du signal est un critère d'évaluation, ou pour plus de techniques d'imagerie avancées telles que la fluorescence speckle microscopie, un objectif 100X est recommandé. - Le temps d'exposition appareil photo est réglé entre 0,5 à 2 s. Cela dépend de l'intensité GFP-actine dans les cellules. Nous utilisons généralement le temps d'exposition le plus bas possible pour éviter de blNSEIGNEMENT de la GFP-actine et la toxicité potentielle pour les cellules.
- Pour obtenir la meilleure résolution, le Binning devrait être fixé à 1 x 1 et Gain à 1. Dans certains cas, nous avons mis en binning de 2 x 2 pour réduire le temps d'exposition, mais cela réduit la précision des mesures, nous pouvons faire sur les objets en mouvement dans l'étude time-lapse.
- Configurer les paramètres time-lapse:
- Choisissez le dossier pour enregistrer les images capturées et tapez un nom de fichier.
- Définissez le nombre d'images et de moments durée de l'intervalle pour l'expérience. Nous utilisons généralement un intervalle de 15 s à 1 min entre les images et jusqu'à 2 h pour la durée.
- Assurez-vous que l'obturateur actif est configuré pour être fermés entre les acquisitions.
- Avant de commencer l'acquisition d'image time-lapse, éteignez les lumières et la salle de capturer une image unique pour vérifier les réglages.
- Également capturer une image en fond clair. Assurez-vous que le condenseur est réglé à la bonne phase ou le filtre DIC. Allumezla lampe halogène et de collecter de l'image. Eteindre la lampe halogène.
- Revenir à "FITC" paramètres de l'imagerie time-lapse et capturer une image de test.
- Capturez la série time-lapse.
Pendant l'expérience, il est important de surveiller les images telles qu'elles sont acquises. Dans certains cas, de petits changements de température dans la chambre peut causer de la dérive de discussion. Ceci peut être évité en optimisant les flux et les lignes de vide, de sorte que le débit est constant au cours des cellules. Aussi, en minimisant la circulation dans la chambre de microscope, et la réorientation des courants d'air bouches d'aération au plafond loin de le microscope peut être utile. Une alternative qui a bien fonctionné dans notre expérience est l'utilisation de 37 ° C / 5% de CO 2 chambres incubateur qui renferment toute la scène et objective. Ceux-ci offrent l'avantage de cellules de surveillance pendant la nuit ou plus, mais l'accès aux cellules est limité.
Si nécessaire, mettre en pause l'acquisition time-lapse et de recentrer l'image. Effectuez les recentrer aussi rapidement que possible aux éviter de modifier l'intervalle de temps entre les images. - Un protocole typique se compose de 20-30 minutes d'images de référence avant l'ajout d'un agent d'essai suivie par 0,5 à 4 heures d'acquisition des images supplémentaires. La durée de l'expérience peut être limitée par photoblanchiment de la GFP au fil du temps, c'est pourquoi il est important de choisir le plus court délai d'exposition possible. Il peut également être souhaitable de modifier l'intervalle entre les images laps de temps à 30-60 s si une étude plus longue est souhaitée.
4. L'analyse des données
- Plusieurs logiciels peuvent être utilisés pour analyser les ensembles d'images, tels que les éléments de NIS, Metamorph, Slidebook, etc Nous effectuent généralement de notre analyse de l'image à l'aide du NIH ImageJ permettant une analyse sur n'importe quel ordinateur sur notre laboratoire ou à domicile. Les versions que nous utilisons sont:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
FIDJI (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ peut être utilisé pour analyser un grand nombre de processus dynamiques, y compris:
- Fréquence des saillies lamellipodes
- Distance, temps, et la vitesse des protubérances
- Le mouvement des fibres d'actine au cours du temps
- Dans ImageJ, lorsque l'ensemble de l'image ouvre le numéro de la tranche / tranches total sera affiché dans le coin supérieur gauche de la fenêtre, avec le nom du fichier, le nombre de pixels, type de fichier et la taille. La barre de défilement Z sur le fond correspond à la fois. En outre, les plaçant le pointeur sur l'image s'affiche les coordonnées x, y, z et l'emplacement des pixels sur le fond de la barre d'outils ImageJ.
- Protubérance lamellipodes peuvent être étudiés en déterminant le nombre de saillies nouvelles au fil du temps. Cela peut être fait pour le périmètre cellule entière ou une région choisie. Ce type d'analyse peut également être effectuée dans les nonconfluent, les cellules non transfectées avec un contraste de phase ou la microscopie DIC. Cependant, en utilisant des cellules exprimant la GFP-actine permet l'analyse des monocouches confluentes, en particulier lorsque les cellules contenant la GFP et manquent-actine sont adjacents les uns aux autres.
- La distance protubérance lamellipodes, la persistance (temps), et la vitesse peut être évaluée par kymographe (ligne de balayage) analyse. Dessinez une ligne perpendiculaire à la bordure d'une cellule (c'est le plus facile s'il n'y a pas de cellule adjacente, ou la cellule adjacente ne expriment la GFP-actine). Dans ImageJ, en appuyant sur "/" va générer un kymographe, avec l'axe des x représente distance et le temps de l'axe y représente (15 s à 1 min par pixel en fonction de l'intervalle de temps directives ci-dessus). Les lignes peuvent être tirés sur une saillie lamellipodes et les dimensions de la boîte mesurée (en appuyant sur M dans ImageJ). La distance, le temps et la vitesse peut alors être calculé.
- Le mouvement de fibres de stress peut également être mesurée par analyse kymographe d'une façon similaire.
5. Les résultats représentatifs:
Avec notre protocole de transfection, nous observons habituellement expression de la GFP-actine dans au moins 50% des HUVEC transfectées, et ne peuvent souvent trouver des zones sur la lamelle où> 90% des HUVEC dans la région expriment la GFP-actine. Un exemple d'une expérience d'imagerie de cellules vivantes avec des HUVEC subconfluentes exprimant la GFP-actine est montré dans le film 1. Pour cette expérience particulière, une image a été acquise une fois par minute. Comme on peut le voir dans le film, la GFP-actine dans les HUVEC peut être observée partout dans le cytoplasme, ainsi que dans struct filamenteusesres et locales lamellipodes saillie sur le bord des cellules. Il ressort également dans le film, c'est que la GFP-actine d'expression n'est pas uniforme entre les cellules. Cellules choisi pour l'étude ont généralement assez de GFP-actine présents pour visualiser diverses structures contenant l'actine filamenteuse. Les cellules exprimant des niveaux très élevés de GFP-actine peut être problématique pour l'étude parce que dans ces cellules, il est généralement difficile de distinguer la F-actine structures du montant élevé de G-actine présents.
Film 2 montre un exemple du comportement des HUVEC confluentes exprimant la GFP-actine. Comme les HUVEC subconflent, actif lamellipodes la formation et la rotation le long des périmètres de cellules était apparente. Cependant, ces lamellipodes souvent donné lieu à la membrane volants, indiquant protubérance moins efficace 7. Cela est probablement dû à la présence de cellules adjacentes bloquant le substrat à proximité. Des fibres d'actine corticale et des fibres de stress sont aussi visibles dans les films 1 et 2. Bien que les cellules, nous observed resté stationnaire, les fibres de stress sont similaires aux fibres d'arc transversale dans les cellules migrent, formant près du bord des cellules et se déplaçant latéralement vers le centre de la cellule où ils démontez 8, 9. Une caractéristique supplémentaire dynamiques observées dans ces cellules a été la formation de structures en anneau d'actine qui élargi de manière concentrique, qui s'appelait auparavant l'actine nuages 10.
Un exemple de la façon dont la distance, la persistance et la vitesse des protubérances cellulaires sont quantifiés à partir de ces images time-lapse jeux utilisant l'analyse kymographe est montré dans la figure 1. Dans la figure 1A, une ligne de pixel est tiré à peu près perpendiculaire au bord de cellules pour la production d'un kymographe (figure 1B). Dans ce kymographe, la région définie par la ligne est placée verticalement et les images de l'ensemble du time-lapse sont empilés horizontalement. En regardant de gauche à droite dans la kymographe, saillies sont représentés comme des mouvements à la hausse dans le bord de la cellule. Dans la figure 1C, une ligne a été superimposed sur le bord d'une de ces saillies, et les données de pixels associé à cette ligne ont été recueillies et sont affichés dans la fenêtre Résultats dans le bas du panneau. Cette analyse permet de quantifier la dynamique protubérance, et peut également être utilisée pour estimer la fréquence protubérance (nombre de saillies / heure) dans cette région de la cellule.
Un exemple de l'analyse du mouvement de fibres de stress est montré dans la figure 2. La plupart des fibres de stress, nous avons observé formé près de la périphérie de la cellule et se dirigea vers le centre cellulaire, où ils ont finalement démonté. Cela peut aussi être quantifiée par analyse kymographe. Une ligne est tracée perpendiculairement au bord de la cellule et aux fibres de stress (figure 2A) et une kymographe est générée (figure 2B). Les fibres de stress apparaissent comme des lignes continues dans la région cytoplasmique de la kymographe, se déplaçant souvent vers le bas et vers la droite (vers le centre de la cellule). Parfois, les fibres sont difficiles à voir dans le kymographe originale, et dans ces cas, nousutiliser le filtre de masque flou pour affiner l'image (figure 2C). Les lignes sont dessinées sur les fibres de stress et les données sont collectées pixel en utilisant la fonction mesure (figure 2D). Une autre façon de recueillir ces données est de tracer une ligne à partir du début à la fin de la fibre de stress identifiés pour obtenir la pente moyenne pour la durée que la fibre a été observée (figure 2E). Cette analyse permet de quantifier le stress en fibre de mouvement latéral et peut également être utilisé pour quantifier le nombre de fibres de stress observée dans cette région de la cellule.
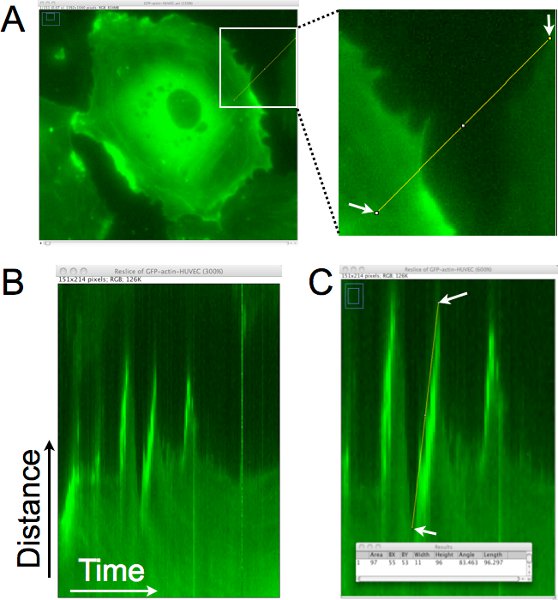
Figure 1. Kymographe l'analyse de la bordure de cellule pour déterminer la distance protubérance, la persistance et la vitesse des locaux lamellipodes. Une. Une ligne de pixel est tiré à peu près perpendiculaire au bord de la cellule. Cette région est extraite de chaque image de la time-lapse paramétrée pour générer un montage de la région au fil du temps. B. En ee résultant kymographe, l'axe des x représente le temps, se déplaçant de gauche à droite, et l'axe des ordonnées représente la distance. Mouvement de la bordure des cellules au cours du temps peut être évaluée dans ce kymographe et lamellipodes sont identifiés les régions où le bord de la cellule, déplaçant vers la droite, va vers le haut. C. Une ligne est tracée sur le bord des cellules, où une saillie par un lamellipode a été identifié. Les dimensions du rectangle de délimitation de la ligne tracée sont alors acquises (affichés dans la fenêtre superposée). La largeur est utilisée pour calculer le temps de dépassement ou de persistance. La hauteur est utilisée pour calculer la distance protubérance. La vitesse de dépassement est calculé en divisant la hauteur par la largeur. Dans cet exemple, la distance vers le haut a été de 96 pixels x 0,16125 um / pixel = 15,5 um, et le temps était de 11 pixels x 1 minute / pixel = 11 min. La vitesse a été calculée comme 15,5 μm/11 min. = 1,4 um / min.

FAnalyse IGURE kymographe 2. du mouvement de fibres de stress d'actine. Une. Une ligne de pixel est tiré perpendiculairement au bord de la cellule pour produire une kymographe. B. Comme indiqué dans la Fig. 1, dans le kymographe résultant, l'axe des x représente le temps et la distance axe des ordonnées. Fibres de stress sont observés comme des lignes continues dans la cellule, allant souvent à la baisse et à droite (flèches) C. Pour mieux visualiser les fibres de stress, le filtre Accentuation peut être utilisé. Dans cet exemple, un rayon de 3 pixels et son poids le masque de 0,60 a été utilisé. D. Lignes de pixels simples sont ensuite dessinés sur la fibre de stress identifiés, et les données recueillies. Dans ce panel de trois lignes ont été dessinées et ensuite "supprimer" a été pressé de faire une annotation permanente (ligne blanche) de leurs lieux après chaque mesure. E. Alternativement, si la distance moyenne, l'heure et la vitesse de la fibre de stress est souhaitée, une ligne peut être établi dès le départ et les points d'arrivée (ligne jaune), et les données pourr qui peuvent être acquis (en surbrillance dans la fenêtre des résultats). Pour cet exemple, les mesures ont été faites sur cette fibre de stress pour 37 images x 1 min frame /. = 37 min. La distance parcourue pendant cette période était de 75 x 0,16125 cadres um / pixel = 12,1 um. La vitesse résultant latéral de la fibre de stress était de 12,1 μm/37min = 0,33 um / min. Une valeur positive pour la vitesse est attribué pour les fibres de déplacement vers le centre de la cellule, et négatif pour les fibres motrices vers la périphérie.
Images d'une vidéo 1. Time-lapse de vivre HUVEC exprimant la GFP-actine. L'intervalle entre les images est de 1 min. Local lamellipodes saillie sur tout le périmètre de cellules. En outre, les fibres de stress à l'arc transversal déplacé latéralement vers le centre des cellules. Lorsque la thrombine (1 U / ml) a été ajouté à la baignoire, les cellules légèrement contracté et les saillies extérieures des lamellipodes pause pendant environ 10 min. Après que les cellules contractée, la formation de lamellipodes et le roulement CV d. Cliquez ici pour regarder le film.
Movie 2. HUVEC confluentes exprimant la GFP-actine, avant et après traitement par la thrombine. Le temps écoulé est indiqué dans le coin en bas à droite en minutes: secondes. L'intervalle entre les images est de 30 s. La thrombine (1 U / ml) a été ajouté après le 45 min. période de référence. Des événements locaux comprennent la formation annotée lamellipodes et le roulement (pointes de flèche près des bords des cellules, 00:59 - 37:29), l'actine nuages (flèches, 1h59-21h29), et un écart à un carrefour tricellulaire qui élargit, après addition de thrombine (flèche, 62:30 - 70:00). Transverse fibres de stress à l'arc sont également apparentes dans plusieurs des cellules. Les cellules affiché la formation active et de chiffre d'affaires locaux ainsi que leurs périmètres lamellipodes, avec de nombreuses donnant lieu à la membrane volants. La thrombine a provoqué une pause dans la formation de lamellipodes et le roulement, et la brève apparition de quelques petits interstices entre les cellules.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Cliquez ici pour regarder le film.
Discussion
L'imagerie de la GFP-actine dans les cellules endothéliales en direct permet une analyse détaillée de la dynamique du cytosquelette d'actine en réponse aux stimuli inflammatoires. Cette méthode peut également être utile de s'appuyer sur les conclusions antérieures montrant remodelage du cytosquelette en réponse aux forces physiques comme la contrainte de cisaillement 11. En outre, cette méthode permet une évaluation détaillée de la contribution de la dynamique de l'actine du cytosquelette à diverses activités de la cellule endothéliale, y compris la migration, la mitose, la formation des jonctions intercellulaires et la maturation jonctionnelle, et le maintien de la fonction de barrière.
Dans les données présentées, le comportement du cytosquelette d'actine endothéliales peuvent être observées avant et après traitement par la thrombine. Lamellipodes locale tout au long des bords des cellules endothéliales ont été observées former et régresse au fil du temps dans les monocouches de cellules à la fois nonconfluent et confluentes. Le traitement par la thrombine brièvement interrompu la forme lamellipodesation et le chiffre d'affaires. La thrombine a également causé des cellules de se contracter légèrement, en accord avec les précédents rapports que la thrombine provoque la formation de fibres d'actine stress et les tensions centripètes développement accru dans les cellules endothéliales 12-14. Cependant, à partir des études d'imagerie des cellules vivantes de ce genre, l'origine des fibres de stress peuvent désormais être déterminé. En HUVEC, la plupart des fibres de stress proviennent à la périphérie des cellules et des fibres ressemblent à l'arc dans la migration de cellules transversales 8, 9. Une autre force de cette méthode sur l'utilisation de cellules fixes est que le nombre de fibres de stress peuvent être quantifiés dans des cellules individuelles avant et après traitement de thrombine, en éliminant les biais de sélection entre les groupes expérimentaux.
Avec ce protocole, nous évaluons le mouvement dynamique de la bordure des cellules et des fibres de stress d'actine. Pour comprendre la dynamique de monomère d'actine dans les cellules endothéliales, des techniques plus avancées telles que le recouvrement de fluorescence après photoblanchiment (FRAP) ou de fluorescence speckle microscopie (FSM) peut être appliquée 15, 16. En outre, parce cellules endothéliales microvasculaires peuvent représenter un meilleur modèle de la fonction de barrière microvasculaire, l'optimisation des protocoles de transfection pour exprimer efficacement GFP-actine dans les cellules endothéliales microvasculaires représente une direction future logique.
En résumé, l'imagerie des cellules vivantes endothéliales exprimant la GFP-actine représente un outil puissant pour déterminer comment le cytosquelette d'actine des cellules endothéliales répond à différents types de stimuli. Des études utilisant des monocouches confluentes étroitement endothéliales aideront à déterminer les rôles des structures dynamiques telles que l'actine riches lamellipodes et transversale des fibres de stress d'arc en fonction de la barrière endothéliale. En outre, imagerie des cellules vivantes des cellules endothéliales exprimant la GFP-actine ou d'autres protéines de fusion qui permettent de visualiser d'autres structures subcellulaires fournira des informations détaillées spatio-temporelle nécessaire pour comprendre la signalisation et les mécanismes structurels qui dintégrité de la barrière éterminer.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Le plasmide GFP-β-actine a été généreusement fourni par le Dr Wayne Orr, LSUHSC-S Département de pathologie, et a été amplifié dans le laboratoire du Dr Becky Worthylake, LSUHSC-NO Département de pharmacologie. Ce travail a été soutenu par des subventions des National Institutes of Health (P20 RR-018 766) et l'American Heart Association (05835386N).
matériels
| Name | Company | Catalog Number | Comments |
| 1. Ringer stock 5x | |||
| Chimique | Société | Nombre de catalogue | Montant |
| Chlorure de sodium | EMD | SX0420-3 | 35 g |
| Chlorure de Potassium | JT Baker | 3040 | 1,75 g |
| Chlorure de calcium | Sigma | C-3881 | 1,47 g |
| Sulfate de magnésium | Sigma | M-9397 | 1,44 g |
| Stérile eau filtrée | N / A | N / A | Porter à 1 L |
| Filtre stérile dans des flacons à l'autoclave et les magasins à 4 ° C | |||
| 2. Tampon MOPS | |||
| Chimique | Société | Nombre de catalogue | Montant |
| MOPS | Sigma | M3183 | 125,6 g |
| Stérile eau filtrée | N / A | N / A | Porter à 1 L |
| Filtre stérile dans des flacons à l'autoclave et les magasins à 4 ° C | |||
| 3. L'albumine du sérum physiologique (APSS) | |||
| Chimique | Société | Nombre de catalogue | Montant |
| Ringer stock (5x) | N / A | N / A | 200 ml |
| Tampon MOPS | N / A | N / A | 5 ml |
| Phosphate de sodium | Sigma | S-9638 | 0,168 g |
| Pyruvate de sodium | Sigma | P5280 | 0,22 g |
| Sel de sodium EDTA | Sigma | ED2SS | 0,0074 g |
| Le glucose | Sigma | G7528 | 0,901 g |
| L'albumine, bovine | USB | 10856 | 10 g |
| Stérile eau filtrée | N / A | N / A | Porter à 1 L |
| Ajuster le pH à 7,4 à 37 ° C, puis filtre stérile dans des flacons à l'autoclave et conserver à 4 ° C. | |||
| 4. Saline à 0,9% | |||
| Chimique | Société | Nombre de catalogue | Montant |
| Chlorure de sodium | EMD | SX0420-3 | 9 g |
| Stérile eau filtrée | N / A | N / A | Porter à 1 L |
| Filtre stérile dans des flacons à l'autoclave et les magasins à 4 ° C | |||
| 5. 1,5% une solution de gélatine | |||
| Gélatine de la peau de porc | Sigma | G2500 | 15 g |
| Saline à 0,9% | N / A | N / A | Porter à 1 L |
| Chauffer la solution à 37 ° C pour dissoudre la gélatine suffisamment. Alors qu'il était encore chaud, filtre stérile dans des flacons à l'autoclave et conserver à 4 ° C | |||
Références
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon