Method Article
Construit en FLS: une méthode simple pour la modification des cellules / Virion surfaces avec une gamme de marqueurs biologiques sans affecter leur viabilité
Dans cet article
Résumé
Fonction-Spacer-lipidique (FSL) des constructions permettent les caractéristiques de surface des cellules vivantes et des virions d'être modifiée sans perte de vitalité. La méthode nécessite seul contact simple de construire une solution avec une cellule de FLS / virion et l'incorporation de surface spontanée et stable se produit.
Résumé
La possibilité de modifier / visualiser des surfaces biologiques, puis d'étudier les cellules modifiées / virion dans une gamme de in vitro et in vivo dans des environnements est essentielle à l'obtention de mieux comprendre le fonctionnement de certaines molécules ou de l'entité entière. Etudes de modification de surface biologiques sont généralement limités à l'ingénierie génétique de l'organisme ou de la fixation covalente des groupements chimiques de la surface de la cellule 1,2. Cependant, ces techniques traditionnelles d'exposer à la cellule de réactifs chimiques, ou qu'ils nécessitent une manipulation importante pour atteindre le résultat souhaité, ce qui les rend lourdes, et ils peuvent, par inadvertance sur la viabilité / fonctionnalité des cellules modifiées. Une méthode simple pour modifier inoffensive la surface des cellules est nécessaire.
Récemment, une nouvelle technologie, la technologie KODE a introduit une gamme de nouvelles constructions comportant trois volets: un groupe de tête fonctionnelle (F), une entretoise (S) et une queue lipidique (L) et sont connus comme fonction-Spacer-lipidiques ou de FLS constructs3. L'entretoise (S) est choisi pour fournir une construction qui est dispersible dans l'eau, mais spontanément et de façon stable incorporer dans une membrane.
FLS construire des groupements fonctionnels (F) à ce jour incluent une gamme de saccharides dont le groupe sanguin déterminants liés, les acides sialiques, les polysaccharides hyaluronane, fluorophores, biotine, radiomarqueurs, et une gamme de peptides 3-12. Les constructions de FLS ont été utilisés dans des embryons de modifier, de spermatozoïdes, le poisson zèbre, les cellules épithéliales / endomètre, les globules rouges, et des virions de créer des contrôles de qualité des systèmes et des panneaux de diagnostic, de modifier l'adhérence cellulaire / interaction / séparation / immobilisation, et pour in vitro et in d'imagerie in vivo de cellules / virions 3-12.
Le processus de modification de cellules / virions est générique et extrêmement simple. La procédure la plus courante est l'incubation des cellules (dans les lipides des médias libres) avec une solution de FLS construit pendant 1-2 heures à 37 ° C 4-10. Durant l'incubation le FSL construit spontanément, intégrer dans la membrane, et le processus est terminé. Le lavage est optionnel. Cellules modifiées par des constructions de FLS sont connus comme kodecytes 6-9, tandis virions sont kodevirions 10.
FLS construit en perfusions directes et kodecytes / kodevirions ont été utilisés dans des modèles animaux expérimentaux 7,8,10. Tous kodecytes / kodevirions semblent conserver leur vitalité normale et la fonctionnalité tout en acquérant la nouvelle fonction de la fraction F 7,8,10,11.
La combinaison de la dispersion dans les médias biocompatible, l'incorporation spontanée dans les membranes cellulaires, et une faible toxicité apparente, rend FSL construit des outils de recherche précieux pour l'étude des cellules et des virions.
Protocole
Le protocole suivant décrit la procédure générique pour l'insertion des constructions FLS (figure 1) dans les membranes biologiques. Par souci de simplicité du protocole fait référence uniquement aux cellules (kodecytes), qui sont à une concentration de 100%. Cependant, les cellules terme est interchangeable avec des virions (kodevirions) ou des organismes ou des structures cellulaires et leur concentration dans le diluant n'est pas important, à condition qu'il soit toujours cohérentes entre les essais, contrôles et essais. Avec les globules rouges du volume globulaire est généralement de 80%, mais avec des virions, d'embryons et d'autres cellules, il est généralement inférieur à 1%. La méthode est très robuste et va produire des membranes modifiées lorsqu'ils sont utilisés par aucun de ses variations, mais le raffinement sera nécessaire d'optimiser et de normaliser le degré de modification nécessaire pour des applications spécifiques.
1. Préparation de FLS Construit
- Pour préparer la solution de reconstituer FLS construire stock du produit sec FLS (tableau 1) par l'ajout de 1,0 ml de diluant (ou comme spécifié dans la notice du produit) dans le flacon de produit. Brièvement soniquer (30 secondes). Cela préparera une solution 1mg/mL, qui peut être répartie dans 100 uL des contenants stériles et stocké à 2-8 ° C pendant une semaine, ou au congélateur jusqu'à 3 mois.
- Pour préparer travaille FLS construire des solutions pour l'insertion, juste avant l'utilisation brève sonication (30 secondes) de la solution stock d'homogénéiser les micelles. Diluer la construction de FLS dans le tampon (de préférence ne contenant pas de lipides ou de matériau très hydrophobe) à la concentration requise ou sur une plage, si désiré.
Notes:
- Les constructions de FLS sera généralement insérer dans les cellules dans les médias lipidique contenant, mais nécessite généralement autant qu'une concentration 50X FLS travail le plus élevé que si les médias en PBS ou autre lipide libre.
- Les dilutions plage de travail dépendra de la demande, la sensibilité méthode de détection, le type de FLS construire, et le degré de modification nécessaire. Typiquement la gamme de dilution sera compris entre 10 à 500 mg de FLS par mL de diluant pour les constructions de FLS et d'hydrates de carbone de 100 à 100 ug / ml pour les constructions de FLS d'autres tels que les fluorophores et la biotine.
- Si la préparation des diluants d'insertion contenant plusieurs FLS construire, il suffit d'ajouter les constructions ainsi que dans le même diluant à la concentration normale de travail. Si une construction est à la concentration beaucoup plus élevée que l'autre, une certaine adaptation (augmentation) de la concentration peut être requise pour la moindre construction. Alternativement constructions peuvent être ajoutés de manière séquentielle, de préférence avec la plus grande concentration de construire en premier, suivi par le moindre.
- FLS concentrations de construire au-dessus de 1000 pg / mL peut introduire des quantités importantes de lipides dans une membrane cellulaire, et peut changer la forme de la cellule ou le rendre plus sensibles à la lyse.
- FLS solutions de construire de travail doit être conservé à 2-8 ° C et utilisé dans quelques jours.
- Les constructions de FLS peut être dilué dans l'eau mais ont réduit la stabilité et doit être utilisé en quelques heures. Si la notice précise de l'eau comme diluant de reconstitution du produit dans le flacon contient également des sels (comme spécifié dans la notice).
2. Insertion de FLS Construire (s) dans les membranes
- Commencez par vous laver les cellules pour FLS libre modification des lipides non liés par centrifugation et l'utilisation de PBS ou de lipides cellulaires des médias libres comme solution de lavage.
- Pack de cellules ou de suspendre dans 100 ul de diluant.
- Simultanément, préparer les témoins qui devraient idéalement être à la fois les cellules non modifiées (incubés avec du PBS, plutôt que solution de FLS) et / ou des cellules modifiées avec un bénin mais liées construire FLS.
- Ajouter 100 ul d'une dilution appropriée de FLS solution (contenant une ou plusieurs constructions FLS) aux cellules et incuber pendant 1-2 heures à 37 ° C. Un résultat similaire peut être obtenu par 6 heures d'incubation à 25 ° C ou une nuit (18 heures) à 4 ° C - un mélange est recommandé tous les quelques heures si lourdes suspensions cellulaires sont utilisés.
- Laver (en option) à deux reprises avec du PBS ou des médias de supprimer tout construit sans FLS et préparer une suspension appropriée.
Notes:
- Le diluant utilisé pour suspendre les cellules peuvent être des milieux de culture cellulaire, le PBS, les solutions de stockage de cellules, etc, mais de préférence sans lipides (par exemple sérum de veau fœtal) ou des détergents (par exemple le Tween).
- Différents volumes (de 100 uL) des ratios (de 1h01 cellules / solution FLS) ou des conditions d'incubation de temps et de température peuvent être utilisés à condition que le même rapport, la concentration et le volume sont utilisés pour obtenir des résultats reproductibles.
3. Manipulation et visualisation
- Une fois le processus de modification de FLS a été achevé le kodecytes peuvent être stockés à 4-8 ° C dans les lipides des médias libres ou utilisés.
- Kodecytes et kodevirions généralement le même comportement que les cellules non modifiées / virions et peut être Handled et consultés dans les systèmes de test normal (microscopie, sérologie, la cytométrie de flux, etc.) Ils n'ont généralement pas d'exigences particulières, sauf pour l'évitement des solvants / détergents / lipides qui peut éluer les constructions à partir des lipides des membranes.
Notes:
- Construit restera dans la membrane des cellules inactives, comme les globules rouges, si elles sont stockées dans les lipides des médias libres pour la vie de la cellule. Dans les cellules avec des membranes actives les constructions seront internalisés et métabolisés, à un taux dépendant de l'activité membrane cellulaire.
- Les cellules mortes contiennent généralement des niveaux élevés des constructions de FLS, ce qui peut être utilisé pour séparer les cellules non viables à partir des cellules viables.
- Si kodecytes sont stockés (ou utilisés in vivo) en lipide contenant des médias / des environnements, tels que le sérum / plasma, la construction va lentement éluer de la membrane sur une période de plusieurs heures ou jours, selon la température et les concentrations de lipides / compositions.
4. Les résultats représentatifs:
- Les résultats représentatifs suivants dépendent de la construction utilisé (tableau 1), sa concentration inséré et la sensibilité et la spécificité du système de détection (s). En général, toutes les constructions de FLS va insérer dans les cellules après 1 heure, mais les conditions optimales devront être établis pour chaque situation.
- Les constructions de FLS peut être utilisé pour étiqueter l'extérieur d'une variété de cellules vivantes 3-9,11,14. Dans les exemples illustrés dans la Figure 2 embryons à des stades différents ont été utilisés (car ils sont fragiles d'une cellule), mais d'autres cellules (Figure 3) ou virions enveloppés (figure 4) peuvent aussi être étiquetés. FSL-fluorescéine permet le marquage direct des surfaces (figures 2-4), tandis que FLS-biotine et d'autres constructions de FLS peut nécessiter l'utilisation d'un système de détection secondaire (généralement avidine / anticorps / lectines) pour montrer leur présence (figures 5) .
- Le groupe sanguin des marqueurs de la spécificité humaine ou animale peut être attaché aux cellules, y compris les globules rouges 4-9 (figure 6). Comme la quantité de FLS construire sur un kodecyte est contrôlable et reproductible 4-6, kodecytes pour dosage des anticorps peut être faite (tableau 2 et graphique 6). La source réelle de cellules n'est pas important, ils peuvent être n'importe quelle espèce, voire de la même origine que la source d'anticorps, ce qui garantit sur l'antigène seulement incompatible, c'est que mis en place par le FSL 7,8 (figure 6).
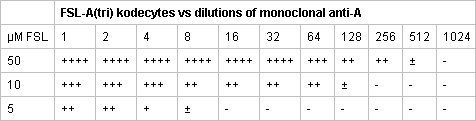
Tableau 2. Représentant réactions sérologiques de trois différents FLS-A (tri) kodecytes globules rouges testé contre les dilutions d'anticorps monoclonaux anti-A. La solution à 50 uM de FLS-A (tri) lorsqu'elle est incubée avec un volume égal de cellules rouges du groupe O produite forte Un cellules antigène positif, qui pourrait être détectée par une dilution 1:512 d'anticorps monoclonaux anti-A. Le 5 - et 10 fois plus faible FLS-A (TRI) des solutions produites kodecytes avec le groupe de moins de sang Une expression de l'antigène.

Figure 1. FLS construire aperçu. Comme une fleur des constructions de FLS se compose de trois éléments majeurs. Le chef fonctionnel (F) dans le cas de la construction de FLS peut être une variété de différents groupes biologiquement fonctionnels, une entretoise (S) conçu pour induire l'espacement des F loin de la membrane, d'améliorer la dispersibilité dans l'eau et être non réactifs avec le sérum, tandis que les lipides diacyle permet la construction d'spontanément intégrer dans les surfaces. (I)-FLS GB3 avec un groupe sanguin Gb 3 (ou P k) trisaccharide Galα4Galβ4Glcβ épitope. (II) FLS-A (tri) avec un groupe sanguin A trisaccharide épitope GalNAcα3 (Fucα2) Galβ. (III) FLS-fluorescéine. (IV) FLS-biotine avec un fragment biotine F unique. Le groupe fonctionnel des structures de I à III sont conjugués à un dérivé activé de l'adipate dioléoylphosphatidyléthanolamine (DOPE) tandis que l'entretoise de structure IV est carboxymethylglycine-adipate base.
Figure 2. FSL-marqué à la fluorescéine embryons murins. Toutes les images sont d'embryons vivants qui ont été étiquetés lorsque leur zone pellucide (ZP) était intacte (c.-à la construction de FLS traversé la ZP à l'étiquette de l'embryon à l'intérieur). Images I-IV sont de ZP-libres libérés de leurs embryons ZP avec de l'acide après Tyrodes étiquetage avec FLS-fluorescéine. Coloration identique se produit indépendamment du fait que les embryons ont été modifiés avec FLS ZP ou ZP intacte libre. Les embryons sont directement marqué avec FLS-fluorescéine, à l'heure 2 37 ° C Méthode dans le sérum sans milieux de culture cellulaire, lavées puis affichés sous microscopie à fluorescence. (I) ZP gratuite de deux cellules d'embryons murins montrant également classique coloration intense corps polaire. (II-III) ZP gratuitement à quatre cellules et huit embryons de cellules murines, deux taches sombres montrant des cellules qui sont outide de l'avion au microscope de mise au point. (IV) ZP libres de cellules d'embryons murins 16. (V) ZP intacte embryons murins blastocyste (D4-D5) où les deux l'embryon et le zona sont étiquetés.

Figure 3. FSL-fluorescéine et le poisson-zèbre 14. (I) microangiographie sur une larve 52 HPF poisson zèbre (heures après fécondation) directement injecté dans la circulation avec FLS-fluorescéine. La vascularisation de poisson zèbre est taché. (II) FLS-fluorescéine hétérogènes cellules Zebrafish tissu rénal (ZK kodecytes) ont été créées ex vivo, puis des micro-injecté dans la circulation d'un poisson zèbre 52 HPF destinataire. Observations in vivo de l'kodecytes ZK ont été faites deux heures après l'injection par l'imagerie de la vascularisation sous fluorescence avec la microscopie time-lapse. Montré est une image vidéo unique avec de grandes cellules lent ou immobile (indiqué par des flèches orange) et rapide des cellules en mouvement (images floues dues aux mouvements - indiquée par des flèches vertes). Étiquetage permet en temps réel dans l'observation in vivo du comportement et de biodistribution du kodecytes ZK. (III) l'absorption orale de FLS-fluorescéine réalisée en plongeant dans les embryons de poissons zèbres FLS-fluorescéine contenant des supports pour un maximum de 5 jours. Le lavage a été réalisé par le transfert d'embryons dans les médias ne contenant pas les constructions de FLS (au moins 6 heures est requis, mais peut être de plusieurs jours). (IIIa) microscopie à champ lumineux du poisson-zèbre FLS-fluorescéine traités correspondant à l'image adjacente à fluorescence (IIIb). La fluorescence est préférentiellement situé dans le tractus intestinal. Aucune coloration n'a été observée chez les embryons témoins non traités (IVa et IVb).

Figure 4. FSL-fluorescéine étiquetage des virions 10 VSV et le virus H1N1. (I) virus de stomatite vésiculaire (VSV) a été directement marqué avec 10 ug / ml FLS-fluorescéine pendant 2 h à 37 ° C, suivie par la fixation au paraformaldéhyde 4% puis la cytométrie de flux. Pas de purification de la VSV kodevirion après étiquetage FLS a été nécessaire. (II) cytométrie de flux de porcs infectés par les cellules testiculaires humaines Un Rico/8/1934 / Porto (H1N1) kodevirions marqué à l'aide FSL-fluorescéine. Les cellules non infectées sont considérés comme la ligne noire tout en fusion de la kodevirion H1N1 avec les résultats des cellules ST dans une cellule fluorescente (ligne rouge).
Figure 5. FLS-biotine cellules marquées et la visualisation ultérieure par avidine marquée 7,8. Toutes les cellules ont d'abord été étiquetés avec FLS-biotine pendant 1 h à 37 ° C, lavées ensuite réagir avec fluorophore avidine marquée, lavés et humides montés pour la microscopie à fluorescence. (I) Compilé image confocale d'un blastocyste d'embryons murins. (II) Centrale tranche confocale de l'embryon de l'image précédente. (III) en direct spermatozoïdes mobiles humains - le flou se produit comme une conséquence de leur mouvement. (IV) fixe (insertion de 4% après paraformaldéhyde) spermatozoïdes humains. (V) des érythrocytes humains. (VI) fixe (4% de paraformaldéhyde pré-insertion) RL95 cancer de l'endomètre humain. (VII) non fixés RL95 endomètre lignée humaine de cellules de carcinome. (VIII) Biotine RBC kodecytes observé dans un échantillon de sang prélevé 2 heures après une perfusion intraveineuse de kodecytes avec (VIII), représentant un champ de vue en microscopie optique tout (VIIIb) est le même domaine visible en fluorescence, l'identification des deux kodecytes présents sur le terrain de vue. Calcul du ratio de kodecytes aux cellules non marquées peut être utilisé comme un indicateur de la survie. (IX) en direct humaine kodecytes biotine endomètre visualisées en se liant à des billes avidinylated.

Figure 6. FSL-Glucides d'ajouter des marqueurs de groupe sanguin pour le profilage sérologique. (I) de globules rouges humains kodecytes Galili ont été créés avec une concentration ensemble de FLS-Galili (500 pg / mL) et testé contre les dilutions de sérum humain. Globules rouges humains n'apparaissent pas naturellement avec l'antigène xenoantigen Galili. Kodecytes peuvent être utilisés à des niveaux quantitatifs d'anticorps dans le sérum. Dans cet exemple, le donneur était déterminé à avoir un titre d'anticorps anti-Galili de 1:32. (II) En créant kodecytes avec diminution des niveaux de FLS («titres d'antigène»), un niveau optimal d'antigène pour détecter les anticorps peuvent être déterminés (dans cet exemple Le a). Les cellules peuvent être créées pour que donner un résultat positif lorsque le taux d'anticorps dépasse un titre spécifique. Le niveau d'antigène FLS nécessaires pour donner un résultat positif dépend de la qualité et le niveau des anticorps détectés. Pour antigènes glucidiques, une solution de FLS de 100 pg / ml entraîne habituellement une forte réaction positive. (III) de l'homme du groupe O les globules rouges ont été modifiés pour avoir un niveau spécifique d'une fourmiIGEN (normalisé A kodecytes), et utilisée pour quantifier précisément et de manière reproductible anti-A dans le sérum humain. Dans cet exemple, l'anti-A titre dans le groupe O testé le sérum est 01h32 et le kodecytes ont été préparés à partir du donneur globules rouges. Groupe sanguin (IV) A et B simultanément les antigènes inséré dans un échantillon du groupe O cellule unique rouges sont utilisés pour créer un kodecytes B faible faible. Ces kodecytes peut être utilisé pour des fins de contrôle de qualité ABO. Ce résultat montre l'analyse d'un spécifiquement formulé une kodecyte B faible faible testée contre les réactifs anti-A et anti-B et donne attendus réactions faibles.
Discussion
Modification des cellules et des virions avec des constructions de FLS est une technique très simple et robuste 3-11. Pour décrire et distinguer FLS construire des cellules modifiées et des virions à partir des cellules non modifiées, ils sont appelés kodecytes et kodevirions respectivement 6-10, mais seulement lorsque le groupe a introduit fonctionnelle peut être montré à être présents sur leur membrane. Lorsque kodecytes sont faites avec différentes concentrations de constructions de FLS, ils peuvent être visés par la concentration de la solution de FLS de construction utilisé pour les créer, par exemple 15 mg / mL Un kodecytes, ou si plus d'un FLS est utilisé, alors un terme combinés, par exemple A + biotine kodecytes 7,8. Lorsque différentes cellules doivent être comparés, y compris le type de cellule dans la description est recommandée, par exemple rouge kodecytes biotine cellulaire ou kodecytes biotine endomètre 7,8.
Bien que le processus d'insertion est très robuste et d'insertion (quoique avec des taux différents) se fera sur une large plage de température de 4 à 37 ° C et en quelques minutes à quelques heures, pour obtenir le contrôle d'insertion reproductibles stricte du temps de contact, température, concentration en FLS ( y compris la formulation de diluant), et dans une moindre mesure la concentration de cellules sont nécessaires. À ce jour, toutes les constructions de FLS peut être utilisé pour modifier les cellules par la même technique 4-11, cependant, il est prévu que certaines conditions seront plus favorables à des flux de travail et / ou les exigences de manutention optimale des cellules / virions d'être modifiés . La concentration exacte de FLS pour obtenir l'effet désiré doit être déterminée par l'utilisateur 4. La résultante de FLS construire des cellules modifiées / virions peuvent généralement être utilisés de la même manière comme une cellule non modifiée / virion dans les systèmes biologiques ou analytique 4-11. Comme les constructions FLS va lentement éluer de surfaces modifiées en cas de contact avec les solutions de lipides 7,8, ou être consommé par les cellules actives 11, ces questions doivent être examinées en ce qui concerne le niveau de signal ou d'activité obtenues sur des périodes de temps. Kodecytes peuvent être fixes (par exemple le glutaraldéhyde / formol) après l'insertion à condition que le fixateur ne contient pas de lipides à élution de solvants et le groupe fonctionnel est compatible avec le fixateur. Alternativement cellules fixes peuvent être modifiés avec des constructions de FLS.
En plus de la modification de la surface des cellules et des constructions virion FSL peut également être perfusée directement dans la circulation des animaux de laboratoire entraînant dans la modification in vivo des cellules circulantes 7 et 12 pour inhiber des virus, des toxines, 12 et 7 anticorps. Construit FLS ont également été utilisés pour décorer les liposomes et peuvent être imprimés sur 13 surfaces de papier, où ils immobilisent, et peuvent ensuite être utilisées dans des tests de diagnostic.
La capacité de modifier facilement les cellules vivantes avec une gamme croissante de constructions FLS devrait se révéler être un outil de recherche utile et de développement pour l'étude de la biologie de la surface cellulaire.
Déclarations de divulgation
Deborah A. Blank et Stephen M. Henry sont des employés et les actionnaires de KODE Biotech Limited le propriétaire du brevet de la technologie KODE. Dan Bess est un employé de Sigma-Aldrich, qui a parrainé la production de cette vidéo article.
Remerciements
Les auteurs remercient Dan Bess de Sigma-Aldrich pour la présentation de la vidéo. Nous remercions également la Direction générale de Don, Evgenii Cherny, Scott Chesla, Elizabeth Hadac, Amanda Harrison, Damien Heathcote, Annika Hult, Chuan-Ching Lan, Susannah McIntosh, Sarvani Komarraju, Elena Korchagina, Caroline Olivier, Martin Olsson, Stephen Parker, Igor Rodinov, Alexander Tuzikov, et Eleanor Williams pour leurs résultats et leurs contributions à la conception, la synthèse de constructions de FLS et de déterminer l'activité biologique.
matériels

Tableau 1. Commercialement disponibles construit FLS décrites dans ce document.
Références
- Waehler, R., Russell, S. J., Curiel, D. T. Engineering targeted viral vectors for gene therapy. Nat. Rev. Genet. 8, 573-587 (2007).
- Strable, E., Finn, M. G. Chemical modification of viruses and virus-like particles. Curr. Top. Microbiol. Immunol. 327, 1-21 (2009).
- Henry, S., Bovin, N. The development of synthetic peptidolipids, glycolipids and other lipid-linked structures to create designer red cells. Transfusion. 48, Suppl 2S. 194A-194A (2008).
- Frame, T., Carroll, T., Korchagina, E., Bovin, N., Henry, S. Synthetic glycolipid modification of red blood cell membranes. Transfusion. 47, 876-882 (2007).
- Hult, A. K., Frame, T., Henry, S., Olsson, M. L. Flow cytometry evaluation of red blood cells transformed with variable amounts of synthetic A and B glycolipids. Vox Sang. 95, Suppl 1. 180-180 (2008).
- Henry, S. Modification of red blood cells for laboratory quality control use. Curr. Opin. Hematol. 16, 467-472 (2009).
- Oliver, C., Blake, D., Henry, S. In vivo neutralization of anti-A and successful transfusion of A antigen incompatible red cells in an animal model. Transfusion. , Forthcoming (2011).
- Oliver, C., Blake, D., Henry, S. Modeling transfusion reactions and predicting in vivo cell survival with kodecytes. Transfusion. , Forthcoming (2011).
- Heathcote, D., Carroll, T., Wang, J. J., Flower, R., Rodionov, I., Tuzikov, A., Bovin, N., Henry, S. Novel antibody screening cells, MUT+Mur kodecytes, created by attaching peptides onto erythrocytes. Transfusion. 50, 635-641 (2010).
- Hadac, E. M., Federspiel, M. J., Chernyy, E., Tuzikovb, A., Korchagina, E., Bovin, N. V., Russell, S. J., Henry, S. M. Fluorescein and radiolabeled Function-Spacer-Lipid constructs allow for simple in vitro and in vivo bioimaging of enveloped virions. J Virol Meth. 10, Forthcoming (2011).
- Blake, D., Lan, A., Love, D., Bovin, N., Henry, S. Fluorophore-kodecytes - fluorescent function-spacer-lipid (FSL) modified cells for in vitro and in vivo analyses. FEBS J.. 277, Suppl 1. 199-199 (2010).
- Harrison, A. L., Olsson, M. L., Brad Jones, R., Ramkumar, S., Sakac, D., Binnington, B., Henry, S., Lingwood, C. A., Branch, D. R. A synthetic globotriaosylceramide analogue inhibits HIV-1 infection in vitro by two mechanisms. Glycobiology. 27, 515-524 (2010).
- Barr, K., Diegel, O., Parker, S., Bovin, N., Henry, S. Function-Spacer-Lipid (FSL) constructs enable inkjet printing of blood group antigens. FEBS J. 277, Suppl 1. 235-235 (2010).
- Lan, C. -C. Modeling inflammatory bowel disease [dissertation]. , University of Auckland. Auckland. (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon