Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse de la migration cellulaire Tronc Crête neurale en utilisant une modification Zigmond Chambre Assay
Dans cet article
Résumé
An approach to analyze the migration of explanted cells (trunk neural crest cells) is described. This method is inexpensive, gentle, and capable of distinguishing chemotaxis from both chemokinesis and other influences on migratory polarity such as those derived from cell-cell interactions within the primary trunk neural crest cell culture.
Résumé
Cellules de la crête neurale (CCN) sont une population de passage de cellules présentes dans le développement des vertébrés qui émigrent à partir du tube neural dorsal (NT) après avoir subi une 1,2 transition épithélio-mésenchymateuses. Après EMT, CNC migrer de grandes distances le long des voies stéréotypés jusqu'à ce qu'ils atteignent leurs objectifs. CNC se différencier en un vaste éventail de types de cellules, y compris les neurones, cellules gliales, les mélanocytes et les cellules chromaffines 1-3. La capacité du CNC à atteindre et à reconnaître leurs emplacements cible appropriée est fondamentale pour la formation appropriée de toutes les structures contenant le tronc de la CCN composants dérivés 3. Élucider les mécanismes d'orientation pour le tronc de la CCN de migration a donc été un sujet de grande importance. Plusieurs molécules ont été démontrés pour guider la CCN migrations 4. Par exemple, les CNC du tronc sont connus pour être repoussés par des signaux de guidage négatifs tels que Semaphorin, Ephrine et les ligands fente 5-8. Cependant, ne pasjusqu'à récemment toute chimiotactiques du CNC du tronc été identifiés 9.
Conventionnel dans les approches in vitro pour étudier le comportement chimiotactique de cellules adhérentes mieux travailler avec immortalisé, de façon homogène les cellules distribuées, mais sont plus difficiles à appliquer à certaines cultures primaires de cellules souches qui n'ont pas d'abord une distribution homogène et rapide de différencier (comme CNC). Une approche pour homogénéiser la répartition de la CNE du tronc pour les études de chimiotactisme est d'isoler les CNC du tronc de l'enseignement primaire des cultures d'explants NT, puis soulevez et replate qu'ils soient près de 100% de confluence. Cependant, cette approche nécessite plaquage des quantités substantielles de temps et d'effort pour explant suffisamment de cellules, est rude, et distribue des CCN du tronc d'une manière différente à celle trouvée dans des conditions in vivo.
Nous rapportons ici une approche in vitro, qui est en mesure d'évaluer la chimiotaxie et d'autres réponses migratoires des CNC tronc sans requirindistribution de ga cellulaire homogène. Cette technique utilise imagerie time-lapse du primaire, imperturbable CNC tronc intérieur d'une chambre modifiés Zigmond (une chambre standard de Zigmond est décrit ailleurs 10). En exposant CNC tronc à la périphérie de la culture à un gradient de chemotactant qui est perpendiculaire à leur directivité naturelle prédit, des altérations de la polarité migratoires induits par le gradient chemotactant appliquée peut être détecté. Cette technique est peu coûteuse, nécessite la mise en culture d'explants NT seulement deux pour le traitement de reproduire, de levage évite de cellules dures (telles que la trypsine), laisse les CNC malle dans une distribution plus semblable à des conditions in vivo, réduit la quantité de temps entre l'explantation et l'expérimentation (ce qui réduit probablement le risque de différenciation), et permet time-lapse d'évaluation des caractéristiques de nombreux migrateurs.
Protocole
1. Jour 1: Isolement des tubes du tronc de neurones pour une nuit de culture sur des lamelles
- Oeufs chiches Incuber 56 h à 38 ° C. Retirer les oeufs de l'incubation, les pulvériser légèrement à l'éthanol 70%, puis laissez-les sécher. Casser les oeufs s'ouvrent sur un plateau en verre stérilisée aux UV.
- Extrait chaque embryon de son jaune d'oeuf et le placer dans chiches Ringer. Pour ce faire, la première coupe autour de ses îles de sang avec des ciseaux courbes, puis, avec une pince émoussée, choisissez l'embryon par sa membrane extra-embryonnaires et le placer dans une boîte de Pétri stérile en plastique contenant une solution de Ringer chiches.
- Isoler le tronc de chaque embryon par le parage des membranes extra-embryonnaires l'excédent ainsi que crânienne, vagal, et sacrée niveaux axiaux à l'aide d'une aiguille de tungstène (Fig. 1). D'abord, sélectionnez environ 9 embryons qui sont entre les stades HH15-17 11. Pour les stades HH15 et plus, les axes cerveau et du cerveau postérieur forment un angle aigu et donc la tête semble incliner caudalement. Astade de HH17, le bourgeon caudal est présent et s'incline face ventrale, mais ne contient pas encore somites. Avec une aiguille de tungstène, coupez les membranes extra-embryonnaires à environ 2 mm de l'embryon et de couper toute les tissus embryonnaires antérieure à somite 10. Également supprimer tous les tissus embryonnaires à partir de caudale autour de la cinquième plus somite nouvellement formé.
- Placez les troncs isolés embryonnaire dans dispase (0,24 U / ml de DMEM) et les incuber pendant 1 h 15 min à 37 ° C et 5% de CO 2. Une fois les troncs d'incubation commence, commencer à préparer six lamelles (CS) pour des explants NT culture (01/05 au 01/08 étapes).
- Rincez 6 CS d'éthanol à 70% (dilué dans de l'eau stérile ultrapure), puis laissez-les sécher. L'utilisation d'un marqueur de laboratoire, dessiner un cercle au centre de chaque CS qui est d'environ 1 cm de diamètre (ce cercle va vous aider à identifier plus tard, où une couche de fibronectine a été appliqué). Sur la même face de chaque CS, écrire le mot «être» (ou tout autre mot ou asymétrique de forme) en dehors du cercle tracé (ce qui aidera à yous déterminer si le côté marqué du CS est orientée vers le haut ou vers le bas).
- Placez chaque CS dans un 40 x 10 séparés plat mm stérile avec la surface marquée vers le bas et permettre le plat de s'asseoir ouverte sous un lampe UV germicide pendant 10 min.
- Appliquer 60 fibronectine ul (FN, 10 pg / ml DMEM) à la surface banalisée de la CS, tout en veillant toute la zone au sein du cercle de 1 cm est recouvert. Placez les plats à incuber à 37 ° C pendant 30 min puis aspirer délicatement la fibronectine de chaque CS.
- Ajouter 250 ul "culture" moyen [DMEM avec L-glutamine (2 mM), pénicilline (100U/ml), streptomycine (100 mcg / ml), et 8% de sérum bovin fœtal (FBS)] pour la zone FN-enduite le CS. Placez les boîtes contenant chacune CS à 37 ° C et 5% de CO 2 jusqu'à ce que le SNRC ont été isolés.
- Transfert de tous les troncs d'embryons incubés à un plat de 5 cm en verre de Pétri contenant du milieu L15 et commencer à disséquer chaque NT à l'aide de pinces fines et une aiguille de tungstène (Fig. 1). Carefully tranche le long de la frontière de la NT et les somites avec une aiguille de tungstène forte tout en étant prudents de ne pas endommager le NT. Il est souvent plus facile de commencer à isoler chaque NT à partir de l'extrémité caudale-la plupart du tronc.
- Sélectionnez 6 de la plus longue et la plus droite NTs à la culture durant la nuit (SNRC entre environ 8 et 15 somites longues sont recommandées). En utilisant une pointe de micropipette apprêtée avec un milieu de culture, le transfert de chacune des 6 nuits à ses propres préalablement préparé CS (de 1,5 à 1,8 étapes). Soyez sûr que le NT ne reste flottant à la surface. Si le NT est flottant, au goutte à goutte milieu sur lui jusqu'à ce qu'il coule à l'aide d'une micropipette.
- Placez chaque plat à 37 ° C et CO 2 5% durant la nuit. Soyez prudent de s'assurer que chaque NT est dans la zone FN enduits de ses respectives CS immédiatement avant de placer le plat dans l'incubateur (en utilisant le cercle tracé à l'étape 1.5 comme référence). Une micropipette peut être utilisé afin de mieux ajuster la position de chaque NT si nécessaire.
- Place àau moins 2 ml de milieu de culture (sans sérum) dans un tube à centrifuger stériles de 15 ml et incuber une nuit à 37 ° C et 5% de CO 2. Laissez le bouchon légèrement dévissé pour permettre le pH du milieu pour ajuster la nuit. Pré-incuber le milieu est importante pour aider à prévenir la formation de bulles dans votre chambre, ce qui peut perturber l'établissement d'un gradient moléculaire. Ces «pré-incubées" milieu doit être utilisé dans toutes les étapes futures. Lorsqu'il n'est pas utilisé, ce milieu doit être en incubation à 37 ° C.
2. Jour 2: Chargement de la chambre modifiés Zigmond et time-lapse d'analyse de la migration cellulaire
- Sur les 6 nuits en culture, sélectionnez les 3 cultures mieux adaptées à l'analyse. Généralement, les cultures de la CCN qui ont au moins un long bord droit doit être sélectionné (figure 2A). Les 3 meilleures cultures seront utilisés pour charger et film 3 chambres modifiés Zigmond toute la journée, chacun avec un traitement différent. Sur les trois cultures, choisissez l'une des loading la première chambre et remet les autres dans l'incubateur pour une utilisation ultérieure.
- En utilisant un coton-tige, appliquez une fine couche de gelée de pétrole entourant les réservoirs et le pont d'une seule chambre modifiés Zigmond.
- Avec une aiguille de tungstène, retirez délicatement le NT à partir de la CS, tout en laissant le CNC entourant attaché à la surface de la CS. Marquer le plat avec un stylo à retenir l'orientation des droites bord de la culture de la CCN.
- Placez quelques gouttes de milieu préincubées sur le pont. Ramassez la CS avec une pince fine, tamponnez le bord de la CS contre un Kimwipe pour enlever la plupart du milieu de culture ancienne, puis placez immédiatement le CS sur la chambre modifiés Zigmond sorte que le bord droit de la culture d'être filmé est centré sur la longueur du pont et à peu près perpendiculaire à la frontière du pont-réservoir (Fig. 2A, B).
- En utilisant un microscope inversé, déplacer la frontière droite de la CCN pour être sur le côté du pont le plus proche de ee réservoir qui contiendra les chemotactant suspectée (figure 2B; pour les contrôles de cela correspondra à réservoir est chargé selon seconde). En outre, plus finement aligner le bord droit de la culture à être perpendiculaire à la frontière du pont-réservoir.
- Soigneusement, mais solidement appuyer sur le CS en la gelée de pétrole présents sur la chambre Zigmond, en s'assurant qu'il est complètement étanche à la chambre, puis placez pétroliers supplémentaires de gelée le long du bord de la CS pour mieux garantir qu'il sera hermétique. Beaux-ajuster l'angle de la frontière de la CCN à nouveau pour corriger tout mouvement pendant le processus d'étanchéité.
- Charger le réservoir qui ne contient pas le chemotactant soupçonnés première (figure 2B). Le faire par le chargement d'une seringue de 1 ml (25 G x 1,5 po aiguille attachée) avec environ 300 moyennes préincubées ul et injecter le support dans le réservoir jusqu'à complet (tout en faisant attention de ne pas générer de bulles dans le réservoir). Branchez le réservoir sur les deux côtés avec un suffmontant icient de gelée de pétrole avant de charger le réservoir suivant.
- Répétez l'étape 2.7, sauf que cette fois en utilisant un milieu contenant du préincubées chemotactant candidat. Il est essentiel lors de la génération d'un gradient moléculaire à travers la culture de toujours charger le réservoir contenant la molécule à tester après le chargement du réservoir manque la molécule testée.
- Placez la chambre chargée Zigmond à 37 ° C à incuber pendant 1 h avant le tournage. Image les plus droites frontières de la culture de la CCN pour 3 h à 90 s intervalles tout en incubation à environ 37 ° C (Fig. 2A, B). Avant de créer n'importe quel film, assurez-vous d'aligner la caméra de sorte que le bord des images d'être obtenus sont alignés avec et toucher le bord du pont qui borde le dernier réservoir chargé (Fig. 2B, panneau supérieur; zone en pointillés représente idéale position pour l'imagerie). Cela facilitera plus tard, un logiciel d'analyse par la standardisation de la directionnalité du gradient moléculaire appliquée et thélectronique à distance à partir du réservoir filmé dans chaque film produit.
- Pour les contrôles, répétez les étapes 2.2 à 2.9 pour chacune des deux cultures de la CCN d'autres sélectionnés (à l'étape 2.1), mais remplir chaque réservoir avec un milieu approprié. Pour un type de contrôle de remplir les deux réservoirs de moyenne préincubées ne contenant pas la molécule à tester. Pour un traitement de contrôle de second, le premier le pont avec quelques gouttes de milieu préincubées contenant le chemotactant suspectée avant de monter le CS. Ensuite, chargez les deux réservoirs avec le même milieu contenant le chemotactant suspectée.
- Utilisez ImageJ (NIH) suivi manuel (rsb.info.nih.gov / ij / plugins / piste / track.html) et le chimiotactisme et la Migration Tool v1.01 (www.ibidi.de / applications / ap_chemo.html) plugins pour suivre la migration des CNC périphérique le long de la frontière droite de la culture jUST imagé et d'analyser les différents paramètres des trajectoires migratoires obtenus (Fig. 2B-C).
3. Les résultats représentatifs:
Un échantillon de trajectoires de cellules à partir d'un film où le tronc de nombreux CNC ont été sensibles à un facteur chimiotactique candidat en utilisant la technique ci-dessus est montré (Fig. 2D). La plupart des cellules dans cet exemple d'une réponse positive affiché un net mouvement jusqu'à le gradient chimiotactique (comme indiqué en rouge). Données de trajectoire peut être utilisé pour analyser d'autres propriétés de la migration des cellules aussi bien.
Afin d'évaluer visuellement un gradient appliqué dans une chambre modifiés Zigmond, une Alexa Fluor 488 IgM conjugué (MW ~ 900 kDa) a été chargé dans le second réservoir d'une chambre modifiés Zigmond (à environ 40 pg / ml H 2 O). Un gradient a été établi par 1 h et encore un peu présent après 26 h, mais fortement diminuée par 50 h (fig. 3). Si la molécule à tester est plus petit, alors le gradient appliquée wiLL se dégradent plus vite que ce qui est montré.

Figure 1. Explantation du tronc au niveau du SNRC pour la culture de la nuit sur la fibronectine revêtement des lamelles. Parce que le tronc CNC se décoller de la dorsale NT situé à côté de somites 8-28, ce segment de la NT est isolée par microdissection et cultivées pendant une nuit sur un CS fibronectine revêtement pour permettre l'émigration des CNC à partir de l'explant NT. NTs isolés qui sont entre 8-15 somites long et relativement droites sont les mieux adaptées pour la culture du jour au lendemain comme ils ont tendance à donner plus aux cultures CCN frontières droites. Régions du tube neural qui donnent lieu à d'autres neurones niveaux de crête axiale sont présentés dans une police plus petite. s, somites.

Figure 2. Méthode d'évaluation de la migration des CNC tronc explantésen utilisant une chambre modifiés Zigmond. (A) Allongée tronc cultures CCN sont préparés par mise en culture de nuit de NTS et résultante des cultures de la CCN avec au moins une longue frontière droite sont sélectionnés pour l'expérimentation. La plus longue frontière droite d'une culture choisie est alors positionné perpendiculairement à la frontière du pont-réservoir, et donc parallèle au vecteur du gradient de l'avenir appliqué. (B) Après le beau-ajustement de la position de la culture de la CCN sur la chambre Zigmond et d'étanchéité la lamelle de la chambre, la chambre est chargée. Lors du test de chimiotactisme, le réservoir qui ne contient pas le chemotactant suspectée (-) est chargé en premier et scellé. Ensuite, l'autre réservoir est chargé avec la chemotactant suspectée (+) et scellé. CNC périphérique long de la frontière préalablement sélectionnés peuvent ensuite être visualisés et suivis en utilisant le plugin Manuel de suivi pour ImageJ (panneau inférieur). (C) de nombreuses caractéristiques migratoires en réponsele gradient appliqué peut être évaluée à partir des données de suivi. Par exemple, un indice de chimiotactisme peut être calculée en divisant le déplacement d'une cellule le long de l'axe x par la distance totale qu'il a migré. (D) Un exemple d'une réponse intéressante est représentée par une parcelle de trajectoire cellule initialement générées par le chimiotactisme et la migration Outil pour le plugin ImageJ. Le point de départ de chaque trajectoire est fixé à l'origine (0,0). Notez combien de cellules migrent vers le centre source.The chimiotactique de la masse de toutes les cellules à leur position finale (croix bleue; toutes les cellules pondération égale) est aussi proche de la source chimiotactique. CNC, les cellules de la crête neurale, pistes rouges, les cellules qui ont migré vers le réservoir chargé avec un chimioattractive soupçonné; pistes noires, les cellules qui ont migré loin; (+), une concentration plus élevée chemotactant; (-), concentration inférieure chemotactant.

Figure 3. profils d'intensité à travers le pont d'une chambre modifiés Zigmond à différents moments après l'ajout d'un Alexa Fluor 488 conjugué IgM. La chambre a été chargé d'une manière semblable à celle décrite dans le protocole avec les principales exceptions que l'eau préincubé (au lieu de moyennes préincubées) a été utilisé pour diluer l'anticorps à 40 pg / ml, et de petites poches d'air ont été présentes aux extrémités du pont (loin de la tranche où les profils d'intensité prises ci-dessus où). Au départ, aucun gradient était présent dans la plupart des ponts. Par une pente ha a été créé et est resté présent à travers à 26 h. En 50 h la présence de la pente était incompatible à différents domaines de la passerelle, et lorsqu'il est présent, la raideur de la pente a été grandement diminuée. Tous les profils ont été générés à partir d'un morceau identique sur le pont (d'un pont-réservoir frontière à l'autre) en utilisant le logiciel AxioVision 4.6. Notez que même lorsque l'airpoches étaient présents, le gradient n'a pas été perturbé. Haute, de haute intensité; faible, de faible intensité; axe des x, distance à travers toute la largeur du pont (2 mm); (+), d'un réservoir chargé de l'Alexa Fluor 488 conjugué IgM; (-), le réservoir n'est pas chargé avec le conjugué.
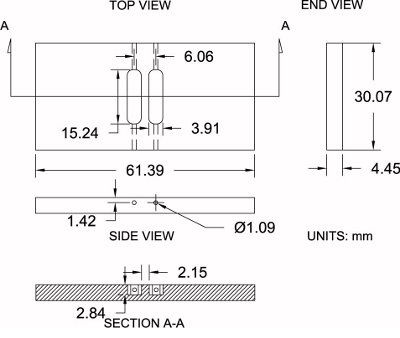
Figure 4. Zigmond modification des spécifications de chambre. Montré est un diagramme de la chambre modifiés Zigmond utilisé ici avec son cahier des dimensions (± 0,2 mm). Les mesures peuvent être modérément ajustées afin de correspondre à des préférences individuelles.
Protocole complémentaire: Fabrication d'une Chambre de modification Zigmond
S'il vous plaît se référer à la figure 4 comme une référence pour le protocole ci-dessous:
- Achat d'une feuille de 3 / 16 "polies acryliques épais (4,45 mm d'épaisseur réelle).
- En utilisant une scie circulaire, couper les blancs de chambre surdimensionné pour l'dimensions approximatives de 33,25 mm x 64,57 mm. Cela permet à 3,175 mm matériels supplémentaires pour l'usinage.
- Réglez la vierge de chambre sur un étau. Avec une fraiseuse et un 6,35 mm (1 / 4 ") bit fraise en bout, la finition d'usinage sur les côtés de la chambre de leurs dimensions exactes: 30,07 mm x 61,39 mm.
- Position de la chambre de vide sur la machine de fraisage et de localiser le centre de la vierge le long des axes x et y avec un palpeur, puis à zéro l'emplacement du centre.
- Acquérir la hauteur de chambre (axe z) en touchant le petit moulin à terme à la surface supérieure et zéro de la hauteur.
- L'utilisation d'un mm 3,91 (0,154 ") bit fraise en bout, de compenser les bits 3,03 mm le long de l'axe des x (sens positif) pour le premier réservoir. Commencez d'usinage dans la chambre à une profondeur de 2,84 mm tout en se déplaçant le long de l'axe y (sens positif) à 7,62 mm (0,300 "), puis traverser à 7,62 mm (0,300") dans le sens opposé (négatif) en direction d'un réservoir complet longueur de 15,24 mm (0,600 "). Offsetle bit à 3,03 mm (0,119 ") le long de l'axe x (sens négatif) et répétez le même processus pour le deuxième réservoir.
- Position de la chambre sur son bord et percer un trou avec un 1,09 mm (0,043 po) foret sur la fin de chaque réservoir (4 au total) qui relie l'extrémité du réservoir sur le côté de la chambre pour le chargement de support lors de l'expérimentation.
- Faire tremper la chambre bien dans l'eau chaude savonneuse pour aider à éliminer tous les contaminants chimiques.
- Trempez et rincez la chambre bien à l'eau bidistillée pour enlever tout le savon. Les chambres sont maintenant prêts à utiliser comme décrit ci-dessus.
Discussion
Conducting chemotaxis research on trunk NCCs has proven challenging for a series of reasons. Trunk NCCs constitute a heterogeneous stem cell population that will differentiate if cultured long-term; therefore, trunk NCCs must be obtained from primary explantation of the trunk-level NT. Conventional methods to study the chemotactic response of homogenously distributed cell populations in vitro are difficult to test on trunk NCCs since they first require that cells are isolated and homogenously replated in ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
We give special thanks to Lino Kim, Steve Guzman and Ujit Satyarthi for technical assistance during the development of this method. Myron Hawthorne, Richard Spengel, and Roberto Rojas machined the chambers used here and provided much-needed technical assistance. Notably, Roberto Rojas produced Figure 4. We are also thankful for Scott Fraser’s invaluable advice prior to the development of the above chemotaxis assay. This work was partly supported by an NIH-MBRS SCORE-5S06GM048680-13 to MEdB and by an award from the CSU, Northridge Graduate Thesis Support Program to CW.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Omega Scientific | DM-22 | |
| Penicillin Streptomycin Solution | Omega Scientific | PS-20 | 100X Stock Concentration |
| L-Glutamine | Omega Scientific | GS-60 | 100X Stock Concentration |
| Fetal Bovine Serum | Omega Scientific | FB-11 | Lot# 105247 (or another that is comparable) |
| Modified Zigmond chamber | Home made | N/A | Reservoir volume: ~ 160 μl ea; for additional specifications, see Fig. 4 and the supplemental fabrication protocol |
| Cell culture dish | Denville | T6040 | 40 x 10 mm |
| Fibronectin | BD | 354008 | 10X Stock prepped by diluting 1 mg FN in 1 ml H2O and 9 ml DMEM |
| Coverslips | Fisher | 12-548-B | Precleaned; 22 x 22 mm |
| L15 medium | Thermo Scientific | SH30525.02 | |
| Petroleum Jelly | Comforts | 011110794642 | 100% |
| Centrifuge tube | Biologix | 10-9152 | 15 ml |
| Dispase | Cell Systems | 4Z0-850 | 10X Stock Concentration |
| Syringe | BD | 309602 | 1 ml |
| Needle | BD | 305127 | 25 G x 1.5 in. |
| Alexa Fluor 488-IgM | Invitrogen | A21042 | Stock is 2 mg/ml; 7 moles dye/mole IgM |
| Dissecting Forceps | FST | Misc. | Dumont #5 or 55; straight tipped; stainless steel or titanium |
| Tungsten Needle | N/A | N/A | Home made; placed in a pin holder |
| Blunt Forceps | Tiemann | 160-18 | Used for transferring embryos to Ringer's from egg yolk |
Supplemental Protocol: Fabrication of a Modified Zigmond Chamber | |||
Please refer to Figure 4 as a reference for the protocol below: | |||
| |||
Références
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon