Method Article
Construire un petit budget laser axotomie système pour étudier la régénération des axones dans le C. elegans
Dans cet article
Résumé
Laser axotomie suivie par imagerie time-lapse est une manière sensible pour doser les effets des mutations dans C. elegans Sur la régénération axonale. Une haute qualité, mais peu coûteux, le système d'ablation laser peut facilement être ajouté à la plupart des microscopes. Laps de temps d'imagerie plus de 15 heures nécessite une immobilisation attention du ver.
Résumé
Laser axotomie suivie par microscopie time-lapse est un test sensible des phénotypes régénération des axones dans C. elegans 1. La principale difficulté de ce dosage est le coût perçu ($ 25-100K) et de l'expertise technique nécessaire pour mettre en œuvre un système d'ablation laser 2,3. Toutefois, les lasers à impulsions à l'état solide des coûts modestes (<$ 10K) peut fournir une performance robuste pour l'ablation au laser dans des préparations transparentes où les axones cibles sont «proches» de la surface du tissu. Construction et de l'alignement d'un système qui peut être accompli en une journée. Le chemin optique fournie par la lumière du condenseur concentré à l'ablation laser fournit un guide d'alignement commode. Un module intermédiaire avec toutes les optiques retiré peut être dédié à l'ablation laser et assure qu'aucun des éléments optiques doivent être déplacés lors d'une séance d'ablation laser. Un dichroïque dans le module intermédiaire permet l'imagerie simultanée et l'ablation laser. Centrer le faisceau laser to le faisceau sortant de la lentille de condenseur de microscope concentré guides de l'alignement initial du système. Une variété de lentilles sont utilisés pour conditionner et d'élargir le faisceau laser pour remplir l'ouverture arrière de la lentille de l'objectif choisi. L'alignement final et les essais sont effectués avec une cible de surface miroir glisser façade en verre. Puissance du laser est ajustée pour donner une place de taille minimale d'ablation (<1um). Le spot d'ablation est centré par des ajustements précis du miroir dernière cinématiquement montée en réticule fixe dans la fenêtre d'imagerie. Laser de puissance pour axotomie sera d'environ 10 fois plus élevée que celle nécessaire pour la tache d'ablation minimale sur la diapositive cible (cela peut varier avec la cible que vous utilisez). Les vers peuvent être immobilisés pour le laser axotomie et imagerie time-lapse en montant sur des patins d'agarose (ou en microfluidique chambres 4). Coussinets Agarose sont facilement faites avec 10% d'agarose dans une solution saline équilibrée fondu dans un four micro-ondes. Une goutte d'agarose fondu est placé sur une lame de verre et aplatie avec un autrelame de verre dans un pavé d'environ 200 um d'épaisseur (une seule couche de ruban de temps sur des lames adjacentes est utilisé comme une entretoise). Un "Sharpie" bouchon est utilisé pour découper un bloc de diamètre uniforme circulaire de 13mm. Anesthésique (1UL Muscimol 20mm) et des microsphères (Chris Fang-yen communication personnelle) (1UL 2,65% polystyrène 0,1 um dans l'eau) sont ajoutés au centre du pavé suivie par 3-5 vers orienté de sorte qu'ils sont couchés sur leurs côtés gauche. Une lamelle de verre est appliquée et ensuite la vaseline est utilisé pour sceller la lamelle et d'empêcher l'évaporation de l'échantillon.
Protocole
1. Construction d'un système d'ablation laser
Porter des lunettes de sécurité laser et l'utilisation de bonnes pratiques de sécurité laser lors de l'alignement initial. Ne regardez jamais à travers les oculaires lorsque le laser est activé.
- Disposez les composants sur la carte de test, comme indiqué dans la Fig. 1 (voir aussi l'exemple 2). Bolt bas du laser (avec une plaque de contremarche si nécessaire), après périscope, et les supports ferroviaire surélevée.
- Positionnez votre microscope pour s'aligner sur l'axe ferroviaire. Aligner avec le faisceau lumineux transmis par le condenseur du microscope. Aligner la hauteur du rail (utiliser un niveau) et la position avec une ouverture réglable ou une lentille apposée sur le rail. L'ouverture ou la lentille doit être aligné aux deux extrémités du rail à la poutre condenseur. Connecteurs de laboratoire peuvent aider à l'ajustement en hauteur du rail.
- Aligner le polariseur Glan-Thompson et lame demi-onde du faisceau laser. Vous n'avez pas besoin du laser sur de faire cet alignement. Le bEAM a juste besoin de passer par les deux sans toucher les bords. Faites pivoter le filtre pour fournir une orientation pratique et la position de la décharge de faisceau (fig.1). Vous tournez la plaque demi-onde pour ajuster la puissance du laser. Fixez les composants de la carte de test.
- Allumez le laser, réglez la fréquence des impulsions à 100, en mode continu, et de réduire à un minimum de puissance en utilisant la lame demi-onde. Utilisez une note Post-It ou du papier pour objectif de visualiser le faisceau laser.
- Ajuster et fixer les miroirs montés cinématiquement dans la séquence du laser pour amener le faisceau vers le miroir qui est monté sur l'extrémité du rail élevée. Le faisceau laser doit être aligné à peu près au centre des miroirs. Les miroirs doivent être orientés approximativement 45 degrés à l'axe du faisceau laser (fig.1).
- Grossièrement ajuster le miroir cinématiquement monté sur le dessus du périscope et à l'extrémité du rail pour aligner le faisceau laser au centre du faisceau lumineux transmis par le microscope. Tant le faisceau laser et til a transmis faisceau lumineux du microscope peut être simultanément visualisées par insertion du papier dans le trajet du faisceau. Assurez-vous que les filtres ND et ouvertures dans le module intermédiaire sont ou totalement ouverte.
- Finement aligner le faisceau laser au centre du faisceau lumineux transmis avec les réglages fins sur le périscope haut et miroirs ferroviaire. Maintenez le papier à proximité du miroir ferroviaire et aligner le faisceau laser au centre du faisceau de lumière transmise avec le miroir du périscope haut. Maintenez le papier près du port de microscope et d'aligner le faisceau laser au centre du faisceau de lumière transmise avec les ajustements miroir ferroviaire (fig.2).
- Placez un post-it dans la trajectoire du faisceau entre le condenseur et la tourelle aligné objectif ouvert. Vous devriez voir le faisceau lumineux transmis par le faisceau laser à petit près du centre. Utilisez les réglages fins sur le miroir du rail au centre du faisceau laser. Fixer le microscope en place avec des pinces.
Les étapes 10.9 à 1.12 sont facultatifs, mais il est facile et utile pour évaluer l'alignement et l'ablation au laser avant d'ajouter les lentilles faisceau expansion.
- Eteignez le laser et d'engager l'obturateur de sécurité mécanique. Tournez le hors dichroïque 50% du trajet du faisceau. Même si aucune lumière directe au laser va passer à l'oculaire, la lumière réfléchie peut être assez intense. Mont de la diapositive cible pour l'alignement d'image fine et avec l'objectif d'huile 60X. Focus sur les rayures sur la diapositive. Mettez dans le ND4 et ND8 filtre dans le module intermédiaire.
- Image de la diapositive cible avec votre CLSM, disque tournant, ou un système de caméra CCD. Tournez le dichroïque 50% dans la trajectoire du laser. De ce point, vous ne devriez jamais regarder à travers oculaires alors que le laser d'ablation est activé. Allumez le laser d'ablation et de définir le mode de déclenchement, de la fréquence à 100, et le nombre d'impulsions à 10. Assurez-vous que la puissance est toujours réglé au minimum avec la lame demi-onde, puis ouvrir l'obturateur de sécurité mécanique. Vous pouvez simultaneoul'image rusé et utiliser l'ablation par laser.
- Alors que l'imagerie de la diapositive cible, déclencher l'ablation laser. Vérifiez la diapositive cible pour une tache d'ablation euh 1-10 dans diamètre. Séquentiellement supprimer les filtres ND jusqu'en un endroit ablation est vu. Ajustez l'endroit d'ablation pour le centre de l'image avec le miroir ferroviaire. Vous aurez envie de rajouter une filtre ND pour avoir de place pour accroître la puissance du laser finement avec la lame demi-onde pour donner une <1 tache d'ablation um. Image à 0,2 um / pixel ou moins et ajuster finement l'endroit d'ablation au centre de l'image (position 256 256 avec 512X512 image).
- Vérifiez la profondeur de champ et l'axe du faisceau laser. Accent haut et en bas 1-2 um et vérifier la position d'ablation et la taille du spot d'ablation. Si le faisceau laser est aligné axialement l'endroit d'ablation ne bougera pas. Le faisceau laser inconditionnée va distribuer le pouvoir sur plusieurs UM (environ 3-5 um de haut en bas de la discussion).
2. Ajouter les lentilles d'élargir le faisceau laser pour remplir l'arrière objectivela convergence d'ouverture et d'ajuster pour contrôler l'accent
- Ce système utilise deux faisceaux extenseurs Galiléen à élargir le faisceau laser pour remplir l'ouverture arrière de l'objectif (10 mm). Montez les 4 lentilles sur des supports et les attacher au rail (+ L1f1 L2f2 et L3f1 '+ L4f2'). Ajustez la position de telle sorte que toutes les lentilles sont au même axe optique et exactement orthogonale au faisceau laser (fig. 2).
- Allumez le laser et l'adapter à la puissance minimum et en mode continu. Environ ajuster l'alignement du faisceau dans chaque lentille en utilisant du papier pour voir le faisceau laser et faisceau de lumière transmis à partir du condenseur du microscope. Éteignez et d'obturation au laser.
- Retirer les pinces d'un côté de la loupe et au microscope glisser hors de la trajectoire du faisceau laser. Allumez le laser et retirez l'obturateur de sécurité.
- L'alignement des lentilles fines et le faisceau laser peut être effectuée en visualisant le faisceau laser élargi sur un mur proche. Le faisceau doit dilater et se contracter symétriquement lorsque le leNSE sont déplacés. Ajuster les deux derniers miroirs montés cinématiquement pour aligner le faisceau (fig. 3).
- Le profil du faisceau aligné et élargi doit être circulaire et d'une luminosité uniforme (fig. 3). La taille et l'uniformité du faisceau peut être visualisé avec un Post-It note à la position estimée de l'ouverture arrière objectif.
- Le faisceau doit être ajusté à zéro de convergence pour les systèmes optiques infini. La convergence peut être estimé en notant comment les changements de taille du faisceau que vous déplacez un post-it loin de lentilles. Eteignez le laser et d'engager l'obturateur mécanique.
- Faites glisser le microscope de retour dans la trajectoire du faisceau laser à l'aide des pinces fixes pour définir l'alignement correct. Remplacer les pinces sur le côté libre du microscope, mais ne pas serrer le bas.
- Allumez le laser et retirez l'obturateur de sécurité. Rotation de la tourelle objective à une position ouverte. Placer un post-it sur la scène. Vous devriez voir le faisceau laser élargi et uniforme centrée sur la b lumière transmiseeam du condenseur (fig. 4). Vous pouvez avoir besoin pour le centrer en desserrant les colliers de microscope et soigneusement poussant le microscope.
- Engager l'obturateur de sécurité, et mettre le laser pour déclencher le mode. Tournez l'objectif 60X en place et l'image de la surface de rayures sur la diapositive cible.
- Retirez l'obturateur de sécurité, déclencher l'ablation laser et ajuster la puissance du laser pour la tache d'ablation minimum. Le spot d'ablation doit être circulaire et au sein de 5-10 um centre de l'image.
- Centre place d'ablation avec des réglages fins de miroir ferroviaire cinématiquement monté. Vous aurez besoin d'ajuster la manière itérative montés sur rail et d'un miroir haut du périscope à la fois centre de la tache d'ablation et de maintenir un profil de faisceau uniforme.
- Évaluer la mise au point Z du laser en déplaçant l'accent systématiquement monter et descendre dans les étapes 1 um et déclenchant l'ablation laser. Le faisceau élargi, alignés, et la convergence ajusté devrait ablation maximum au foyer image et faiblement ou pas du tout une euh abOve ou en dessous de discussion (figure 5).
- Ajustez la mise au point Z du faisceau élargi en déplaçant lentille L3 de la lunette de Galilée (fig.2).
3. Laser axotomie et time-lapse de microscopie des axones de régénération
- Micro-ondes de 10% d'agarose (RPI de biologie moléculaire grade EEO 0,1 A20090) dans une solution saline équilibrée jusqu'à complètement fondu. Situé sur une plaque chaude pour maintenir fondu durant l'utilisation pour le montage.
- Une goutte d'agarose fondu est placé sur une lame de verre et aplatie avec une autre lame de verre dans un pavé d'environ 200 um d'épaisseur (une seule couche de ruban de temps sur des lames adjacentes est utilisé comme une entretoise).
- Une casquette "Sharpie" marqueur est utilisé pour découper un bloc de diamètre uniforme circulaire de 13mm.
- Anesthésique (1UL Muscimol 20mm) et des microsphères (Chris Fang-yen, communication personnelle) (1UL 2,65% polystyrène 0,1 um dans l'eau) sont ajoutés au centre du pavé suivie par 3-5 vers orienté de sorte qu'ils sont couchés sur leurs côtés gauche . Une lamelle de verre est appliquée et ensuite Vaseline est utilisé pour sceller la lamelle et d'empêcher l'évaporation de l'échantillon (fig. 6).
- L'ablation laser est aligné à réticule, comme décrit ci-dessus, au début de chaque session. Engager l'obturateur de sécurité laser.
- Retirez la cible d'alignement au laser et l'image d'un ver adulte monté avec un marqueur fluorescent approprié dans les neurones cibles. Axones image à un grossissement similaires (0,2 um / pixel ou plus fort grossissement) et la position sous le réticule (Fig.7).
- Ouvrez l'obturateur de sécurité laser et déclencher l'ablation laser tout en imagerie. Évaluer l'axone après le déclenchement du laser et augmenter lentement la puissance du laser jusqu'à la axone est coupé. Vous aurez besoin d'environ la puissance du laser 10X davantage pour réduire les axones que de former une tache d'ablation sur la diapositive cible d'alignement (environ 1UJ / ns impulsion). Nous généralement coupé avec 100 impulsions à 2,5 kHz et de puissance fixé à environ 0.27mW (puissance moyenne mesurée à spécimen avec mesureur de puissance Coherent FieldMaxII et laser mis à continu à 2500 Hz). L'ablationréglage de la puissance laser sera compatible pour le découpage des axones dans les futures expériences (Fig.7).
- Un axone coupé avec succès montrera une pause d'environ 0,5-1 um sans perte de luminosité dans les deux extrémités coupées (Fig.7). Une perte importante de luminosité ou un grand écart (2-10 um) signifie souvent d'importants dégâts au-delà de l'axone par une bulle de cavitation. Les axones proximaux et distaux se séparent et forment des ampoules de rétraction au cours des 30 prochaines minutes (fig. 8 et film).
- Equilibrer vos vers montés avec votre platine de microscope pendant 30 minutes avant de commencer votre enregistrement laps de temps. Cela permettrait de minimiser la dérive due aux différences de température et de contraction d'agarose.
- ) Time-lapse paramètres d'imagerie sont mis en place en utilisant le logiciel d'imagerie associée à votre système. En général, nous l'image de 10 à 20 étapes Z (1um/step) à 0,1-0,2 um / pixel en utilisant le gain, sténopé, vitesse de balayage, et les paramètres d'imagerie laser de puissance qui minimisent l'exposition tout en donnant la résolution spatiale souhaitée. Intervalles d'échantillonnage sont typiquesLy 1-5 minutes de plus de 15 heures, selon la résolution souhaitée temporelle (fig. 8 et film).
- Données d'image time-lapse sont convertis en utilisant les films Elements NIS ou ImageJ.
4. Les résultats représentatifs:
Laser axotomie utilisant ce système est fiable et la routine. Les résultats présentés dans la figure 7 sont typiques. Time-lapse d'imagerie de la régénération des axones est très robuste en utilisant ce protocole. Nous faisons régulièrement coupé et de l'image jusqu'à 5 axones en 5 vers différents sur une seule lame à l'aide d'une platine motorisée. La seule limitation est le temps qu'il faut pour rassembler les images de chaque axone, par exemple, si il faut 20 secondes pour recueillir une pile pour un axone, puis tout au plus, vous pourrez déguster 9 axones (9 piles) si vous êtes d'échantillonnage toutes les 180 secondes. L'exemple montré dans les figures 8 et 9 est un résultat représentatif. Environ 10% des expérimentations donnent des résultats de cette qualité. Les expériences restants fournissent de bonnes données sur le phénotype de régénération, mais elles sont esthétiquement unappealING fait de petits mouvements de sautillement du ver qui commencent généralement après 5-8 heures d'immobilisation.

Figure 1 système d'ablation laser. Le Nd 532 nm: Yag laser est monté sur une plaque riser pour le porter à la hauteur des autres composantes et boulonné à la planche à pain. (Isolateur optique est facultative et n'est probablement pas nécessaire). Le polariseur Glan-Thompson et lame demi-onde sont utilisés pour contrôler finement la puissance du laser. Ils sont dans des montures de rotation finement calibré. Prenez soin de fixer les décharge de faisceau. Le miroir d'angle dirige le faisceau laser sur le miroir inférieure périscope. Le miroir du périscope supérieure dirige le faisceau vers le miroir ferroviaire. Le rail est monté sur deux plates-formes tige en charge. Double lentilles galiléens sont attachés aux montages sur rail coulissant. Avis ajouté le module intermédiaire dédié à l'ablation laser. Le système pourrait être rendue plus compacte en enlevant les optiques IsolaTor et le miroir d'angle, et le repositionnement du laser, Glan-Thompson polariseur et lame demi-onde au bord arrière de la planche à pain.

Figure 2 double lentilles conditionné galiléennes sont utilisés pour étendre l'UM 300 TEMoo faisceau laser d'une taille de convergence uniforme mm à zéro 10. Une prise de laboratoire est placé sous l'une des plateformes tenant la rampe. Cela aide à ajuster la hauteur du rail pendant les étapes de l'alignement. Grossièrement ajuster la hauteur du rail par le montage de la lentille L1 au rail et à l'aide du faisceau condenseur comme un guide d'alignement. Ajustez le rail de sorte que le faisceau condenseur s'aligne avec le centre de l'objectif aux deux extrémités du rail. Cela permettra d'assurer le rail est alignée parallèlement à l'axe optique du microscope. Vous devrez peut-être d'abord régler le microscope pour correspondre à l'axe optique du rail. Utiliser des brides pour fixer la position du microscope (voir fig. 1). Retirer èmee rail lentille. Maintenant aligner le faisceau laser au centre de la poutre à condensateur aux deux extrémités du rail. Un papier dans le trajet du faisceau est une manière commode de voir les deux faisceaux simultanément. Utilisez le miroir du périscope haut pour aligner le faisceau laser à la poutre à condensateur à proximité du miroir monté sur rail. Utilisez le miroir monté sur rail pour aligner le faisceau laser à la poutre du condenseur à l'extrémité du rail (plus proche de microscope). Maintenant, montez tous les quatre lentilles sur le rail comme le montre la figure. La longueur du rail, longueur focale de la lentille, et les arrangements lentilles varie en fonction de votre microscope et mis en place physiques. Les paramètres critiques sont le diamètre du faisceau laser et la taille de l'ouverture arrière de l'objectif choisi. Infinity systèmes optiques portera une parfaitement parallèles faisceau laser (zéro de convergence). Distance entre L1 et L2 doivent être la somme des lentilles focales, f1 + f2, et la distance entre L3 et L4 devrait en conséquence être f1 '+ f2'. La distance entre ee double paires Galiléen n'est pas critique. Position de L3 peut être finement ajustée pour contrôler la convergence du faisceau; <1mm ajustements seront nécessaires pour régler la focalisation du laser au foyer image. Veillez à retirer toutes les lentilles, les filtres, les ouvertures, etc à partir du module intermédiaire qui pourrait être dans le chemin du faisceau (ou être au courant de ce qu'ils font et d'ajuster votre système en conséquence).
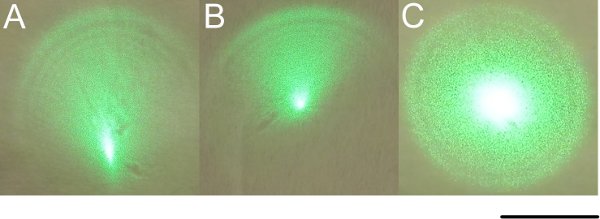
Figure 3 Alignement du faisceau laser à travers les lentilles à double galiléen. Retirer les pinces de microscope d'un côté du microscope de sorte que le microscope peut être déplacé hors de la trajectoire du faisceau, mais les pinces restantes permettront au microscope pour être précisément repositionné. Pensez à la sécurité laser. Assurez-vous que la puissance du laser est ajustée à un minimum avec le polariseur de Glan-Thompson. Allumez le laser et visualiser le faisceau laser sur le mur. Vous pouvez trouver un papier collées au mur permet d'afficher le laserspot. Ajuster systématiquement les positions des lentilles pour obtenir une sensation pour ce qu'ils font pour la taille du faisceau et l'apparence. Vous devriez voir quelque chose qui ressemble à la partie A, où une tache intense est excentré situé dans un profil de gradateur. Utilisez le miroir monté sur rail pour ajuster la tache intense au centre, comme indiqué dans la partie B. Vous pouvez maintenant utiliser le périscope monté sur le dessus miroir pour donner un profil uniforme périphériques. Si tout est aligné correctement, vous devriez maintenant trouver que le déplacement des lentilles provoque la poutre pour dilater et se contracter de façon symétrique. Déplacer les lentilles revenir à la position de départ comme le montre la figure 2. Maintenant intercepter le faisceau à la distance de l'ouverture arrière objectif. Il doit être circulaire, au moins assez grand pour remplir votre ouverture arrière, et d'une luminosité uniforme. C'est OK si elle est plus grande, aussi longtemps que vous avez suffisamment de puissance laser pour vos ablations. Évaluer la convergence en comparant diamètre du faisceau à la distance de l'ouverture de l'objectif de retour et le mur. Diamètre du faisceau doitêtre identiques pour un faisceau de convergence nul. La barre d'échelle est de 10mm.

Figure 4 Alignement du faisceau laser élargi à la poutre condenseur. Obturateur le laser et déplacer le microscope de nouveau dans le chemin du faisceau laser à l'aide des pinces que s'arrête l'alignement. Allumez, aligner et focaliser le faisceau condenseur en utilisant une lentille d'objectif. Ruban de papier sur les oculaires pour empêcher quiconque de visualiser la lumière laser intense réfléchie. Rotation de la tourelle objective à une position ouverte. Mettez un morceau de papier sur la scène pour occlure le faisceau condenseur. Tourner le laser à mode continu et retirez l'obturateur de sécurité mécanique. Vous devriez voir un peu de lumière laser provenant si le microscope. Desserrez les colliers de microscope et doucement pousser le microscope afin d'aligner le faisceau laser avec le faisceau condenseur. Le faisceau laser doit être circulaire et d'une luminosité uniforme. Il est parfois utile de Adjuer le rail lentilles. Vous devriez être capable d'élargir et de contrat, le faisceau laser de façon uniforme si l'alignement est correct. Vous pouvez centrer le faisceau laser contractée à la poutre centrée condenseur minimum avec le miroir monté sur rail et ensuite l'étendre à la taille désirée. Une fois que vous réglez la position du faisceau contrat avec le miroir du rail, vous aurez besoin de réajuster le miroir du périscope monté sur le dessus pour maintenir une luminosité uniforme du faisceau élargi. Si vous ne pouvez pas obtenir un faisceau laser circulaire centrée alors vous aurez besoin de revenir à travers les étapes d'alignement plus tôt.

Figure 5 Centre place d'ablation et d'ajuster la convergence du faisceau laser pour la mise au point optimale. Éteignez et d'obturation au laser. Retirez le papier et monter la diapositive cible miroir (vous pouvez aussi utiliser de l'encre de marqueur permanent sur une lamelle comme une cible 2). Rayures sur la surface de l'image en miroir avec les 60Lentille de l'huile 1.4na X) Maintenant l'image de la surface avec un confocale ou CCD. Ne pas regarder dans les oculaires alors que le laser est activé. Allumez-le et unshutter le laser. Réglez le laser pour déclencher le mode, la plus faible consommation, et de 100 Hz. Trigger environ 10 impulsions. Vous devriez voir une tache d'ablation de 1-5 um de diamètre intérieur 10 um du centre de vue. Si vous ne voyez pas une tache d'ablation, vous pouvez augmenter la puissance du laser dans les étapes de 5-10%. Une fois que vous identifiez un endroit d'ablation, le centrer dans le champ de vue. Mettez le réticule à 256, 256 coordonnées, si le visionnement d'image 512X512. Si vous réglez le spot laser au centre, puis il ne changera pas de position avec le zoom. Utilisez le miroir monté sur rail pour déplacer le spot d'ablation de la ligne de mire du centre. Réévaluer l'uniformité du faisceau laser en regardant le faisceau avec l'objectif enlevé comme décrit plus haut dans la figure 4. Ajustez l'uniformité du faisceau avec le miroir monté périscope haut. Répétez l'évaluation de la position au comptant d'ablation. Ceci est un processus itératif processus qui doivent être répétées jusqu'à ce que la tache d'ablation est centré et le faisceau élargi est uniforme. Si fait correctement l'endroit d'ablation sera circulaire comme on le voit dans le spot d'ablation à Focus sur la figure. Suivant évaluer la focalisation du faisceau laser dans l'axe Z. Déclencher le laser pour produire un spot d'ablation d'environ 1 um dans le centre. Maintenant, déplacez la glissière d'environ 5 um latéralement et se concentrer une UM-dessous de la surface de la lame cible. Déclencher le laser à l'aide des paramètres laser que vous avez utilisé pour la tache d'ablation d'abord. Répétez après focalisation 1 um-dessus de la surface de la lame cible. Si le faisceau laser est focalisé au foyer image, alors vous devriez voir un modèle similaire à celui montré dans cette figure. Le spot le plus grand d'ablation doit correspondre à la netteté de l'image et les taches d'ablation dessus et en dessous accent devrait obtenir de plus petits de façon symétrique. Ajustez lentille L3 pour aligner plans focaux. Déplacement lentille L3 loin du microscope rendre le faisceau plus convergente et l'endroit d'ablation se rapprochera del'objectif. Petit <1mm ajustements seront nécessaires à proximité de discussion. Vous êtes maintenant prêt à couper les axones. La barre d'échelle est de 1 um.

Figure 6 ver de montage pour axotomie laser et imagerie time-lapse. Agarose 10% dans une solution saline est chauffé jusqu'à complètement fondu. Une petite goutte est placée sur une lame de microscope en verre puis aplati avec une autre lame pour former un coussin plat. L'épaisseur de la plaquette est fixé par un ruban sur deux diapositives adjacentes. Le pad est autorisé à mettre pendant environ 1 minute puis les lames sont séparées. Un "Sharpie" top est utilisé comme un emporte-pièce pour former un bloc homogène de taille d'environ 13mm. 1 ul de 10 mM et 1 ul muscimol de microsphères sont ajoutés au centre du pad (Fang-yen communication personnelle). Les vers sont ajoutés à la baisse de 2 ul et orienté avant de mettre sur la lamelle de verre. La vaseline est ensuite appliquée à partir d'une seringue (20-25 ga. Aiguille) au bord de la lamelle pour le sceller.

Figure 7 Les résultats typiques de laser axotomie chez C. elegans. En A, vous pouvez voir l'axone intacte peu avant et après laser axotomie. L'écart est normalement d'environ 0,5 1um. B shows laser axotomie d'un axone sans endommager un axone à proximité d'environ 1 um loin. Laser a été fixé à environ 10% de puissance (0,3 mW en moyenne à 2500 Hz), et 100 pulsations. La barre d'échelle est de 5 um.

Figure 8. Typiques de type sauvage L4 régénération. Ceci est une série chronologique montrant l'ablation et time-lapse enregistrement de la régénération des axones. Peu de temps après au laser axotomie à 0 minutes, vous pouvez voir l'ampoule rétractation. En 138 minutes de l'ampoule de rétraction s'est retirée à son extrême étendue et maintenant commencé à remodeler. Protubérances membranaires sporadiques (mircospikes ou filopodes) peuvent être vus le long de l'arbre axone (flèches 138 et 324). L'tronc droit s'étend un cône bien formé croissance compacte à 360 minutes. A 414 minutes à la fois des souches ont étendu les cônes de croissance. Les cônes initiaux croissance embryonnaire-like deviennent dystrophiques comme ils s'étendent vers la corde nerveuse dorsale (414, 519 et 597 minutes). La croissance dystrophiques décrochage cônes courte de la moelle épinière dorsale (960 minutes). Pointes de flèches soulignent moignon proximal et les cônes de croissance. Les flèches indiquent les protubérances membranaires long de l'arbre axone proximal. 20um barre d'échelle.
Vidéo 1. Film de la régénération des axones de type sauvage. Ce film va de pair avec les points de temps indiqué dans la figure 8. Worms ont été montés comme décrit dans le protocole et les axones ont été imagées toutes les trois minutes pendant environ 10 heures. Z stacks (20 X 1um) ont été prélevés à chaque point du temps et a fusionné en images par un algorithme simple projection maximale (Éléments NEI). Cliquez ici pour regarder le film.
Discussion
Il ya plusieurs bonnes discussions sur la microchirurgie au laser avec des systèmes de laser différentes 3,5-11. Femtoseconde lasers IR sont le «gold standard» pour l'ablation laser subcellulaire 12 et commode si associé à une installation d'imagerie, mais ils sont souvent trop coûteux pour les utilisateurs individuels. Si vous avez besoin d'un laser femtoseconde pour l'imagerie infrarouge de votre échantillon en raison de la profondeur de l'imagerie, alors vous aurez probablement besoin d'une pour le laser axotomie. Tissus transparent avec les axones cible au sein de 30 à 50 um de la surface sont probablement faisable avec les lasers à impulsions bleu et vert dans les 20 UJ / impulsion fourchette cible à travers une lentille d'immersion na élevé. Il n'y aura plus de dommages collatéraux avec le nano et pico seconde lasers rapport avec le laser femtoseconde, d'autant que la profondeur de l'axone augmente cible. C. elegans est transparent et tous les axones sont à 20-30 um de la surface. Nous faisons régulièrement coupé axones moteurs qui sont dans les 5 um de la surface. Nous avons aussi facilement couper hacheons dans l'anneau nerveux qui sont environ 20 um de la surface de la cuticule. Nous avons trouvé la limite pour la coupe des axones à environ 30-50 um par le diamètre d'un ver adulte. Il est probable que le système d'ablation laser décrit ici serait bien travailler avec de nombreuses préparations différentes qui répondent aux critères de transparence et de la profondeur des axones cible. Pourtant, il est un peu surprenant, étant donné les avantages théoriques des lasers femtoseconde IR, que 355 nano et picoseconde nm et 532 nm lasers exécuter si bien pour le laser axotomie en C. elegans 6,13. Nous ne voyons aucune différence dans la régénération des axones en réponse au laser nanoseconde avec axotomie 440 nm, 532 nm nanoseconde, et des lasers femtosecondes infrarouge.
Solid state lasers UV 355 nm sont environ le même coût que la diode 532 nm pompé passivement Q-Switched laser à état solide, mais nécessitent des puissances supérieures ou optique qui passent efficacement ces longueurs d'onde plus courtes. La plupart des optiques sont conçus pour bien performer avec 400 visibles -700 nm de lumière. 355 nm lasers offrirait certains avantages tels que six seuil de réduction du plasma, la taille plus petite place, et une longue passe dichroïque serait efficace à 100% directes de l'ablation par laser à la cible et permettre l'imagerie simultanée de la GFP sans perte de signal de l'échantillon. Les lasers bleus nm 440 conserverait les avantages de travailler avec un laser de lumière visible (de bonnes performances avec des optiques standard et de sécurité). Malheureusement, le coût d'un DPP Q-switched laser à état solide 440 nm est de 3 fois le coût d'un laser 355nm ou 532 nm de puissance similaire à ce moment. Si nous devions concevoir un nouveau système pour C. elegans, où la profondeur des cibles est minime, nous opterions pour une lentille transparente aux UV (coût environ $ 3.000 pour une lentille d'huile 1.3na 40x avec 50-70% de transmittance à 355nm) et un laser 355 nm produisant 50 à 10 UJ / impulsion à 1 -20 kHz.
L'ablation Axon est pensé pour être dû à la formation du plasma. Impulsions plus courtes produira seuils plasma à faible puissance et les volumes de plasma w malades seront plus petits 6. L'objectif est de produire le plasma et petit plus éphémère en ajustant l'énergie d'impulsion à la plus faible puissance. Agrandir les plasmas de longue durée va générer des bulles de cavitation que les dommages entourant les cellules. Nous avons généralement constaté que l'ablation en utilisant environ 50-100 impulsions à la fréquence la plus élevée (c.-à 2.5kHz) donne les meilleurs résultats. Cela suggère que les dommages peuvent être progressivement intégrée sur une série d'impulsions afin de mieux contrôler l'étendue des dégâts. Le système d'ablation laser décrite ici est très indulgent si le faisceau est aligné et élargi avec précision. Nous commençons la coupe des axones vers adultes à la puissance du laser à 10% (moyenne de 0,3 mW mesuré à 2500 Hz et environ 1 UJ / impulsion) et peut couper avec des dommages localisés limitée par la puissance de 14%. Vous pouvez observer plus grandes zones de dégâts de 15 à 39% la puissance du laser, mais seulement au-dessus 40% de puissance (environ 1 mW en moyenne mesurée à 2500 Hz) ne les vers exploser à cause de grandes bulles de cavitation et de dommages à la cuticule du ver.
e_content "> Le Steinmeyer et al. 2010 2 papier est une excellente ressource pour construire un système d'ablation laser. Leon Avery a aussi une belle description pratique d'un système d'ablation laser basé sur un laser à gaz N2 nm coûteux 337 et il fournit certaines pratiques très conseils (elegans.swmed.edu / Worm_labs / Avery /). Lorsque vous concevez votre propre système, vous devriez d'abord parler avec votre représentant microscope afin de déterminer comment cibler le laser d'ablation à l'objectif du microscope. Votre microscope doit être monté sur une table anti-vibrations (Newport, TMI, Thor). Un haut breadboard est optimal, mais un top en acier massif peut toujours être utilisé avec positionneurs magnétiques. Un module dédié intermédiaires sur une portée verticale est agréable car tous les éléments optiques peut être laissé en place. Cependant, il peut être moins coûteux et plus commode d'utiliser un port de la caméra (inversé) ou un «combinateur» attaché à un port epi-fluorescence. Vous avez besoin de connaître la taille de l'ouverture arrière et la transmission (à l'une blation longueur d'onde laser) de l'objectif que vous comptez utiliser. Une fois que vous décidez sur un laser (par exemple, Crylas, TEEM, Cristal, ou CRC), vous devez contacter Thor ou de Newport pour aider à sélectionner les bons éléments d'optique, matériel informatique et de sécurité. Nous avons décidé d'un élargisseur de faisceau Galiléen double pour économiser l'espace, mais une simple extension de Kepler est une option (F2/F1 = facteur d'expansion). Un expanseur de faisceau personnalisé sera le moins cher, mais à Newport, Thor, et plusieurs des fabricants de lasers offrent une excellente qualité commerciale du faisceau extenseurs. Certains fabricants de lasers offrent également atténuateurs manuelle et à commande électronique qui peut être rentable et peu encombrant, mais pas aussi polyvalent que le polariseur de Glan-Thompson et la plaque demi-onde. Vous aurez également besoin de décider la façon de contrôler le laser. Vous pouvez concevoir un contrôleur de LabView, utilisez un générateur commerciaux TTL, ou les logiciels fournis par l'entreprise au laser. Discutez des options avec le fabricant de laser spécifique. tente »> Nous avons fourni une liste du matériel que nous avons utilisé seulement comme un guide général. Le système décrit ici a coûté environ $ 15 000 lorsqu'elle est ajoutée à notre système d'imagerie existants. Votre département Physique locales auront souvent quelqu'un qui est prêt à fournir une introduction pratique à en toute sécurité travaillant avec des lasers faisceau libre.Méthodes alternatives pour l'immobilisation et laps de temps d'imagerie de C. elegans ont été récemment décrites. 14
Dépannage
L'étape la plus difficile et critique l'alignement du faisceau centré étendu à l'axe optique du microscope. Une fois que vous avez le faisceau centré et étendu à travers les lentilles de Galilée, vous devez travailler dur pour obtenir ce aligné à moins de 5 um de l'axe optique du microscope avant d'utiliser les miroirs de pilotage de l'alignement final pour le centre. L'utilisation excessive des miroirs de direction pour aligner le faisceau du microscope va l'amener hors axe passant par le faisceauexpandeur. utilisant PRUDENCE EXTRÊME vous pouvez atténuer le faisceau laser avec le filtre ND approprié et visualiser directement le profil du faisceau laser sur une cible réfléchissante (miroir surface frontale). Vous pouvez doucement pousser le microscope avec précision le centre du faisceau dans le champ de l'objectif 60X de vue (si elle ne peut pas être centré dans le haut / bas gamme dont vous avez besoin d'ajuster la hauteur du rail). Le profil du faisceau peut être utilisé pour aligner avec précision l'axe microscope optique pour donner un faisceau centré qu'il est circulaire et «fusées» de façon symétrique. Une éruption asymétrique est une indication que l'axe microscope n'est pas parfaitement aligné (ou le rail n'est pas de niveau). Enfin, vous devriez ajuster L3 et voir une expansion régulière et symétrique et la contraction de la poutre. Focus du microscope, précisément sur la surface cible et ensuite ajuster L3 à focaliser le faisceau laser pour la plus petite tache. Vous devriez maintenant constater que le faisceau laser est à 5 um du centre où imagé via LSCM ou CCD système et l'endroit d'ablation est dans1um de concentration Z.
Si vous trouvez que vous "sauter" vers ou constamment générer de grandes bulles de cavitation à couper axones votre problème est plus probable l'alignement amende de l'ablation laser. Assurez-vous que le minimum (<500nm) tache d'ablation est localisée à la mise au point Z (ajuster la convergence avec lentille L3) et à l'endroit XY fiduciaires (ajuster avec miroir cinématiquement montés dernière).
Cibler les axones près de la surface, il faudra moins de puissance de laser. De même, les petits animaux (L1 et L2), il faudra moins de puissance laser pour axotomie rapport à cibler les axones même chez les adultes.
Si votre axones de type sauvage ne se régénèrent pas ou l'eau de Javel axones vous devriez essayer de réduire la puissance d'imagerie laser ou en diminuant le taux d'échantillonnage. Si vos vers meurent ou deviennent maladives essayez de réduire le Agarose pour cent dans les étapes 1%. Assurez-vous que vous ne bougez pas la lamelle, après les vers de montage comme ce sera souvent provoquent leur mort lors de l'utilisation élevée parpourcentage d'agarose et des microsphères.
Si vos vers éclater ou meurent lors d'une session time-lapse, il est dû à: 1. Pourcentage d'agarose est trop élevé. 2. Dommages aux cuticules par ablation laser. 3. Mouvement de la lamelle après le montage. Si des dommages à la cuticule est en faute qu'elle affectera seulement les vers montés qui ont été ciblés avec le laser d'ablation.
Si votre ver se déplace trop pendant une session time-lapse essayez d'augmenter le pourcentage d'agarose dans les étapes de 0,5%. Axones sains dans les vers sains sont toujours «actif» et d'afficher un niveau homogène de la fluorescence. Si vous voyez une diminution soudaine de la fluorescence ou de l'activité du ver est mourant ou mort. Plusieurs axones perlées ou fragmentées sont un signe certain d'un ver mourant ou mort.
Si vous avez du mal à garder votre axones se concentrer lors de la session laps de temps ensemble il peut y avoir plusieurs problèmes différents. Premièrement, vérifiez votre dérive scène par l'imagerie d'un échantillon inerte sur une lame de verre de plus de 10 hrs. Une dérive quelques microns peuvent être dus à l'instabilité thermique, mais supérieure à 5 um est probablement dû à des problèmes mécaniques avec votre microscope. Problèmes avec le montage sont plus communs. Laissez vos vers montés s'équilibrer avec votre platine de microscope pendant 30 minutes avant de commencer votre laps de temps. Vérifiez que votre sceau vaseline n'ont pas développé de fuites au cours de votre session laps de temps.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Cette recherche a été soutenue par la National Science Foundation, le Fonds de dotation McKnight for Neuroscience, le Christopher et Dana Reeve Foundation et Amerisure Charitable Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| 535 nm laser | Crylas | FDSS532Q3 | (TEEM, Crystal, et CRC offrent également des lasers comparables) |
| Toutes les optiques et le matériel | (Thor offre optiques comparables et matériel) | ||
| SUPREMA optique Mount, 1,0 de diamètre | Newport | SS100-F2KN | 2 |
| Une «post diamètre, 1" de hauteur | Newport | PS-1 | 1 |
| Une «fourche de diamètre après | Newport | PS-F | 1 |
| Achromatique d'ordre zéro Plate Wavel, Retardation vague ½, 400-700nm | Newport | 10RP52-1 | 1 |
| Stade de rotation, une "Aperature | Newport | RSP-1T | 1 |
| Une «post diamètre, 1" de hauteur | Newport | PS-1 | 1 |
| Une «fourche de diamètre après | Newport | PS-F | 1 |
| Glan-Laser Polarisant calcite, 430-700nm | Newport | 10GL08AR.14 | 1 |
| Rotation Polarisant mont | Newport | RM25A | 1 |
| ¼ "entretoise pour une« post diamètre | Newport | PS-0.25 | 1 |
| ½ "de hauteur, une« après Diamètre | Newport | PS-0.5 | 1 |
| Fork, 1 message "de diamètre | Newport | PS-F | 1 |
| Décharge de faisceau | Newport | PL15 | 1 |
| Microscope Objectif Monture | Newport | LH-OBJ1 | 1 |
| Une «post diamètre, 1" de hauteur | Newport | PS-1 | 1 |
| Une «fourche de diamètre après | Newport | PS-F | 1 |
| High-Energy Laser Nd: YAG miroir, 25,4 mm de diamètre, 45 °, 532 nm | Newport | 10Q20HE.2 | 4 |
| SUPREMA optique Mount, 1,0 pouces de diamètre, trou de passage de montage | Newport | SN100C-F | 2 |
| Haute précision de réglage à vis Bouton, voyages 12.7mm, 100TPI | Newport | AJS100-0.5K | 4 |
| Adaptateur fileté, ¼ -20 masculins, 8-32 femelles | Newport | SS-1-B | 2 |
| Rod Clamp pour 1,5 cm de diamètre tige | Newport | 340-RC | 2 |
| Rod, 14 pouces (35,5 cm) | Newport | 40 | 1 |
| Transporteur ferroviaire pour le X26, carré longueur 40mm | Newport | CN26-40 | 4 |
| Steel Rail, 384mm (15 ") de longueur | Newport | X26-384 | 1 |
| Plate-forme de tige pour tige 1,5 cm de diamètre | Newport | 300-P | 2 |
| Rod, 14 pouces (35,5 cm) | Newport | 40 | 2 |
| Plano-lentille concave, diamètre 12,7 mm, 25mm-EFL, 430-700nm | Newport | KPC025AR.14 | 2 |
| Lentille plan-convexe, diamètre 25,4 mm, 50.2mm EFL, 430-700nm | Newport | KPX082AR.14 | 1 |
| Lentille plan-convexe, diamètre 25,4 mm, 62.9mm EFL, 430-700nm | Newport | KPX085AR.14 | 1 |
| Monture fixe, 0,5 "de diamètre, 1,0" Hauteur d'axe | Newport | LH-0.5 | 2 |
| Monture fixe, 1,0 "de diamètre, 1,0" Hauteur d'axe | Newport | LH-1 | 2 |
| Microsphères 0.1um | Polysciences | 00876 | |
| Agarose | RPI | A20090 | Questions EEO |
| Muscimol | Sigma | M1523 |
Références
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature protocols. 5, 395-407 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branching. Proc Natl Acad. 104, 15132-15137 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nature protocols. 5, 1888-1902 (2010).
- Raabe, I., Vogel, S. K., Peychl, J., Tolic-Norrelykke, I. M. Intracellular nanosurgery and cell enucleation using a picosecond laser. J. Microsc. 234, 1-8 (2009).
- Hutson, M. S., Ma, X. Plasma and cavitation dynamics during pulsed laser microsurgery in vivo. Physical review letters. 99, 158104-158104 (2007).
- Venugopalan, V., Guerra, A., Nahen, K., Vogel, A. Role of laser-induced plasma formation in pulsed cellular microsurgery and micromanipulation. Physical review letters. 88, 078103-078103 (2002).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in C. elegans. Opt Express. 16, 5963-5963 (2008).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J. Vis. Exp. (24), e1129-e1129 (2009).
- Tsai, P. S. Plasma-mediated ablation: an optical tool for submicrometer surgery on neuronal and vascular systems. Curr. Opin. Biotechnol. 20, 90-99 (2009).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neurosci. 7, 30-30 (2006).
- Shen, N. Ablation of cytoskeletal filaments and mitochondria in live cells using a femtosecond laser nanoscissor. Mech. Chem. Biosyst. 2, 17-25 (2005).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Opt. Express. 16, 9884-9894 (2008).
- Rohde, C. B., Yanik, M. F. Subcellular in vivo time-lapse imaging and optical manipulation of Caenorhabditis elegans in standard multiwell plates. Nat. Commun. 2, 271-271 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon