Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détection multiplex de bactéries dans les échantillons complexes cliniques et environnementaux à l'aide d'oligonucléotides couplés microsphères fluorescentes
Dans cet article
Résumé
Nous décrivons une méthode multiplex pour la détection des microorganismes dans un échantillon à l'aide d'oligonucléotides couplés billes fluorescentes. Amplicon de tous les organismes au sein d'un échantillon est hybridé à un panel de sondes couplées perles. Un instrument Luminex ou Bio-Plex est utilisé pour interroger chaque perle pour le type de perle et le signal d'hybridation.
Résumé
La vaginose bactérienne (VB) est un syndrome récurrent polymicrobiennes qui se caractérise par un changement dans la «normale» microbiote de Lactobacillus dominé à un microbiote dominé par un certain nombre d'espèces bactériennes, dont Gardnerella vaginalis, Atopobium vaginae, et d'autres 1-3. Cette condition est associée à une série de résultats négatifs sur la santé, y compris l'acquisition du VIH 4, et il peut être difficile à gérer sur le plan clinique 5. Par ailleurs, le diagnostic de BV s'est appuyée sur l'utilisation de la coloration de Gram des frottis frottis vaginal qui sont notés sur différents critères numériques 6,7. Bien que ce diagnostic est simple, peu coûteux et bien adapté aux ressources limitées, il peut souffrir de problèmes liés à des interprétations subjectives et il ne donne pas un profil détaillé de la composition du microbiote vaginale 8. Les récents efforts de séquençage en profondeur ont révélé une riche flore vaginale avec diversesdes différences claires entre les échantillons prélevés sur des individus qui sont diagnostiqués avec le BV par rapport à ceux des individus qui sont considérés comme normaux 9,10, ce qui a abouti à l'identification d'un certain nombre de cibles potentielles pour le diagnostic moléculaire de 11,12 BV. Ces études ont fourni une mine d'informations utiles, mais séquençage en profondeur n'est pas encore pratique en tant que méthode de diagnostic dans un contexte clinique. Nous avons récemment décrit une méthode de profilage rapide de la microflore vaginale dans un format multiplex à l'aide d'oligonucléotides couplés avec des billes fluorescentes de détection sur une plate-forme Luminex 13. Cette méthode, comme la coloration de Gram actuelle basée sur les méthodes, est rapide et simple, mais ajoute en outre l'avantage d'exploiter les connaissances moléculaires résultant de séquençage des études en design de la sonde. Cette méthode offre donc un moyen de profil de la micro-organismes importants qui sont présents dans un prélèvement vaginal qui peut être utilisé pour diagnostiquer BV avec une haute spécificité et la sensibilité de compARED à la coloration de Gram tout en fournissant des informations supplémentaires sur la présence et l'abondance d'une façon semi-quantitative et rapide. Cette méthode multiplex est extensible bien au-delà de la gamme des dosages PCR quantitative pour des organismes particuliers, qui est actuellement limitée à 5 ou 6 essais différents dans un seul échantillon 14. Surtout, la méthode n'est pas limité à la détection de bactéries dans des prélèvements vaginaux et peut facilement être adapté rapidement le profil de presque toutes les communautés microbiennes d'intérêt. Par exemple, nous avons récemment commencé à appliquer cette méthodologie à l'élaboration d'outils de diagnostic pour utilisation dans les usines de traitement des eaux usées.
Protocole
Cette méthode a été utilisée dans la recherche présentée dans Dumonceaux et al. J. Clin. . Microbiol 47, 4067-4077, doi: 10.1128/jcm.00112-09 (2009).
Un diagramme schématique illustrant la procédure générale est présentée dans la figure 1.
1. Perle de couplage
Cette section décrit les méthodes qui seront utilisées pour le couplage des sondes oligonucléotidiques de billes de polystyrène Luminex (voir tableau 2). Les volumes sont légèrement adaptées pour l'évaluation des nouvelles sondes de capture sur une base expérimentale, ces volumes sont indiqués entre parenthèses.
- Retirer 1-Ethyl-3-(3-dimethylamiopropyl) carbodiimide HCl (EDC) de poudre de -20 ° C et il dessicateur à température ambiante.
- Resuspendre les microsphères par sonciation dans un sonicateur bain-marie pendant 20 secondes, puis vortex 20 secondes environ.
- Transfert 400 pi (100 pi) de microsphères dans un tube Eppendorf (ce qui correspond à 5x10 6 ou 1,25 x10 6 microsphères). Luminex suggère l'utilisation de tubes de faible teneur en protéines microcentrifugeuse contraignant (par exemple des tubes Eppendorf LoBind protéines, numéro de catalogue 0030 108.094) pour empêcher les billes de découplés de coller aux tubes et interférer avec la récupération de billes. Nous n'avons pas trouvé que cela soit un problème en utilisant la norme microtubes polypropylène, qui nous utilisent habituellement (par exemple numéro de catalogue VWR 87003-298).
- Pellet à 14000 xg pendant 1 minute. Retirer et jeter le surnageant.
- Resuspendre les microsphères dans 50 pi (12,5 pi) de la température ambiante 0,1 M 2 - (N-morpholino) éthanesulfonique (MES) à pH 4,5.
- Préparer une nouvelle solution d'EDC à 10 mg / ml dans l'eau.
- Préparer moins de 1 ml de cette solution en pesant 5-10 mg d'EDC à l'échelle d'analyse, puis en ajoutant de l'eau à 10 mg / ml.
- Ajouter 1 nmol de 5'-amino oligonucléotide de capture C12-modifié (tableau 2) pour les microsphères et les mélanger au vortex. 1 nmol est de 5 l de 200 uM oligonucléotides.
- Ajouter 2,5 l de solution fraîche d'EDC à l'microsphères et mélanger au vortex pendant 5 secondes.
- Incuber à température ambiante pendant 30 minutes dans l'obscurité.
- Jeter la solution d'EDC (étape 1.6) et de préparer un nouvel échantillon de 10 mg / ml d'EDC dans l'eau comme ci-dessus (étape 1.6).
- Ajouter un autre ul 2.5 d'EDC solution fraîche aux microsphères et de vortex pendant 5 secondes.
- Incuber à température ambiante pendant 30 minutes dans l'obscurité.
- Laver les billes en ajoutant 1 ml de 0,02% de Tween 20. Vortex (facultativement soniquer pendant 20 secondes ainsi) pour remettre les perles.
- Centrifugeuse 14000 xg 1 minute. Retirer et jeter le surnageant.
- Laver les billes à nouveau en ajoutant 1 ml de sulfate de sodium dodécyl 0,1% (SDS). Vortex (facultativement soniquer pendant 20 secondes ainsi) pour remettre les perles.
- Centrifugeuse 14000 xg 1 minute. Retirer et jeter le surnageant.
- Resuspendre les perles dans 100 ul (25 pi) de Tris-EDTA (TE) buffer [10 mM de Tris-Cl pH 8,0, EDTA 1 mM, pH 8,0].
- Énumérer les perles dans un hémocytomètre ou compteur Coulter pour déterminer la concentration d'actions.
- Préparer un Master Mix microsphère en diluant chaque bourrelet à une concentration finale de 100 billes / ul dans du tampon TE. Piscine couplé perles correspondant aux complexes désiré de l'essai (par exemple pour un dosage de 10-plex, mélanger 10 différentes billes couplées à une concentration finale de 100/μl de chaque bourrelet).
- Stocker le Master Mix microsphère à 4 ° C dans l'obscurité. Le mélange peut être stockée pendant des mois s'il est conservé dans ces conditions.
2. Chaperonine 60 universelle cible (cpn60 UT) la production d'amplicons et la génération de brins simples.
- Générer la réaction en chaîne polymérase (PCR) de produit pour chaque échantillon. Inclure les phosphorothioate et amorces biotine modifiés 5 '(tableau 1). Voir le tableau 3 pour les volumes à mélanger et à la concentration.
- Immédiatement après la PCR est terminée, ajouter 2 pl (20 unités) de T7 exonuclease à chaque tube de PCR (le tampon de PCR suffira pour que la réaction T7). Incuber la réaction à température ambiante (~ 22-25 ° C) pendant 40 minutes.
- A la fin de cette incubation, ajouter 12,5 ul de 0,5 M d'éthylène diamine tétraacétique (EDTA) pH 8,0 et mélanger. Cela donne un total de ~ 64.5μl d'un seul brin de produits PCR.
3. Hybridation d'un seul brin de produits PCR pour des billes de polystyrène oligonucléotides couplés.
- Préchauffer l'instrument à 60 ° C pour maintenir la température d'hybridation pendant l'analyse. Allumez le chauffe-plateforme utilisant le logiciel de l'instrument et être sûr d'utiliser le bloc de chauffage en cuivre qui s'adapte à la plaque PCR de style qui contient le mélange de perles hybridées.
- Resuspendre microsphère Mix Master (étape 1.20) avec une pipette, verser un montant approprié dans un tube Eppendorf, capuchon du tube, et soniquer dans un sonicateur bain-marie pendant 2 minutes. Sinon, pour assurer la cohérence absolue dans billes resuspension, le master mix microsphères peuvent être remises en suspension par vortex et de pipetage, puis sonication comme ci-dessus, puis distribuer la quantité désirée dans un tube en polypropylène Eppendorf.
- Distribuer 17 l de simple brin produit de PCR (étape 2.2) dans les puits appropriés d'un profil bas de 96 puits thermométrique PCR plaque (tableau 2). Ajouter 33 ul d'extrait, mélange billes sonciated à chaque puits. Couvrir avec couvercle en silicone (tableau 2) et appuyez doucement.
- Mettez la plaque dans le thermocycleur avec un programme d': 95 ° C pendant 5 min, 60 ° C pendant 10 min, 60 ° C détiennent, 60 ° C pendant 5 min, à la fin. Démarrez le programme.
- Faire frais streptavidine-phycoérythrine (SA-PE) solution; vous aurez besoin de 25 pi par puits (faire plusieurs puits en sus). Faire SA-PE solution en diluant stock de SA-PE (1 mg / ml) de 1:50 à 20 pg / ml avec 1x chlorure de tétraméthylammonium (TMAC) tampon (3 M TMAC; 0,1% Sarkosyl; 50 mM Tris-HCl, pH 8,0 ; 4 mM EDTA, pH 8,0).
- Lorsque le thermocycleur arrive à la 60 ° étape maintenez C,ouvrir le couvercle, retirez le couvercle en silicone et d'ajouter SA-PE solution directement dans chaque puits (NE PAS prendre la plaque de la thermocycleur). Replacez le couvercle en silicone, fermez le couvercle thermocycleur et reprendre le programme.
- Lorsque le programme est terminé, prenez la plaque et rapidement à le transférer à la machine Bioplex à lire. Plaque doit être lu en 10 minutes. Lisez à 60 ° C; s'assurer que les Bioplex a été préchauffée à cette température. Soyez certain que la hauteur de la sonde a été ajusté pour tenir compte de la plaque utilisée, comme décrit dans le manuel de l'utilisateur pour l'instrument utilisé.
- Pour précision de perles et de détection de signal, les paramètres de grille sur la Bioplex doit être réglé en fonction du type de microsphères utilisées. Billes de polystyrène BioRad nécessitent un réglage porte de 4,335-10,000 tout microsphères magnétiques nécessitent un réglage du 5,000-25,000. Il ya aussi la possibilité d'exécuter la plaque en utilisant le réglage de PMT haute qui augmente la valeur du gain journaliste. Ce que je peuxUGMENTATION l'intensité de la baisse des signaux mais il est important notamment un contrôle approprié négatif comme un signal de fond sera également augmenté.
4. Les résultats représentatifs:
Un de nos objectifs dans le développement et l'exécution du présent essai a été de le rendre aussi simple et rationnel que possible. Nous avons donc optimisé la critique post-amplification des mesures, y compris le temps du traitement T7 exonucléase et le temps d'hybridation afin de développer un test qui peut être complété dans un délai raisonnable. Comme le montre la figure 2A, le traitement T7 de l'amplicon est essentiel pour la génération de signaux, comme la plupart des sondes avaient peu ou pas de signal avec le traitement T7 courte ou pas. Le signal augmenté linéairement jusqu'à 40 minutes environ, au moment où l'augmentation du signal ralenti. Aucune dégradation du signal a été observé, même à 2 heures de temps de traitement T7, ce qui indique que la modification phosphorothioate des amorces est très efficace pour prévenir targela dégradation brin t comme décrit 15. Nous avons choisi 40 minutes pour le temps de traitement T7 à minimiser le temps de protocole global, mais il est clair à partir figure 2A que le traitement T7 peut durer beaucoup plus longtemps. Nous avons également déterminé l'effet du temps d'hybridation sur la génération du signal (figure 2B) et constaté que 10 minutes était suffisant pour le signal maximum, car aucune nouvelle augmentation du signal a été observée même après 4 heures d'hybridation. Par conséquent, une étape d'hybridation 10 minutes a été choisi, encore une fois de minimiser le temps de dosage global. Avec ces résultats à l'esprit, et avec des techniques d'extraction rapide de l'ADN tels que InstaGene (Bio-Rad), le dosage global, y compris l'extraction d'ADN, la PCR et l'analyse Luminex peut être complété en 4-5 heures.
Sur une note d'avertissement, le niveau d'agrégation des billes de polystyrène pendant une course Luminex ou Bioplex peut avoir un impact majeur sur l'efficacité du dosage. Le logiciel Bioplex affichera le niveau de perles d'agrégation, qui survient lorsqueplus d'un cordon est détectée dans le chemin laser et entraîne l'exclusion du signal d'hybridation de l'agrégat. Apparente d'agrégation de billes peut aussi être causée par toute particule qui n'est pas la bonne taille pour une seule perle, et peut même être provoquée par des bulles d'air. Dans un de ces événements, le signal de l'agrégat perles, bulles d'air, ou de particules est éliminée. Dans la plupart des cas, nous constatons que l'agrégation billes est minime (figure 3A) et le niveau cible de 100 événements comptant pour chaque perle est facilement réalisable. Parfois, cependant, les perles présentent une modérée (figure 3B) ou sévère (figure 3C) niveau d'agrégation. Dans ces cas, puisque la plupart des données sont supprimées, l'instrument peut avoir des difficultés pour atteindre 100 événements par type de perle et les résultats peuvent être discutables. L'étape de sonication (étape 3.2) vise à minimiser l'agrégation de billes. De plus, le stockage des perles comme un mélange maître de microsphères diluée (1,20 étape) peut aider. Nous avons remarqué que TMAC excluant de la Hybribuffer dization - il en ajoutant au diluant SA-PE au lieu (étape 3.5) - permet de minimiser l'agrégation de billes. En outre, si nous n'avons pas testé cela, les perles magnétiques récentes disponibles auprès de Luminex ou BioRad On pense à afficher moins d'une tendance à s'agréger.
Les résultats de l'application d'un tableau 5-plex Luminex ciblant G. vaginalis, A. vagin, L. iners, L. crispatus, et L. gasseri avec coloration de Gram des frottis correspondants prélèvement vaginal sont présentés dans la figure 4. Ces échantillons ont été prélevés à partir d'un seul individu à plusieurs moments. Au temps 0, l'individu a été diagnostiqué avec BV basée sur la coloration de Gram (figure 4A) et les résultats de cette Luminex même échantillon (figure 4B) montrent que sur les organismes représentés dans le tableau, G. vaginalis a été la plus répandue, alors que A. vagin et L. iners étaient également positifs. Neuf jours plus tard, l'individu était toujours positive et le BV signal pour G. vaginalis a considérablement augmenté alors que A. vagin et L. iners étaient encore positifs. Surtout, après ce temps la personne a commencé la transition vers un microbiote normal que les bacilles à Gram positif est devenu détectable dans le frottis (figure 4A) alors que le signal pour G. vaginalis faibli et que le signal pour L. iners augmenté (figure 4B). Par notre définition originale de BV avec cette méthode (échantillons positifs pour G. vaginalis et / ou A. vagin ont été considérés comme positifs BV) 13, cet individu a été positif BV à tous les temps, bien que la coloration de Gram a échoué à détecter G. vaginalis dans les deux derniers points du temps. Avec la méthode décrite ici Luminex, les tendances peuvent être facilement comparés aux méthodes basées sur le séquençage, et les résultats du test Luminex généralement corroborer les colorations de Gram 13 tout en fournissant des informations supplémentaires sur identité de l'organisme et l'abondance.

Figure 1. Schéma du protocole de Luminex pour déterminer le profil microbiote d'un échantillon clinique complexe ou environnementaux. Le protocole débute avec l'ADN matrice qui a été extraite de l'échantillon d'intérêt. (1) Générer des produits de PCR de l'ADN matrice en utilisant brin spécifique biotinylé, phosphorothioate modifiée cpn60 UT amorces PCR couplée avec un fichier cpn60 UT amorces PCR (tableau 1), (2) Cela génère une piscine produit de PCR représentant le microbiote avec la biotine- phosphorothioate modification sur un brin, (3) Digest le produit double brin par PCR avec l'exonucléase T7, qui ne peuvent pas dégrader le brin phosphorothioate-modifié et génère donc un ADN simple brin qui est modifié à l'extrémité 5 'avec de la biotine, (4) Couple billes de polystyrène pour les espèces spécifiques cpn60 sondes UT - chaque perle a une adresse unique spectrale (indiqué par la couleur perle) que jediscernable par le Luminex ou Bio-Plex instrument de s (5); Hybrider le produit simple brin généré par PCR de l'échantillon d'intérêt à la suite d'espèces spécifiques d'oligonucléotides couplés perles; (6) Ajouter conjugué streptavidine-phycoérythrine qui se lie à l'biotinylé simple brin produit de PCR et agit comme un indicateur de l'hybridation; (7) Déterminez l'adresse spectrale (billes d'identité) et l'intensité du signal d'hybridation utilisant un Luminex ou Bio-Plex instrument. Au moins 100 perles sont comptés pour chaque identité bourrelet et l'intensité médiane de fluorescence (MFI) du signal de la phycoérythrine est rapporté que la sortie. Jusqu'à 100 différents types de billes peuvent être évalués simultanément, mais un test montrant la discrimination de trois types de billes est illustré. (8) Lorsque l'IMF de la PCR se réplique générée à partir du même échantillon est sensiblement supérieur au contrôle négatif pour une donnée perles (unilatéral de Student-test, p <0,05), l'échantillon est considéré comme positif pour l'organisme.
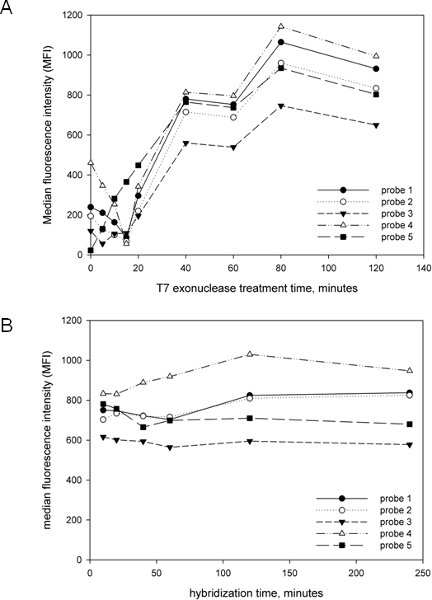
Figure 2. Optimisation des paramètres de dosage Luminex. Cinq sondes différents, s'adressant à anaerobius Peptostreptococcus ont été utilisés avec des amplicons générés à partir d'un modèle mixte comprenant des plasmides contenant la cloné cpn60 UT de 20 bactéries connues pour être associées avec le vagin, y compris P. anaerobius. (A). Effet de la durée du traitement T7 exonucléase. Le protocole décrit ci-dessus a été suivie, mais le temps de traitement avec l'exonucléase T7 a été variée avant l'hybridation et l'intensité médiane de fluorescence (MFI) a été déterminée pour toutes les sondes. (B). Effet de la durée d'hybridation. Le protocole décrit ci-dessus a été suivie avec une variété de fois l'hybridation. Les mêmes ensembles de sondes ont été utilisées avec un amplicon généré à partir du même modèle que dans A et l'intensité médiane de fluorescence (MFI) a été déterminée pour toutes les sondes.
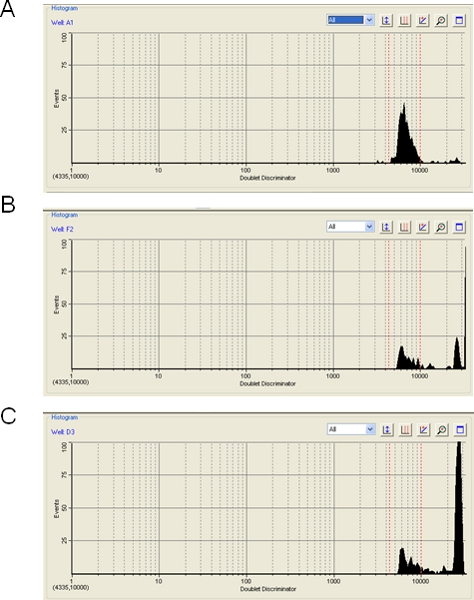
Figure 3. Détermination de l'agrégation billes en utilisant le logiciel Bioplex. Trois exemples sont donnés de pistes Bioplex dans lequel le niveau d'agrégation est billes (A) acceptable (5%), (B) limite (50%) et (C) inacceptable (80%).
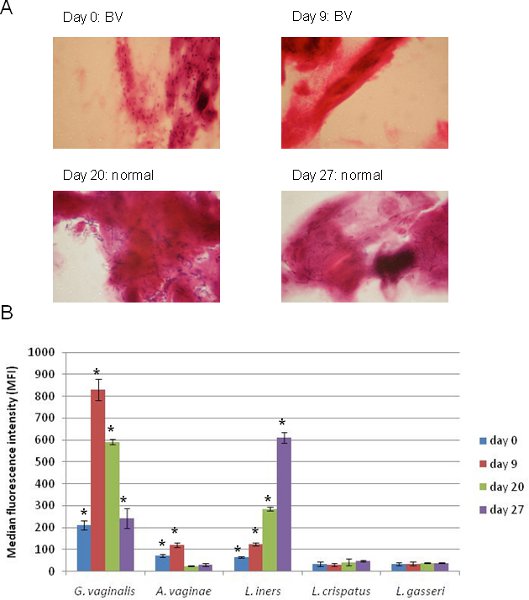
Figure 4. Application d'un tableau 5-plex Luminex pour le diagnostic BV dans les échantillons séquentiels tiré du même individu. (A). Coloration de Gram diapositives montrant le traditionnel diagnostic utilisés pour évaluer chaque échantillon pour BV. (B). Application d'un tableau 5-plex Luminex préparé et exécuté comme décrit dans ce protocole pour les mêmes quatre échantillons présentés dans (A). Cibles bactériennes dont le MFI signal a été significativement positif par notre définition (unilatéral de Student-test, p <0,05) sont indiquées par un astérisque (*).
Discussion
La spécificité de la génération du signal est d'une importance critique; vous devez être convaincus que le signal observé reflète vraiment la détection de l'amplicon généré par cet organisme. Des logiciels tels que PrimerPlex (Premier Biosoft) peut aider à concevoir des sondes qui vont s'hybrider efficacement, mais ils peuvent ou non croisées s'hybrident à des espèces non ciblées. Lorsque des amorces universelles PCR sont utilisés comme décrit dans ce protocole, il est important de gard...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Alberto Severini et Vanessa Goleski de l'aide pour le développement de tests et de commentaires critiques sur ce manuscrit. Ce travail a été financé par l'Agence de santé publique du Canada et le Programme d'aide la recherche industrielle (Conseil national de recherches du Canada). Un appui supplémentaire a été obtenue à l'Université de la Saskatchewan Fonds de publication.
matériels
| Name | Company | Catalog Number | Comments |
| Nom d'oligonucléotides | Société | Séquence 1 | |
| H279BP | Invitrogen, IDT, ou d'autres | Biotine-OEFO GAIIIIGCIGGIGAYGGIACIACIAC | |
| H280 | YKIYKITCICCRAAICCIGGIGCYTT | ||
| H1612BP | Biotine-OEFO GAIIIIGCIGGYGACGGYACSACSAC | ||
| H1613 | CGRCGRTCRCCGAAGCCSGGIGCCTT | ||
| 1O, phosphorothioate-C, E, G-phosphorothioate; F, phosphorothioate-A; I, inosine, Y, C ou T, R, A ou G, K, T ou G, S, C ou G. | |||
Séquences Tableau 1. Des oligonucléotides modifiés pour Universal cpn60 PCR.
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| 1-éthyl-3-(3-dimethylamiopropyl) carbodiimide HCl (EDC) | Pierce | 22980 | |
| Billes de polystyrène fluorescentes: Microplex microsphères (Luminex), ou Bio-Plex COOH billes (Bio-Rad) | Luminex ou Bio-Rad | Bio-Rad: 171-506xxx où xxx correspond à l'identificateur de perles | Les billes magnétiques sont désormais disponibles pour le couplage d'oligonucléotides et peut offrir certains avantages. N'ont pas été jugés par ces auteurs. |
| Oligonucléotides de capture (5 'aminés modifiés C12) | Invitrogen, IDT, ou d'autres | diverses | Niveau de pureté dessalée est acceptable. Séquences des sondes de capture utilisée pour caractériser des prélèvements vaginaux sont fournis dans le manuscrit sur lequel ce protocole est basé 13. |
| T7exonucléase | New England Biolabs | M0263S | |
| Streptavidine-R-phycoérythrine (SA-PE) | Invitrogen | S-866 | Soyez prudent afin d'obtenir une grande pureté SA-PE, ce numéro de catalogue est recommandé |
| Thermométrique 96 puits Plaques PCR | Fisher | CS006509 | tienne compte des deux thermocycleur 96 puits et la machine Bioplex |
| Thermométrique étanchéité tapis | Fisher | CS006555 | Peut-être ré-utilisés; laver à l'eau savonneuse, bien rincer et sécher |
| TMAC 5M | Sigma | T3411 | |
| Bio-Plex ou de l'instrument Luminex | Bio-Rad ou Luminex | Bio-Rad: 171-000201 | |
| Logiciels pour la conception de la sonde PrimerPlex | Premier Biosoft | www.premierbiosoft.com | Suggestions pour la sonde de Luminexsigne, bien que d'autres plates-formes logicielles peuvent être utilisés |
Tableau 2. Réactifs et équipements spécifiques.
| composante | ul / dosage | dosages μl/100 | concentration finale |
| 10x tampon PCR (Invitrogen) | 5 | 500 | 1x |
| 50 mM MgCl 2 (Invitrogen) | 2.5 | 250 | 2,5 mM |
| DNTP 10 mM | 1 | 100 | 0,2 mM de chaque |
| H279BP, 25 pM | 0,25 | 25 | 375 nm |
| H1612BP, 25 pM | 0,75 | 75 | 125 nM |
| H280, 25 pM | 0,25 | 25 | 375 nm |
| H1613,25 pM | 0,75 | 75 | 125 nM |
| Eau | 34 | 3400 | --- |
| Totaux | 44,5 | 4450 |
Tableau 3. Suggérée mélanges pour PCR avec amorces modifiées cpn60 TU (tableau 1). Le test est mis en place pour 5 pi d'ADN matrice et 0,5 ul (2,5 U) de Taq ADN polymérase (Invitrogen). Normalement grands volumes sont préparés (par exemple, suffisant pour 100 tests) et stockés à -20 ° C.
Références
- Hale, L. P., Swidsinski, A., Mendling, W. Bacteria associated with bacterial vaginosis. N. Engl. J. Med. 354, 202-203 (2006).
- Hay, P. Life in the littoral zone: lactobacilli losing the plot. Sex. Transm. Infect. 81, 100-102 (2005).
- Morris, M., Nicoll, A., Simms, I., Wilson, J., Catchpole, M. Bacterial vaginosis: a public health review. Brit. J. Obstet. Gynecol. 108, 439-450 (2001).
- Myer, L., Kuhn, L., Stein, Z. A., Wright, T. C., Denny, L. Intravaginal practices, bacterial vaginosis, and women's susceptibility to HIV infection: epidemiological evidence and biological mechanisms. Lancet. Infect. Dis. 5, 786-794 (2005).
- Wilson, J. Managing recurrent bacterial vaginosis. Sex. Transm. Infect. 80, 8-11 (2004).
- Nugent, R. P., Krohn, M. A., Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J. Clin. Microbiol. 29, 297-301 (1991).
- Ison, C. A., Hay, P. E. Validation of a simplified grading of Gram stained vaginal smears for use in genitourinary medicine clinics. Sex. Transm. Infect. 78, 413-415 (2002).
- Money, D. The laboratory diagnosis of bacterial vaginosis. Can. J. Infect. Dis. Med. Microbiol. 16, 77-79 (2005).
- Schellenberg, J. Pyrosequencing of the chaperonin-60 universal target as a tool for determining microbial community composition. Appl. Environ. Microbiol. 75, 2889-2898 (2009).
- Spear, G. T. Comparison of the diversity of the vaginal microbiota in HIV-infected and HIV-uninfected women with or without bacterial vaginosis. J. Infect. Dis. 198, 1131-1140 (2008).
- Brotman, R. M., Ravel, J. Ready or not: the molecular diagnosis of bacterial vaginosis. Clin. Infect. Dis. 47, 44-46 (2008).
- Fredricks, D. N., Fiedler, T. L., Marrazzo, J. M. Molecular identification of bacteria associated with bacterial vaginosis. N. Engl. J. Med. 353, 1899-1911 (2005).
- Dumonceaux, T. J. Multiplex detection of bacteria associated with normal microbiota and with bacterial vaginosis in vaginal swabs by use of oligonucleotide-coupled fluorescent microspheres. J. Clin. Microbiol. 47, 4067-4077 (2009).
- Molenkamp, R., van der Ham, A., Schinkel, J., Beld, M. Simultaneous detection of five different DNA targets by real-time Taqman PCR using the Roche LightCycler480: Application in viral molecular diagnostics. J. Virol. Meth. 141, 205-211 (2007).
- Nikiforov, T. T., Rendle, R. B., Kotewicz, M. L., Rogers, Y. H. The use of phosphorothioate primers and exonuclease hydrolysis for the preparation of single-stranded PCR products and their detection by solid-phase hybridization. PCR. Methods. Appl. 3, 285-291 (1994).
- Hill, J. E., Penny, S. L., Crowell, K. G., Goh, S. H., Hemmingsen, S. M. cpnDB: A Chaperonin Sequence Database. Genome. Res. 14, 1669-1675 (2004).
- Bradshaw, C. S. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. J. Infect. Dis. 194, 828-836 (2006).
- Dumonceaux, T. J. Enumeration of specific bacterial populations in complex intestinal communities using quantitative PCR based on the chaperonin-60 target. J. Microbiol. Meth. 64, 46-62 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon