Method Article
Electroporation de Mesenchyme craniofaciale
Dans cet article
Erratum Notice
Résumé
Cartilages craniofaciale développent en contact étroit avec d'autres tissus et sont difficiles à manipuler des animaux vivants. Nous utilisons l'électroporation pour offrir des outils moléculaires lors de la croissance du squelette cranio-facial tout en contournant les premiers effets embryonnaire. Cette approche nous permettra de tester efficacement des molécules candidates In vivo.
Résumé
L'électroporation est une méthode efficace de délivrer de l'ADN et d'autres macromolécules chargées dans les tissus à des moments précis et dans des endroits précis. Par exemple, l'électroporation a été utilisée avec succès pour étudier le développement neural et rétiniennes chez Xenopus, le poulet et la souris 1-10. Toutefois, il est important de noter que dans toutes ces études, les enquêteurs ne visaient pas les tissus mous. Parce que nous sommes intéressés au développement cranio-faciales, nous avons adapté une méthode pour cibler mésenchyme facial.
Lorsque nous avons cherché la littérature, nous avons trouvé, à notre grande surprise, très peu de rapports de transfert de gènes réussie dans le tissu cartilagineux. La majorité de ces études étaient des études de thérapie génique, comme la livraison de siRNA ou de protéines dans des lignées cellulaires chondrogénique, ou des modèles animaux d'arthrite 11-13. Dans d'autres systèmes, comme le poulet ou la souris, l'électroporation de mésenchyme facial a été difficile (COMMUNICAT personnellesions, Département du développement cranio-facial, KCL). Nous avons supposé que l'électroporation dans les tissus cartilagineux et procartilaginous chez Xenopus pourrait mieux fonctionner. Dans nos études, nous montrons que le transfert de gène dans les cartilages faciaux se produit de manière efficace à un stade précoce (28), lorsque l'ébauche du visage est toujours composé de tissus mous avant de différenciation du cartilage.
Xenopus est un système très accessible pour l'analyse des vertébrés développement cranio-facial. Structures cranio-faciale sont plus facilement visibles chez Xenopus que dans n'importe quel modèle d'autres vertébrés, principalement parce que les embryons de xénope sont fécondés à l'extérieur, permettant l'analyse des premières étapes, et en facilitant l'imagerie en direct à la résolution seule cellule, ainsi que la réutilisation des 14 mères. Parmi les modèles de développement des vertébrés à l'extérieur, Xenopus est plus utile pour l'analyse craniofaciale que le poisson-zèbre, comme les larves de Xenopus sont plus grandes et plus faciles à dissect, et la région en développement du visage est plus accessible à l'imagerie de la région équivalente dans le poisson. En outre, les Xenopus sont évolutivement plus proche de l'homme que le poisson-zèbre (environ 100 millions ans plus près) 15. Enfin, à ces stades, les têtards de Xenopus sont transparentes, et l'expression simultanée des protéines fluorescentes ou des molécules permettant une visualisation facile des cartilages en développement. Nous prévoyons que cette approche nous permettra de tester rapidement et efficacement des molécules candidates dans un système modèle in vivo.
Protocole
Partie 1A. Équipement
Microscope: debout champ stéréoscopique avec l'objectif de faible puissance
- Tension / Générateur d'impulsions: BTX ECM 830 Système Place électroporation vague
- Pipeter extracteur: P-87 Micropipette Puller (Sutter Instrument Company, CA)
- Manipulateur: grossier, ou combinés grossier et fin en fonction de la préparation.
- Micropipette titulaire: Outils Fine Science
- Électrode: maison
- L'électroporation de chambre: maison
L-électrodes en forme:
- Couper 8 cm de haute pureté 0,4 mm fil de tungstène (Goodfellow) et apposer au milieu d'une seringue de 1 ml d'utiliser du mastic (nous utilisons la Blu-Tack). Laisser 4 cm de fil de tungstène exposée de la pointe de la seringue et l'embout plier en forme de L, 1 cm de l'extrémité (fig. 1A).
- Garniture pointe de sorte que la fin des mesures de 0,5 mm de longueur. Tson pourboire est le terminus de l'électrode.
- Exécutez l'excès parallèles fil de tungstène à la seringue et l'utiliser pour connecter le générateur d'impulsions de l'électrode.
- Répétez le processus faisant une paire d'électrodes.
- Attacher les électrodes au générateur d'ondes carrées d'impulsion via des câbles à courant continu.
L'électroporation de chambre
- Tapisser le fond plat de 90 mm avec ~ 5 mm modeler non toxique.
- Remplissez plat avec les médias électroporation.
- En utilisant une pince n ° 5 horloger se tailler un puits en forme de T (fig. 2). Le bien longtemps devrait mesurer environ 2 mm x 2 mm x 10 mm et le court ~ 2 mm x 2 mm x 5 mm. Le plat électroporation peuvent être lavés et réutilisés.
Partie 1B. Réactifs
ADN ou macromolécules chargées
- Micropipettes: 1 mm de large 4 "de long en verre borosilicate capillaires (WPI, TW100-F)
- Milieux de culture: Normal amphibiens médias (NAM)
- > 10 X stock: 1100 mM NaCl, 20mM de KCl, 10 mM de Ca (NO 3) 2 • 4H 2 O, 1 mM EDTA.
- Autoclave et conserver à 4 ° C.
- 1 X NAM: Diluer de stock, tampon 10x avec 0,1 mM NaHCO 3 et 0,2 mM de Na 3 PO 4.
- Têtards Xenopus laevis, le stade 28
Préparation de l'ADN:
- Préparer des plasmides d'expression utilisant des protocoles standard.
- Resuspendre l'ADN à une concentration finale de 1 ug / ul dans nucléase libre H 2 0.
* Nous avons eu du succès avec des vecteurs contenant un promoteur fort CMV, comme pCS2 + [16]. Pour l'analyse de la lignée, nous avons généralement des ADN codant la protéine fluorescente verte (GFP + pCS2) à une concentration finale de 0,1 pg / pl. Les concentrations d'ADN [entre 0,1 à 3 pg / pl ont également été testés. Nous avons constaté que des concentrations inférieures à 0,8 pg / pl cellules inefficace étiquetés, tandis que des concentrations d'ADN de plus de 2 pg / m &u; L n'a pas d'améliorer l'efficacité d'électroporation].
Morpholino oligonucléotides préparation:
(Remarque:. OM doivent être fluorescéine (3'-carboxyfluorescéine modifié) ou autrement chargés)
- Resuspendre oligonucléotides morpholino (OM) (Genetools, www.genetools.com ) à une concentration de 2 mM dans nucléase libre H 2 0.
- Aliquote de la chaleur de la solution mère à 65 ° C pendant 5 minutes.
- Diluer à la concentration finale de 0,5 mM dans l'eau sans nucléase.
* 0.1-1mm solutions MO ont été testés. 0,5 mM solutions MO ont été suffisantes pour l'électroporation de nombreuses cellules mésenchymateuses.
Micropipettes
- Préparer Micropipettes capillaires à partir de verre borosilicate (1 mm de large, 4 "de long, WPI pas. TW100-F). Utilisez extracteur d'aiguilles pour préparer micropipettes avec un cône 8-12 mm de long et à pointe fine.
- Astuce Crush ~ 2 mmde la pointe avec une pince, en créant une pause déchiquetées.
Médias
- Milieux d'incubation: Préparer une solution fraîche 3 / 4 normal amphibiens médias (MNA) de 1x stock. Ajouter 0,025 mg / ml de gentamycine.
- L'électroporation des médias: comme ci-dessus, avec 0,1% de benzocaïne (Sigma, 06950).
2. L'électroporation
Micropipette configuration
- Remplissez micropipette avec ~ 1 solution injectable ul.
- Fixez micropipette au micromanipulateur et joindre à microinjecteur (Picospritzer II).
- Micropipette angle à 50 ° de la table.
- Régler la pression d'injection à 20 PSI.
- Calibrer micropipette à injecter 30 nl par impulsion.
Préparation Tadpole
- Anesthetize stade de 28 larves de Xenopus par l'incubation dans les médias électroporation pendant 5 minutes.
- Transfert de têtard anesthésiés dans la chambre d'électroporation remplis avec les médias électroporation. Position d'embryondans le temps et afin que la tête repose dans le T-jonction avec la face dorsale vers le bas et la face ventrale exposés. La tête doit être légèrement surélevée par rapport à la queue.
- En utilisant des pinces, doucement sécurisé têtard bien avec entourant la plasticine. (Note:.. Si le têtard n'est pas sécurisé, il peut se contracter et contact des électrodes au cours électroporation Dans ce cas, jetez le têtard que mouchoirs seront sévèrement endommagé)
L'électroporation
- Insérer le bout micropipette immédiatement postérieure à la glande du ciment et dans le mésenchyme du visage.
- Injecter solution à 30 nl en mésenchyme.
- Rétracter micropipette.
- Aligner rapidement des conseils d'électrode parallèle à la tête de l'embryon (fig. 3).
- Appliquer 8 50 ms, impulsions 20mV carrés.
- Rétracter électrodes.
- En utilisant des pinces attentivement communiqué de têtard à partir ainsi et le transfert à 3 / 4 NAM, 0,025 mg / ml de gentamycine.
- Les têtards peuvent être incubés dans 3 / 4 NAM, 0,025 mg / ml overnight, ou plus.
- Embryons d'écran pour l'électroporation efficace par microscopie à fluorescence après 24 heures.
3. Les résultats représentatifs:
L'utilisation de molécules fluorescentes permet un dépistage facile d'embryons électroporé. La figure 4 montre un lot typique de MO électroporées têtards ~ 12, 48 et 96 heures après l'électroporation, incubés à 14,5 ° C. En utilisant la microscopie à fluorescence, les OM peuvent être visualisées immédiatement après l'électroporation et persister pendant plusieurs jours après l'électroporation. Dans notre expérience, la fluorescence est faiblement évidente au stade 46 (~ 5 jours plus tard). Dans les cartilages, la fluorescence diminue considérablement après l'apparition de la différenciation (~ st 42); cependant, la fluorescence persiste MO plus fortement dans d'autres types cellulaires tels que l'endoderme du pharynx. La microscopie à fluorescence montre que les oligonucléotides sont incorporées dans plusieurs tissus dont le cartilage craniofaciales. Oligonucléotidiques par fluorescence cune souvent être visualisées dans le tissu de chaque côté de la tête. Cela est probablement dû à la diffusion rapide de la solution injectable dans le mésenchyme lâche craniofaciales avant l'électroporation.
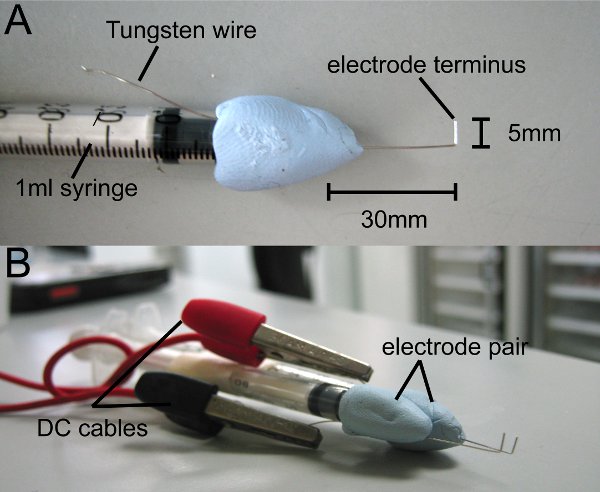
Figure 1 électrodes maison. Fil de tungstène en forme de L est attachée à une seringue de 1 ml à l'aide non-toxique d'argile ou de mastic. (A) Le terminus d'électrode mesures 5 mm. (B) Joindre une paire d'électrodes, de sorte que les terminus sont parallèles. Des électrodes sont fixées à générateur d'impulsions par des câbles à courant continu.

Figure 2 chambre d'électroporation. (A) 90 mm plat bordé avec de la plasticine est rempli avec les médias et une chambre en forme de T sculptés avec une pince Aucun horloger de 5. (B) Le côté le plus long mesure 2 mm x 2 mm X10 mmtandis que les mesures à court de 2 mm x 2 mm x 5 mm. Le chef de l'embryon repose dans la jonction en T, la face ventrale en place.
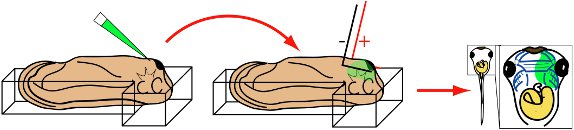
Figure 3 Procédure électroporation schématique illustrant. St. 28 têtard est placé dans la chambre d'électroporation, la face ventrale en place. Micropipette est inséré dans la glande de ciment mésenchyme facial sous-jacent. Injecter. Micropipette est enlevé et la L-électrodes en forme sont alignés parallèlement flanquant la tête. Appliquer huit de 50 ms, 20 mV impulsions carrées. Rétracter électrodes. Cultivez têtards au stade désiré. Visualisez MOS ou expression de la GFP en utilisant la microscopie à fluorescence.
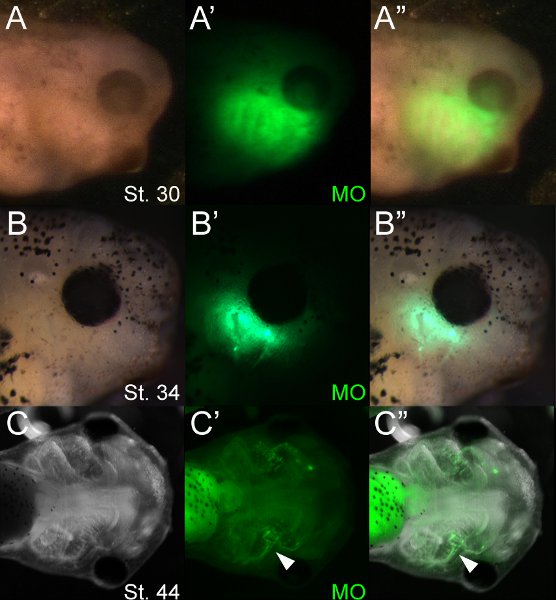
Figure 4 têtards représentant 12 (A), 48 (B) et 96 (C) heures après l'électroporation (stades 30, 34 et 44 respectivement). (A "B") Fluorescent MO peuvent être visualisés au sein de mésenchyme cranio au cerfes 30 et 34. Fluorescence peut être détectée dans les cartilages au stade 44 (pointe de flèche, C'-C "). L'intestin est très autofluorescente.
Discussion
Dans cette vidéo, nous avons démontré la faisabilité de la livraison de gènes médiée par électroporation dans le mésenchyme du visage de têtards de Xenopus. En utilisant cette approche, nous pouvons contourner les premiers effets du développement de la manipulation de la fonction des gènes qui nous permet de cibler des tissus spécifiques à des points plus tard. Nos études montrent que les populations hétérogènes de cellules mésenchymateuses craniofaciales peuvent être touchés, ce qui nous permet d'examiner la lignée de cellules par électroporation des cellules ainsi que des exigences autonomes pour des protéines d'intérêt. Combiné avec l'imagerie en direct, nous pouvons utiliser cette approche pour étudier la fonction des gènes, au fil du temps, au cours du développement cranio-facial. Cette nouvelle méthode met en évidence la traçabilité de Xenopus pour l'étude de l'organogenèse. Nous prévoyons que cette méthode peut être largement adapté à l'étude la morphogenèse et la différenciation des tissus d'autres aussi.
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêts.
Remerciements
Nous sommes reconnaissants à Nancy Papalopulu et Boyan Bonev de l'aide pour l'électroporation Xenopus. Nous remercions également Marc Dionne pour la lecture critique, Jeremy Green et John Wallingford pour des discussions utiles et des membres du laboratoire Liu pour leur soutien. Ce travail a été financé par des subventions du BBSRC (BB/E013872/1) et le Wellcome Trust (081880/Z/06/Z) pour KJL.
Références
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20, 19-32 (2011).
- Haas, K. Single-cell electroporation for gene transfer in vivo. Neuron. 29, 583-591 (2001).
- Calegari, F. Tissue-specific RNA interference in post-implantation mouse embryos using directional electroporation and whole embryo culture. Differentiation. 72, 92-102 (2004).
- Drinjakovic, J. E3 ligase Nedd4 promotes axon branching by downregulating PTEN. Neuron. 65, 341-357 (2010).
- Falk, J. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC. Dev. Biol. 7, 107-107 (2007).
- Hewapathirane, D. S., Haas, K. Single Cell Electroporation in vivo within the Intact Developing Brain. J. Vis. Exp. (17), e705-e705 (2008).
- Kuriyama, S. Tsukushi controls ectodermal patterning and neural crest specification in Xenopus by direct regulation. of BMP4 and X-delta-1 activity. Development. 133, 75-88 (2006).
- Mende, M., Christophorou, N. A., Streit, A. Specific and effective gene knock-down in early chick embryos using morpholinos but not pRFPRNAi vectors. Mech. Dev. 125, 947-962 (2008).
- Neumann, E. Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo. J. 1, 841-845 (1982).
- Price, S. R. Regulation of motor neuron pool sorting by differential expression of type II cadherins. Cell. 109, 205-216 (2002).
- Grossin, L. Direct gene transfer into rat articular cartilage by in vivo electroporation. Faseb. J. 17, 829-835 (2003).
- Khoury, M. A comparative study on intra-articular versus systemic gene electrotransfer in experimental arthritis. J. Gene. Med. 8, 1027-1036 (2006).
- Takahashi, D. Down-regulation of cathepsin K in synovium leads to progression of osteoarthritis in rabbits. Arthritis. Rheum. 60, 2372-2380 (2009).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Wheeler, G. N., Brandli, A. W. Simple vertebrate models for chemical genetics and drug discovery screens: lessons from zebrafish and Xenopus. Dev. Dyn. 238, 1287-1308 (2009).
- Turner, D. L., Weintraub, H. Expression of achaete-scute homolog 3 in Xenopus embryos converts ectodermal cells to a neural fate. Genes. Dev. 8, 1434-1447 (1994).
Erratum
Formal Correction: Erratum: Electroporation of Craniofacial Mesenchyme
Posted by JoVE Editors on 6/28/2013. Citeable Link.
A correction was made to Electroporation of Craniofacial Mesenchyme. There was an incorrect unit used for the voltage.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon