Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Haut débit cristallisation des protéines membranaires en utilisant la méthode lipidique Bicelle
Dans cet article
Résumé
Bicelles sont des mélanges de lipides / amphiphile qui maintiennent les protéines membranaires (les députés) au sein d'une bicouche lipidique, mais ont un comportement de phase unique qui facilite criblage à haut débit par les robots de cristallisation. Cette technique a réussi à produire un certain nombre de structures à haute résolution provenant des deux sources procaryotes et eucaryotes. Cette vidéo décrit les protocoles pour générer le mélange lipidique bicelle, en incorporant les députés dans le mélange bicelle, la mise en place des essais cristallisations (manuellement ainsi que robot) et des cristaux de la récolte à partir du milieu.
Résumé
Les protéines membranaires (les députés) jouent un rôle essentiel dans de nombreux processus physiologiques tels que le pompage des molécules spécifiques à travers la bicouche membranaire contraire imperméable qui entoure toutes les cellules et les organelles. Altérations de la fonction du résultat de députés dans plusieurs maladies et affections humaines, ainsi, une compréhension complexe de leurs structures demeure un objectif essentiel pour la recherche biologique. Cependant, la détermination des structures de députés demeure un défi important souvent issus de leur hydrophobicité.
Les députés ont d'importantes régions hydrophobes incorporé dans la bicouche. Les détergents sont fréquemment utilisés pour solubiliser ces protéines de la bicouche générant une micelle protéines de détergent qui peuvent ensuite être manipulés d'une manière semblable que les protéines solubles. Traditionnellement, les essais de cristallisation se faire en utilisant un mélange de protéines de détergent, mais ils résistent souvent à produire des cristaux de cristallisation ou de mauvaise qualité. Ces problèmes surviennent en raison de lal'incapacité du détergent pour bien imiter la bicouche résultant en une mauvaise stabilité et de l'hétérogénéité. En outre, les boucliers de détergent à la surface hydrophobe de la MP en réduisant la surface disponible pour les contacts de cristal. Pour contourner ces inconvénients députés peut être cristallisé dans les médias lipidique, qui reproduit plus fidèlement leur environnement endogène, et est récemment devenu une technique de novo pour la cristallisation MP.
Lipidique phase cubique (LCP) est une bicouche lipidique en trois dimensions pénétré par un système interconnecté de canaux aqueuse à 1. Bien monooléine est le lipide de choix, les lipides connexes tels que monopalmitolein et monovaccenin ont également été utilisés pour faire LCP 2. Les députés sont incorporés dans le LCP où ils diffusent en trois dimensions et des noyaux de cristal nourrir. Un grand avantage de la LCP est que la protéine reste dans un environnement plus natif, mais la méthode a un certain nombre d'inconvénients techniques, y compris visc hauteosity (nécessitant des appareils spécialisés) et des difficultés dans la visualisation et la manipulation de cristal 3,4. En raison de ces difficultés techniques, nous avons utilisé un autre support lipidique pour la cristallisation-bicelles 5,6 (figure 1). Bicelles sont des mélanges de lipides / amphiphile formé par le mélange d'un lipide phosphatidylcholine (DMPC) avec un amphiphile (CHAPSO) ou un lipide à chaîne courte (DHPC). Dans chaque disque bicelle, les molécules lipidiques génèrent une bicouche tandis que la ligne amphiphile des molécules apolaires fournissant les bords des propriétés bénéfiques des deux bicouches et des détergents. Surtout, en dessous de leur température de transition, la protéine-bicelle mélanges ont une viscosité réduite et sont manipulés d'une manière semblable comme détergent solubilisées députés, rendant bicelles compatible avec les robots de cristallisation.
Bicelles ont été utilisées avec succès à cristalliser plusieurs protéines membranaires 5,7-11 (tableau 1). Cette collection croissantedes protéines démontre la polyvalence de bicelles de cristalliser deux hélice alpha et feuillet bêta députés à partir de sources procaryotes et eucaryotes. En raison de ces succès et la simplicité de mise en œuvre à haut débit, bicelles devrait faire partie de l'arsenal tous les cristallographe protéines de la membrane. Dans cette vidéo, nous décrivons la méthodologie bicelle et de fournir un protocole étape par étape pour la mise en place des essais de cristallisation à haut débit des députés purifiée en utilisant la robotique standard.
Protocole
Bicelle cristallisation base se compose de quatre étapes de base (figure 2): i) préparation d'un bicelle lipidique formant: mélange amphiphile; ii) l'incorporation de la protéine purifiée dans le milieu bicelle; iii) des essais de cristallisation (manuellement ou de manière robotisée), et iv) visualisation, l'extraction et le gel de cristal. Ces étapes sont décrites en détail ci-dessous
1. Préparation de bicelles
Bicelles peuvent se former dans une variété de lipides: les combinaisons amphiphile et sur une large gamme de concentrations. Par conséquent, une composition à base initiale sur les conditions de succès antérieurs, il est recommandé (tableau 1). Le mélange le plus de succès est le DMPC: CHAPSO bicelle formulation, qui peut être soit achetés dans le commerce comme une pré-mélangé prêt à utiliser la formulation (voir tableau des réactifs ci-dessous) ou préparés en laboratoire tel que décrit. Pour cet exercice, nous allons préparer 1 ml de DMPC 35%: mélange CHAPSO à un ratio 2,8:1 molaire.
- Peser 0,26 g DMPC (M. 677,9 g / mol), 0,09 g CHAPSO (M. 630,9 g / mol) et ajouter de l'eau déminéralisée pour un volume final de 1,0 ml.
- Le pourcentage bicelle peut varier entre 10% -40% avec un DMPC: CHAPSO rapport molaire allant de 2.6-3.0:1 (tableau 1).
- Remarque: Plus la concentration de la bicelle plus il est difficile de dissoudre les lipides entraîne une viscosité supérieure solution. Cependant, une formulation concentrée bicelle peut être avantageux lorsque la concentration en protéines est faible.
- Dissolution des lipides pour obtenir une solution homogène nécessite un effort considérable, faisant de cette étape, la plupart du temps dans la méthode bicelle. Faites défiler les étapes suivantes jusqu'à la DMPC est complètement mélangé:
- Chauffer le mélange à ~ 40 ° C en utilisant un bain d'eau ou d'un incubateur et vortex pour ~ 1 minute.
- Remarque: Comme plusieurs cycles sont effectués, le réchauffement le mélange se traduira par un con gel-likecohérence rend difficile de vortex.
- Refroidir le mélange sur la glace et le vortex pendant quelques minutes. Refroidissement aide liquéfier la solution facilitant le vortex.
- Remarque: Comme plusieurs cycles sont effectués, le mélange peut devenir trouble au refroidissement.
- Répétez les étapes énumérées ci-dessus (1.2.1 et 1.2.2) jusqu'à ce que le lipide est complètement dissoute.
- Remarque: Ce processus peut prendre plusieurs heures. La formation Bicelle est indiqué par les changements de comportement de phase des DMPC: formulation CHAPSO. Une fois terminée, le mélange sera un gel transparent ou au-dessus la température ambiante et un liquide visqueux sur la glace.
- Chauffer le mélange à ~ 40 ° C en utilisant un bain d'eau ou d'un incubateur et vortex pour ~ 1 minute.
- Le mélange est bicelle maintenant prêt à utiliser et peut être conservé à -20 ° C pour stockage à long terme (jusqu'à 5 ans). En raison du risque d'hydrolyse du groupe de tête des phospholipides, il n'est pas conseillé de stocker bicelles à température ambiante pendant de longues périodes.
2. Incorporation de protéines dans bicelles
La plupart des structures MP ont été obtenus à partir de bicelles cristallisé dans DMPC: CHAPSO bicelle concentration allant de 2 à 8% en utilisant une concentration en protéines de 8 à 12 mg / ml (tableau 1). Si possible, les écrans initiaux devraient utiliser ces lignes directrices et des concentrations supplémentaires peuvent être criblés à l'étape de l'optimisation. Comparée à la méthode LCP, l'incorporation de protéines avec bicelles est un processus simple (figure 3), qui devrait être fait le même jour que des essais de cristallisation.
- Décongeler le DMPC: CHAPSO bicelle mélange à température ambiante jusqu'à ce que le changement de phase pour un gel transparent.
- Remarque: Plusieurs gel-dégel ne sera pas affecter le comportement bicelle.
- Placer le mélange sur la glace pour liquéfier et brièvement au vortex pour rétablir une phase homogène bicelle. Lorsqu'il est placé sur la glace, le mélange peut devenir trouble.
- From sur ce point, garder le mélange et la protéine purifiée bicelle sur la glace. Cela permet de garder l'bicelle dans une phase liquide qui rend prêtent à de pipetage.
- Ajouter le mélange à l'bicelle purifiée détergent solubilise la protéine dans un 1:4 (V / V) ratio.
- Par exemple: 100 ul de protéines bicelle mélange est obtenu en mélangeant 80 ul de protéines avec 20 bicelle ul. Si la concentration en protéines est de 15 mg / ml et la concentration bicelle est de 35%, cela donne un mélange de protéines bicelle-incorporé avec une concentration en protéines de 12 mg / ml et une concentration bicelle de 7%.
- Mélanger doucement le contenu de pipetage de haut en bas jusqu'à ce que la solution devienne claire et homogène.
- Remarque: Si des bulles apparaissent, un tour rapide (30-60 secondes, 13000 rpm, 4 ° C) avec une centrifugeuse de table peut aider à les supprimer.
- Incuber le mélange sur la glace pendant au moins 30 min pour favoriser l'intégration complète de la protéine into bicelles. Le mélange de protéines bicelle est maintenant prêt pour des essais de cristallisation.
3. Mise en place d'essais de cristallisation
Autres techniques de cristallisation des lipides tels que le LCP nécessitent un équipement spécialisé à cause de forte viscosité du médium, mais le comportement de phase unique de mise en œuvre dans bicelles permet pratiquement n'importe quel format standard, y compris la cristallisation de la robotique (figure 3). Essais de cristallisation peut être effectuée soit en suspension ou assis formats de dépôt en utilisant la norme des écrans disponibles dans le commerce.
- Que la mise en place des plateaux manuellement ou en utilisant un robot de cristallisation, de maintenir le mélange de protéines bicelle sur la glace. Cela permet de garder le froid mélange de protéines-bicelle et s'assurer que la viscosité de la solution est minime.
- Essais de cristallisation Manuel - Utiliser une pipette standard, le mélange de protéines bicelle peut être mélangée avec une solution de réservoir de la même manière que normalement effectuerED pour des protéines membranaires solubles ou détergent solubilisé.
- Remarque: Conservez le mélange de protéines bicelle sur la glace pendant les essais.
- Essais de cristallisation robotisée - Nous avons adapté ces épreuves pour le robot de cristallisation Mosquito, mais en principe (suivant les mêmes précautions) la technique devrait être compatible avec tous les robots de cristallisation. Les conseils suivants vous assurer que le mélange de protéines bicelle reste frais et avec précision la pipette par le robot:
- Prérefroidir la plaque de maintien du mélange de protéines-bicelle en le plaçant sur la glace.
- Pipeter le mélange de protéines bicelle dans la plaque et de continuer à maintenir la plaque sur la glace. Cette plaque doit être le dernier élément d'aller sur le robot avant de commencer la course.
- Mise en place du bac réservoir et les couvercles de cristallisation sur la plate-forme 3 et 5, respectivement, du robot moustique.
- Placer la plaque contenant des protéines bicelle mélange sur la plate-forme 4du robot moustique. Ceci assure le mélange de protéines bicelle est le dernier à être capté par le robot et il est immédiatement libéré.
- Afin d'éviter le chauffage et augmentation de la viscosité, ne pas mélanger le réservoir avec le mélange de protéines bicelle.
- Lorsque vous effectuez plusieurs écrans, retourner immédiatement la plaque bicelle en protéines à la glace pour le refroidissement dès que une course est terminée.
- Volume de goutte et le ratio (protéine: réservoir) peut être choisi que pour des essais de cristallisation conventionnels. Par exemple, les essais initiaux de cristal à l'aide du robot moustique peut être configuré à l'aide de protéines 0,25 ul: mélange bicelle plus 0,25 réservoir ul.
- Incuber les essais de cristal dans une chambre à 20 ° C. La température est une sélection de bonnes et de paramètre d'optimisation car le comportement de phase des bicelles dépend de la température.
- Des températures plus élevées induisent la phase lamellaire 12 (figure 1), qui a l'avantage de pré-organisationla protéine dans des couches. Les températures inférieures à 20 ° C peuvent être criblés, mais vous ne devriez pas descendre en dessous de 4 ° C, car cela pourrait provoquer des lipides pour précipiter sur de longues périodes de temps.
- De la même manière que des essais de cristallisation traditionnelle, les essais doivent être surveillés bicelle sur une base régulière pour l'apparence de cristaux et de croissance. Nous vous recommandons de vérifier sur les plateaux de la 1 ère et 3 ème jour post-installation suivie d'une inspection hebdomadaire.
- Optimisation de cristal peut être effectuée en utilisant des méthodes couramment utilisées pour les cristaux de détergent à base de grille dont le dépistage, le dépistage d'additifs, en changeant etc températures plus, le pourcentage bicelle et de protéines: rapport bicelle peuvent être variées. Par ailleurs, bicelles peuvent être dopés avec des lipides spécifiques qui peuvent être nécessaires pour la stabilité des protéines ou de fonction.
4. Visualisation, cristal d'extraction et de congélation
Depuis les procès de cristal avec le mélange de protéines bicelle avoir une viscosité similaire à la protéine-détergent gouttes, la visualisation et l'extraction de cristal est de routine et est effectuée comme traditionnelle set-ups.
- Visualisation: Contrairement aux médias LCP qui nécessite souvent un éclairage de haute qualité sous une lumière normale et polarisée pour la détection des cristaux, la visualisation n'est pas entravée par bicelles. Coloré et aussi incolore, gouttes de cristal de protéines peuvent être facilement analysés à l'aide de microscopes standard et aucun équipement spécial n'est requis.
- Bicelles, comme d'autres supports lipidiques, ont tendance à produire un pourcentage élevé de faux positifs. Un microscope UV contribue grandement à différencier des protéines à partir de cristaux de sel (figure 4).
- Extraction et de congélation: extraction de cristal et le gel est relativement simple et ne nécessite pas la dissolution des médias bicelle environnantes. En outre, la phase de bicelle se donne quelques modérée cryo-protection.
5. Les résultats représentatifs:
nt "> Il prend généralement 2-3 jours pour les cristaux à comparaître et à environ une semaine ou plus pour eux de grandir à leur taille maximale. Ce fut le cas pour la bactériorhodopsine et le canal de souris anions voltage-dépendants 1 (mVDAC1) 4,8 cristaux . Pour d'autres protéines membranaires cela peut prendre plusieurs semaines pour la croissance cristalline, il est donc important de continuer à suivre les essais de cristal bien au-delà des premières semaines.Comme avec les autres médias lipidique, bicelles tendent à former des formes qui peuvent paraître cristalline. Il a également été observé qu'ils conduisent à un pourcentage plus élevé de sel et de cristaux de lessive. Un microscope à UV qui détecte la fluorescence du tryptophane peut considérablement aider à éliminer ces non-protéiques de faux positifs. La figure 4 montre des formes de lipides, de sel et de cristaux de protéines que considérée à la lumière visible et UV pour aider à distinguer les différents résultats qui peuvent être observés.
83fig1.jpg "/>
Figure 1. Bicelle schématique. Bicelles sont composés d'une molécule lipidique bicouche formant comme DMPC (bleu) et un amphiphile tels que CHAPSO (vert), qui protège les bords hydrophobe de la bicouche. Comme la température est augmentée, en forme de disque bicelles subir une transformation de phase dans une feuille 12 lamellaire perforé.
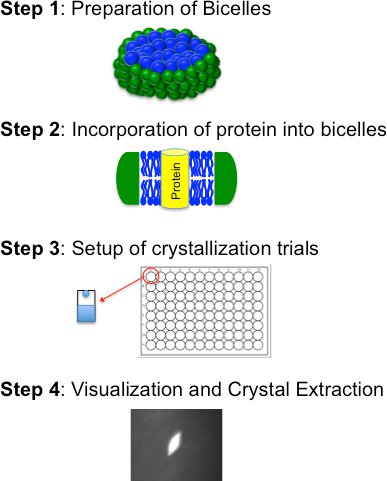
Figure 2. Organigramme pour le procédé de cristallisation bicelle décrivant les quatre étapes de base.

Figure 3. Essais cristal configuration schématique. Protéines membranaires purifiées détergent solubilisé peut être directement mélangé avec bicelles sur la glace par un simple pipetage du contenu ensemble. Après incubation du mélange de protéines / bicelle sur la glace pour les essais de cristallisation ~ 30 minutes,peuvent être mis en place en utilisant n'importe quel format standard dont la robotique.

Figure 4. Visualisation des essais de cristal. Image visible (en haut) et de l'image UV (panneau inférieur) de (A) cristaux aciculaires observés dans un état de sel seulement. Pas de fluorescence peut être détectée à partir des cristaux, une indication de faux positif. (B) en forme de bâtonnet cristal formé dans un état de MPD. Le cristal fluorescence faiblement mais a été jugée non protéinique utilisant diffraction des rayons X. (C) Crystal observer environ quatre semaines après la mise en place des essais. La forte fluorescence sous lumière UV confirme qu'il est un cristal de protéine.
| No. | Protéines | Source | Formulation Bicelle | Protéines Concentratisur | Détergent 1 | Résolution (A) | Référence |
| 1 | Bactériorhodopsine 2 | Halobacterium salinarum | 8% DMPC: CHAPSO (2,8:1) | 8 mg / ml | 2.0 | Faham et Bowie, 2002 | |
| 8% DTPC: CHAPSO (3:1) | 8 mg / ml | 1.8 | Faham et al., 2005 | ||||
| 2 | β2-adrénergiques / complexe Fab | Homo sapiens | 8,3% DMPC: CHAPSO (3:1) | 10 mg / ml | DDM | 3.4/3.7 | Rasmussen et al., 2007 |
| 3 | Canal anionique voltage-dépendants 1 | Mus musculus | 7% DMPC: CHAPSO (2,8:1) | 12 mg / ml | LDAO | 2.3 | Ujwal et al., 2008 |
| 4 | Xanthorhodopsin | Salinibacter ruber | 4,2% DMPC, NM 5% | 4 mg / ml | DDM | 1.9 | Luecke et al., 2009 |
| 5 | Protéase Rhomboid | Escherichia coli | 2% DMPC: CHAPSO (2,6:1) | 9 mg / ml | Glucoside Nonyl | 1.7 | Vinothkumar, 2011 |
1 détergent utilisé pour la purification des protéines membranaires
2 lipides des membranes pourpres autochtones peuvent être emportés lors de la purification
Tableau 1. Résumé des conditions de cristallisation pour les structures de protéines membranaires résolu en utilisant bicelles.
Access restricted. Please log in or start a trial to view this content.
Discussion
Bicelles sont un support unique lipidique qui offrent un natif bicouche-comme l'environnement tout en se comportant comme si solubilisées par des détergents. Cette propriété donne bicelles un net avantage sur les autres méthodes de cristallisation à base de lipides car il n'y a pas de courbe d'apprentissage ou de l'équipement spécialisé requis pour cette technique. Une fois bicelles sont disponibles, que ce soit commercial ou préparé dans le laboratoire, ils peuvent être directement mélangé...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous tenons à remercier les Drs. James Bowie et Salem Faham pour fournir une expertise technique et des conseils sur la méthode et le Dr bicelle Aviv Paz pour des discussions utiles. Nous reconnaissons l'appui Le Du expérimental. Rachna Ujwal a des intérêts financiers dans MemX Biosciences LLC, qui, cependant, ne prend pas en charge ce travail. Ce travail a été soutenu en partie par des subventions du NIH (RO1 GM078844).
Access restricted. Please log in or start a trial to view this content.
matériels

Références
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon