Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En décapsidation in vitro du VIH-1 Cores
Dans cet article
Résumé
Décapsidation est une étape essentielle dans la phase précoce du cycle de vie du VIH-1 et est défini comme le démontage de la coquille de capside et la libération des complexes de ribonucléoprotéines virales (vRNP). Ici, nous montrons des techniques pour isoler des noyaux intacts à partir de virions VIH-1 et pour quantifier leur décapsidation In vitro.
Résumé
Le génome des rétrovirus est enfermé dans une capside entourée d'une enveloppe lipidique. Pour lentivirus, comme le VIH-1, la coquille conique capside est composée de protéines CA disposés comme un treillis de l'hexagone. La capside est fermé par 7 pentamères à la fin de large et 5 à l'extrémité étroite du cône 1, 2. Enfermé dans cette coquille capside est le complexe de ribonucléoprotéines virales, et ensemble, ils constituent le cœur.
Suite à la fusion de la membrane virale avec la membrane de la cellule cible, le VIH-1 est libérée dans le cytoplasme. La capside démonte puis en relâchant sans CA de la forme soluble 3 dans un processus appelé décapsidation. La localisation intracellulaire et le calendrier du VIH-1 décapsidation sont mal comprises. Simple substitutions d'acides aminés dans les CA qui modifient la stabilité de la capside également nuire à la capacité du VIH-1 à infecter les cellules 4. Cela indique que la stabilité de la capside est critique pour le VIH-1. VIH-1 décapsidation a été difficile à étudier en raison du manque de disponibilité des tests sensibles et fiables pour ce processus. Nous décrivons ici une méthode quantitative pour l'étude de décapsidation in vitro en utilisant des noyaux isolés de VIH-1 infectieux des particules. L'approche implique l'isolement des noyaux par sédimentation de virions concentrés à travers une couche de détergent et d'un gradient de saccharose linéaire, dans le froid. Pour quantifier décapsidation, les noyaux isolés sont incubées à 37 ° C pour les différents intervalles de temps et ensuite sédimentées par ultracentrifugation. L'étendue de la décapsidation est analysée par la quantification de la fraction du CA dans le surnageant. Cette approche a été employée pour analyser les effets des mutations virales sur le VIH-1 de la stabilité capside 4, 5, 6. Il devrait également être utile pour étudier le rôle des facteurs cellulaires du VIH-1 décapsidation.
Protocole
1. Production de particules de VIH-1
Avant de procéder, vous devez obtenir la permission et suivez les directives du Bureau de la biosécurité de votre institution à travailler dans un établissement agréé pour la biosécurité VIH infectieux. Vous devez vous assurer que les soins et les précautions de sécurité sont suivies pendant le travail dans le laboratoire de biosécurité.
Production de particules de VIH-1 est généralement effectuée par transfection transitoire de cellules 293T avec le VIH-1 ADN proviral en utilisant une méthode de transfection de phosphate de calcium 7, 8. Haute stocks de virus cultivés par titre culture de cellules infectées par T conviennent également.
- Culture des cellules 293T au moyen Eagle modifié par Dulbecco (DMEM) contenant 10% de sérum fœtal bovin (FBS) et complété avec des antibiotiques [pénicilline (100 UI / ml) et streptomycine (100 ug / ml)] à 37 ° C, 5% de CO 2 .
- Détachez les cellules à partir des plats de près de confluence avec 0,25% de trypsine-EDTA et des semences 2x10 6 cellules dans 9 ml par 100 mm boîte de culture un jour avant la transfection. Graine six 100 boîtes de culture mm pour la production de virions. Si la préparation concentrée de cœurs est nécessaire, des plats plus pourraient être semées pour la transfection.
- Le lendemain, les monocouches de cellules doit être d'environ 25% de confluence et prêt pour la transfection. Pendant six plats de cellules à transfecter, amener 120 pg d'ADN proviral jusqu'à un volume de 2,7 ml d'eau stérile. A ce mélange, ajouter 0,3 ml de 2,5 M CaCl 2 et 3 ml de 2XBBS, et bien mélanger par pipetage de haut en bas plusieurs fois. Laisser le mélange reposer à température ambiante pendant 10-20 minutes.
- Ajouter 1 ml de la goutte à goutte le mélange résultant au centre de chaque plat tout en tourbillonnant doucement pour mélanger. Placez les plats pendant la nuit (~ 16 heures) dans un incubateur réglé à 35 ° C et 3% de CO 2.
- Aspirer le milieu de culture et doucement, ajouter 5 ml de PBS.
- Aspirer PBS et ajouter 5 ml de milieu frais. Culture des cellules dans un incubateur à 37 ° C et 5% de CO 2 pour les 24-48 heures supplémentaires.
- Recueillir le surnageant de culture contenant des particules virales, le transférer à un tube de 50 ml à centrifuger conique. Combinez les surnageants de tous les plats et centrifuger à 1500 xg pendant 5 min pour sédimenter les cellules et les débris. Filtrer le surnageant à l'aide de filtres de 0,45 um seringue taille des pores. Des précautions doivent être prises pour minimiser la formation d'aérosols tout en travaillant avec le virus vivant. Cela comprend l'utilisation de tubes coniques avec joints toriques ou couvre benne rotor pendant l'étape de centrifugation. Si cela n'est pas possible, les bouchons à vis des tubes doivent être enveloppés avec du parafilm.
2. Concentration de virions VIH-1 par ultracentrifugation
- Placer le surnageant de culture (30 ml) dans un tube de 38,5 ml polyallomère centrifugeuse (pour Beckman SW32Ti rotor ou équivalent). Sous-couche doucement le surnageant contenant le virus avec 5 ml de solution de saccharose à 20% dans du PBS à l'aide d'une pipette de 5 ml.
- Centrifuger pendant 3 heures à32000 rpm à 4 ° C (175 000 xg à r max) pour les particules de virus de granules.
- Retirer le surnageant par aspiration, en prenant soin de ne pas perturber le culot au fond du tube. Ajouter 0,5 ml de 1XSTE tampon (10 mM Tris-HCl [pH 7,4], NaCl 100 mM, EDTA 1 mM) pour le tube et le lieu à 4 ° C pendant 1 heure à desserrer le culot. L'utilisation d'un large alésage une pipette ml délicatement la pipette haut et en bas à quelques reprises pour détacher le culot au fond du tube. Ensuite, le transfert de l'desserré granulés à un tube de 1,5 ml, en prenant soin d'éviter de faire mousser. Incuber à 4 ° C pour un autre 1-3 heures pour permettre aux petites touffes de virus à se disperser. Durant cette période, préparer le gradient de saccharose comme décrit dans l'étape 3.1.
- Délicatement la pipette la suspension de virus de haut en bas plusieurs fois et centrifuger à 8000 rpm (6000 xg) à 4 ° C dans une centrifugeuse réfrigérée pendant 1 min pour éliminer les grumeaux résiduels. Gardez le froid de l'échantillon pendant ce processus.
3. Gradient de saccharosecentrifugation pour isoler des noyaux
VIH-1 les noyaux sont isolés en utilisant un «spin-thru" méthode 9 qui est une modification de la méthode décrite précédemment pour la purification du VIH-2 cœurs 10.
- Préparer un ml 12 linéaires de 30% à 70% dans un tampon de gradient de saccharose 1XSTE dans un tube 14,5 ml polyallomère centrifugeuse pour SW32.1Ti rotor. Pour préparer dégradé, utilisez un gradient de 20 ml ancienne, lieu de 6 ml de solution de saccharose à 70% sur le côté proche (à proximité de l'orifice de sortie) et 6 ml de solution de saccharose à 30% de l'autre côté. Assurez-vous que les bulles d'air ne sont pas piégés dans le canal reliant les deux chambres. Utilisez la fonction Auto-Flow Densi gradient anciens pour pomper le dégradé de bas en haut du tube contenant 1 ml de solution de saccharose à 85% dans le fond. Placez délicatement le gradient à 4 ° C jusqu'à refroidi (2-4 heures).
- L'utilisation d'un large alésage une pipette ml délicatement superposition du gradient avec 0,25 ml de solution de saccharose à 15% à STE contenant 1% de Triton X-100.
- Doucement superposition avec 0,25 ml de solution de saccharose à 7,5% en utilisant une gamme STE-alésage une pipette ml. Attention à ne pas mélanger les couches.
- Doucement superposition avec 0,5 ml de suspension du virus de l'étape 2.4. Cette étape doit être réalisée avec soin pour éviter toute perturbation dans la pente et le mélange des couches de saccharose underlaid.
- Placer les tubes dans le seau de pré-refroidissement SW32.1Ti et centrifuger à 32000 rpm (187000 xg à r max) pendant la nuit (16-20 heures) à 4 ° C. Pour éviter une pause de la centrifugeuse, ne commencez pas la centrifugation jusqu'à ce que le vide dans le centrifugeur atteint 250 um
- Collecter des fractions de 1 ml de haut en bas de la pente en utilisant le gradient de fractionnement automatique Densi-Flow. Placer les tubes sur la glace immédiatement après la collecte. Mélanger le contenu des tubes en inversant quelques fois, et de retirer 50 ul de chaque fraction pour la quantification par ELISA ou inverser dosage de l'activité transcriptase.
4. Localisation du VIH-1 des noyauxet le stockage des noyaux
- Avant de procéder à des dosages décapsidation, il est important de déterminer quelles fractions contiennent intacte VIH-1 des noyaux. Ceci peut être déterminé par ELISA p24 ou inverser dosage de l'activité de la transcriptase utilisant les 50 aliquotes de l'étape 3.6.
- La reprise du CA associé avec les noyaux est souvent liée à la stabilité des noyaux. Mesurer le noyau associé CA par ELISA p24 9 en utilisant un échantillon de chaque fraction. Alternativement, mesurer l'activité de la transcriptase inverse de chaque fraction. En utilisant les deux méthodes le pic devrait être d'environ 10 fraction.
- Piscine des fractions contenant des noyaux. Si les carottes ne doivent pas être utilisés pour la décapsidation dosage immédiatement, partie aliquote des noyaux regroupés en aliquots de 0,2 ml à 0,3, flash-gel en N2 liquide et conserver à -80 ° C. Les carottes congelés de cette manière sont adaptés pour le dosage décapsidation. Le rendement du CA core-associé est typiquement 1-2 mg par millilitre de p24 ou environ 15% du total des virions associésp24.
5. Test cinétique du VIH-1 décapsidation
- La quantité de VIH-1 carottes requises par réaction décapsidation est d'environ 50 ng. Pour effectuer le dosage in vitro décapsidation, prédilué l'aliquote de carottes avec un volume égal de tampon 1XSTE froide pour réduire la viscosité de la suspension et de minimiser les erreurs de pipetage.
- Diluer 100 ml de l'cœurs dans 0,15 ml de tampon 1XSTE froide contenant 10 pg / ml de BSA dans un tube de 1,5 ml. Nous complétons le tampon STE avec la BSA (10 pg / ml) afin de minimiser l'adsorption de CA sur les parois du tube. Mélanger par moments le tube retournant plusieurs. Ne pas vortexer les échantillons. Incuber les tubes dans un bain d'eau à 37 ° C pour les intervalles de temps (15, 30, 60 et 120 min). Les tubes doivent être immergés dans le bain d'eau d'au moins jusqu'au niveau de l'échantillon interne afin d'assurer même le réchauffement.
- Durant l'incubation, mélanger délicatement le contenu du tube périodiquement (généralement 5 -10 min) en feuilletant le tube. Pour un contrôle de zéro minute, diluer 100 ul de cœurs dans 0,15 ml de tampon 1XSTE froide et laisser incuber dans la glace pendant toute la durée de l'expérience (120 min). Le contrôle de zéro minute donne la valeur basale et décapsidation est utilisé pour déterminer augmentation décapsidation des carottes incubées à 37 ° C pour les différents intervalles de temps.
- A la fin de la période d'incubation, arrêter le processus de décapsidation en plaçant les tubes dans la glace pendant 10 minutes.
- Centrifuger les tubes à 45 000 rpm (TLA-55 du rotor; 125 000 xg à r max) pendant 20 minutes à 4 ° C. Ce sera un culot de noyaux intacts et la libre circulation des CA publié à la suite de décapsidation de cœurs resteront dans le surnageant. Le rotor doit être préalablement refroidi à 4 ° C avant le chargement des échantillons.
- Transférer le surnageant dans de nouveaux tubes de microcentrifugeuse prérefroidi de préférence en utilisant un gel de chargement astuces stockée à température ambiante. S'il vous plaît noter que la pastille ne sera pas visible à l'œil nu, afin de prendre un soin extrême wien de pipetage sur le surnageant. Resuspendre les pastilles dans 250 pl de diluant pour échantillons ELISA (0,5% de Triton X-100 et de 5% des donateurs de sérum de veau dans du PBS). Pour assurer une dissolution efficace de la pastille, vortex après l'ajout du diluant pour échantillons ELISA. Quantifier le contenu CA du culot et du surnageant à l'aide p24 ELISA comme décrit dans la section suivante.
- L'étendue de la décapsidation est obtenue en calculant la fraction du CA présents dans le surnageant.
6. Dosage de l'AC par ELISA p24
- Beaucoup de trousses commerciales ELISA sont disponibles et peuvent être utilisés pour quantifier CA. Utilisez n'importe quel commerce ou «in-house" ELISA et inclure des normes p24 pour déterminer la linéarité du dosage. Les dilutions des échantillons doivent être testés pour assurer l'exactitude.
- Nous avons développé un ELISA maison qui nous utilisent régulièrement le dosage de CA. La procédure est adapté d'un précédent rapport 11 et est réalisée en utilisant des anticorps de capture et de détection disponibles de l'AID NIHRecherche S and Référence Reagent Program.
7. Les résultats représentatifs:
Un exemple de résultat de test ELISA pour la détermination des fractions contenant de base est montré dans la figure 1. Après avoir recueilli des fractions (1 ml chacune), 50 pl de l'échantillon de chaque fraction a été utilisé pour faire des dilutions en série et analysées par ELISA. La p24 total obtenu en additionnant les valeurs de douze fractions a été de 14,5 ug. Comme le montre la figure dans les fractions 8 à 10 noyaux contenus. La valeur p24 pour les fractions de coeur contenant était de 2,17 mg. Le pourcentage de core-p24 associée (14,97%) a été déterminé en prenant le ratio de la valeur p24 pour les fractions de base (2,17 mg) à la valeur totale de p24 (14,5 mg). Fraction 1 ou 2 contiendra toujours plus grande quantité de p24, ce qui représente CA libre qui n'est pas associée à des noyaux. Elle est suivie par une réduction progressive des valeurs de p24 avec chaque fraction subséquente, puis une forte hausse, et enfin une forte baisse de la p24valeurs. Si prise en charge adéquate pendant le chargement du gradient, puis le sommet du noyau associée CA se trouve autour fraction de 10.
Un résultat typique obtenu par le dosage de la cinétique de décapsidation du VIH-1 noyaux est illustré à la Figure 2. Le graphique montre une augmentation en fonction du temps décapsidation de type sauvage du VIH-1 des noyaux. Le pour cent décapsidation valeur a été obtenue en calculant la fraction du CA présents dans le surnageant. Avec la pratique, le dosage est hautement reproductible et est utile pour déterminer la stabilité des noyaux virale in vitro. S'il vous plaît noter que la reproductibilité de l'essai est fortement tributaire de la manipulation des échantillons au cours de la procédure. Depuis les noyaux sont thermolabiles, les échantillons doivent être conservés à 4 ° C tout au long du test, sauf pendant la période d'incubation.
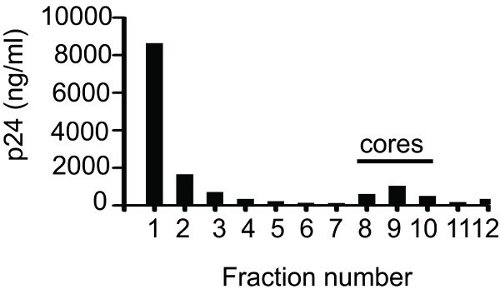
Figure 1 centrifugation par gradient de densité de l'équilibreVIH-1 des noyaux. Une suspension de virus concentrée a été appliquée au sommet d'un gradient de saccharose linéaire 30 à 70% recouverte de 1% de Triton-X-100. Après centrifugation nuit à 187 000 xg et 4 ° C, des fractions de 1 ml ont été recueillies de haut (Fraction 1) en bas (Fraction 12) et p24 a été quantifiée par ELISA.
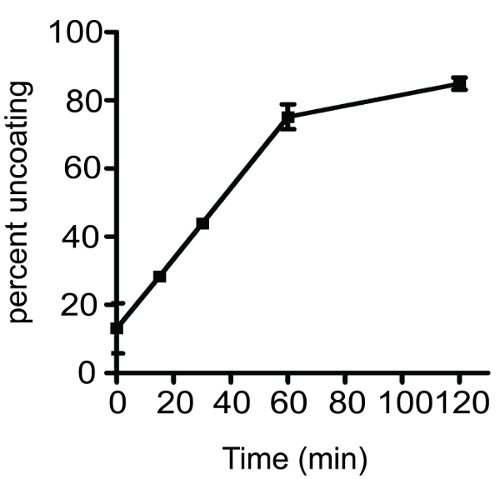
Figure 2 Évolution dans le temps du VIH-1 décapsidation in vitro. VIH-1 purifiée noyaux ont été dilués et incubées à 37 ° C pendant les intervalles de temps indiqués. L'échantillon a été incubé à zéro min sur la glace pendant toute la durée de l'expérience. Après incubation, les échantillons ont été soumis à une ultracentrifugation à 125 000 xg pendant 20 minutes à 4 ° C. Surnageant et de boulettes ont été séparés et analysés par ELISA p24. L'étendue de la décapsidation a été déterminée comme décrit dans le texte du protocole. Chaque réaction décapsidation a été réalisée en double; barres d'erreur couvrent la gamme des deux valeurs.
Discussion
La méthode décrite ici pour purifier le VIH-1 pour étudier des noyaux décapsidation in vitro est utile pour étudier cette phase du cycle de vie du VIH-1, notamment en raison de l'indisponibilité d'une méthode validée d'analyser le VIH-1 dans les cellules cibles décapsidation. Bien que cette méthode utilise pour purifier l'équilibre ultracentrifugation noyaux, d'autres ont utilisé granulation directe après lyse brièvement avec 1% de Triton-X-100 12, 13 ou granulation à traver...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
VIH-1 des études décapsidation dans le laboratoire Aiken ont été soutenus par des subventions des NIH AI40364, AI50423 et AI076121. Plusieurs matériaux clés, y compris les réactifs utilisés dans le test ELISA p24, ont été fournies par la recherche du NIH sida et du programme de référence, Division du sida, du NIAID, NIH.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Le numéro de catalogue | Commentaires (optionnel) |
| DMEM | Cellgro | 10 à 013-CV | |
| PBS | Cellgro | 21 à 031-CV | |
| Triton-X-100 | Mallinckrodt Baker Inc | 9002-93-1 | |
| Tween 20 | Acros | 9005-64-5 | |
| 0,25% de trypsine-EDTA | Cellgro | 25 à 053-CI | |
| 2XBBS | Composition: 50mm BES [p H 6,95], 280 mM de NaCl et 1,5 mM Na 2 HPO 4. Ajuster le pH à 6,95à température ambiante. Stériliser par filtration et les stocker en aliquots à -20 ° C. | ||
| D'anticorps de revêtement: anticorps monoclonal pour p24 (183-H12-5C) | NIH AIDS Research and Référence Reagent Program | 3537 | |
| L'anticorps primaire: le VIH-Ig (sérum hyperimmun patient humain) | NIH AIDS Research and Référence Reagent Program | 3957 | |
L'anticorps secondaire: Chèvre anti-IgG humaine, conjuguée à la peroxydase | Pierce | 31130 | |
| Substrat HRP | KPL Inc | 50-76-11 | |
| Immulon 2HB plaques de 96 puits | Thermo Scientific | 3455 | |
| SW32Ti et SW32.1 rotors Ti et ultracentrifugeuse compatibles | Beckman Coulter | ||
| TLA-55 du rotor et ultracentrifugeuse de table | Beckman Coulter | ||
| Haute microtubes de la vitesse | Beckman Coulter | 326823, 358123, 357448 | |
| Auto-Densi fractionnement du gradient de densité de flux | Labconco Corp | 4517000 | |
| Dégradé Ancien | CBS Scientific Co. Inc | GM-20 |
Références
- Ganser, B. K., Li, S., Klishko, V. Y., Finch, J. T., Sundquist, W. I. Assembly and analysis of conical models for the HIV-1 core. Science. 283, 80-83 (1999).
- Li, S., Hill, C. P., Sundquist, W. I., Finch, J. T. Image reconstructions of helical assemblies of the HIV-1 CA protein. Nature. 407, 409-413 (2000).
- Aiken, C. Viral and cellular factors that regulate HIV-1 uncoating. Curr. Opin. HIV. AIDS. 1, 194-199 (2006).
- Forshey, B. M., Schwedler, U. v. o. n., Sundquist, W. I., Aiken, C. Formation of a human immunodeficiency virus type 1 core of optimal stability is crucial for viral replication. J. Virol. 76, 5667-5677 (2002).
- Forshey, B. M., Aiken, C. Disassembly of human immunodeficiency virus type 1 cores in vitro reveals association of Nef with the subviral ribonucleoprotein complex. J. Virol. 77, 4409-4414 (2003).
- Wacharapornin, P., Lauhakirti, D., Auewarakul, P. The effect of capsid mutations on HIV-1 uncoating. Virology. 358, 48-54 (2007).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Aiken, C., Prasad, V. R., Ganjam, K. V. . Methods in Molecular Biology. 485, 41-53 (2009).
- Kotov, A., Zhou, J., Flicker, P., Aiken, C. Association of Nef with the human immunodeficiency virus type 1 core. J. Virol. 73, 8824-8830 (1999).
- Kewalramani, V. N., Emerman, M. Vpx association with mature core structures of HIV-2. Virology. 218, 159-168 (1996).
- Wehrly, K., Chesebro, B. p24 antigen capture assay for quantification of human immunodeficiency virus using readily available inexpensive reagents. Methods. 12, 288-293 (1997).
- Welker, R., Hohenberg, H., Tessmer, U., Huckhagel, C., Kräusslich, H. G. Biochemical and structural analysis of isolated mature cores of human immunodeficiency virus type 1. J. Virol. 74, 1168-1177 (2000).
- Briggs, J. A., Wilk, T., Welker, R., Kräusslich, H. G., Fuller, S. D. Structural organization of authentic, mature HIV-1 virions and cores. EMBO J. 22, 1707-1715 (2003).
- Auewarakul, P., Wacharapornin, P., Srichatrapimuk, S., Chutipongtanate, S., Puthavathana, P. Uncoating of HIV-1 requires cellular activation. Virology. 337, 93-101 (2005).
- Accola, M. A., Ohagen, A., Göttlinger, H. G. Isolation of human immunodeficiency virus type 1 cores: retention of Vpr in the absence of p6(gag. J. Virol. 74, 6198-6202 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon