Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Formulation de nanoparticules polymériques dibloc par la technique nanoprécipitation
Dans cet article
Résumé
Cet article décrit une méthode pour synthétiser nanoprécipitation à base de polymères diblocs nanoparticules à l'aide de co-polymères. Nous allons discuter de la synthèse de co-polymères diblocs, la technique nanoprécipitation, et les applications potentielles.
Résumé
La nanotechnologie est une branche relativement nouvelle de la science qui consiste à mobiliser les propriétés uniques des particules qui sont nanomètres échelle (nanoparticules). Les nanoparticules peuvent être conçus de façon précise où leur chimie taille, la composition et la surface peut être soigneusement contrôlée. Cela permet une liberté sans précédent de modifier certaines des propriétés fondamentales de leur cargaison, telles que la solubilité, diffusivité des caractéristiques de biodistribution, la libération et l'immunogénicité. Depuis leur création, les nanoparticules ont été utilisées dans de nombreux domaines de la science et la médecine, y compris la livraison de médicaments, imagerie, biologie cellulaire et 1-4. Cependant, il n'a pas été entièrement utilisé en dehors des «laboratoires nanotechnologies» en raison de barrières techniques perçue. Dans cet article, nous décrivons une méthode simple pour synthétiser une plate-forme de nanoparticules à base de polymère qui a une large gamme d'applications potentielles.
La première étape consiste à synthétiser un dibloc co-polymère qui possède à la fois un domaine hydrophobe et hydrophile de domaine. Utiliser PLGA et PEG que les polymères modèle, nous a décrit une réaction de conjugaison avec EDC / NHS chimie 5 (figure 1). Nous discutons également le processus de purification de polymères. Le dibloc synthétisé co-polymère peuvent s'auto-assembler dans des nanoparticules dans le processus de nanoprécipitation travers hydrophobe-hydrophile interactions.
Les nanoparticules de polymère décrite est très polyvalent. Le noyau hydrophobe de la nanoparticule peut être utilisé pour transporter de la drogue peu solubles pour experiments6 livraison de drogue. Par ailleurs, les nanoparticules peuvent surmonter le problème des solvants toxiques pour peu solubles réactifs de biologie moléculaire, telles que wortmannine, ce qui nécessite un solvant comme le DMSO. Cependant, le DMSO peut être toxique pour les cellules et d'interférer avec l'expérience. Ces médicaments peu solubles et réactifs peuvent être dispensés de manière efficace en utilisant des nanoparticules de polymères avec une toxicité minimale. Nanoparticules de polymère peut également être chargé avec un colorant fluorescent et utilisées pour les études de trafic intracellulaire. Enfin, ces nanoparticules de polymère peut être conjugué au ciblage des ligands par PEG surface. Ces nanoparticules ciblées peuvent être utilisées pour étiqueter des épitopes spécifiques sur ou dans les cellules de 7-10.
Protocole
1. Synthèse de PLGA-b-polymère PEG
- Poly (D, L-lactide-co-glycolide) (PLGA) avec des groupes terminaux carboxylate (PLGA-carboxylate) est dissous dans un solvant pour le PLGA (comme mentionné dans la section matériaux) à une concentration de 5 mM. PLGA peut être dissoute à cette concentration avec une agitation douce.
- Les deux NHS (poids moléculaire 115,09) et l'EDC (poids moléculaire 191,7) sont dissous dans la solution de PLGA à une concentration de 25 mM. (EDC et du NHS sont ajoutés dans un excès stoechiométrique de 5 fois par rapport à PLGA). PLGA-carboxylate est converti en PLGA-NHS en ajoutant EDC et NHS de PLGA-carboxylate solution avec une agitation douce pendant environ 1 heure.
- Le produit de réaction PLGA-NHS est précipité en ajoutant du méthanol solution de lavage. Environ 10 fois plus de volume de méthanol est ajouté à la solution. La solution est centrifugée à 2000 xg pour précipiter le PLGA-NHS et jeter le surnageant (supprime les traces d'EDC et du NHS. Cette procédure de lavage avec du méthanol est répété au moins trois fois.
- Le culot PLGA-NHS est séché sous vide pendant 30 minutes pour éliminer toute trace de la solution de lavage.
- Le culot PLGA-NHS est maintenant re-dissous dans le même solvant à la même concentration qui a été utilisé initialement pour dissoudre PLGA. Le PEG hétérobifonctionnel (amine-PEG-carboxylate) est alors ajouté à la solution de PLGA à une concentration de 5 mm (rapport stœchiométrique de 1:1). La solution du mélange est incubé pendant 24 heures avec une agitation constante.
- Après 24 heures, le produit de la réaction PLGA-b-PEG copolymère bloc est précipité en ajoutant du méthanol solution de lavage en excès. Répétez le processus de lavage et de centrifugation comme mentionné ci-dessus à trois reprises. Cela permettra d'éliminer tous les excès de PEG n'ayant pas réagi.
- Le copolymère PLGA-b-PEG bloc est séché sous vide.
2. La préparation de nanoparticules PLGA-b-PEG
Les nanoparticules avec un noyau recouvert de PLGA PEG à la surface peuvent être préparés avec ces copolymères diblocs. Une variété de différents médicaments hydrophobes peuvent être encapsulés dans des nanoparticules telles. Composés fluorescents peuvent être encapsulés dans des nanoparticules ou peuvent être conjugués à PLGA et donc ces nanoparticules peuvent être utilisés pour l'imagerie de fluorescence.
Méthode nanoprécipitation est utilisé pour faire des nanoparticules en particulier lorsque la cargaison souhaitée à encapsuler est hautement hydrophobe dans la nature.
- Le PLGA-b-PEG copolymère bloc et que le médicament / cargaison (à encapsuler) sont dissous dans un solvant qui dissout PLGA. PLGA peut être dissous par de nombreux solvants communs, y compris l'acétonitrile, le DCM, le tétrahydrofuranne, l'acétone ou l'acétate d'éthyle. Le choix du solvant est critique, car elle influe sur les propriétés des nanoparticules. Ainsi, un solvant approprié doit être utilisé dans cette étape.
- Le mélange polymère / médicament est ensuite ajouté goutte à goutte à 3-5 volumes d'eau en remuant pour obtenir une concentration polymère final d'environ 3 mg / mL. (Fig. 2)
- L'agitation est poursuivie pendant 2 heures sous pression réduite pour permettre à des nanoparticules pour former par auto-assemblage et d'éliminer les traces de solvant organique.
- La récolte et la purification: Les nanoparticules sont ensuite concentrées par centrifugation à 2700 x g pendant 10 min en utilisant un filtre Amicon (20 kDa MWCO), lavé, et reconstitué dans du PBS. Cela supprime toutes les marchandises non-piégé de drogue /. Base caractérisations biophysiques, comme la taille, la charge de surface, et l'efficacité de chargement de drogue peuvent être effectuées pour mieux comprendre les propriétés des nanoparticules.
3. Stockage
La lyophilisation est un procédé couramment utilisé pour stocker des nanoparticules 11. La lyophilisation préserve les caractéristiques physiques et chimiques des nanoparticules pour la stabilité à long terme 12. Le procédé de lyophilisation peut causer du stress sur les particules et de déstabiliser la formulation, afin de cryo-protecteurs (protection contre le stress de congélation) et Lyo-protecteurs (protection contre le stress de séchage) sont couramment utilisés. Le choix de ces protecteurs est déterminée par la longueur désirée de 13 temps de stockage.
- Dans la lyophilisation, il ya la solidification totale de l'échantillon par le gel en dessous de sa Tg.
- Dans l'étape de séchage, la glace est éliminée par sublimation. La température et la pression doit être optimisé pour atteindre une efficacité lyophilisation.
4. Les résultats représentatifs:
Caractérisation de PLGA-b-PEG Di-copolymère bloc
Différentes techniques peuvent être utilisées pour confirmer la conjugaison réussie de polymères. La composition de PLGA-b-PEG peut être caractérisée en utilisant un 400 MHz 1H résonance magnétique nucléaire (RMN). Poids moléculaire du produit formé (PLGA-b-PEG) peut être vérifiée par chromatographie sur gel perméable (GPC). Le PLGA-b - PEG de poids moléculaire Distributiocourbe de n et le temps d'élution doit être différent de PLGA et PEG seul. En combinaison, ces techniques devraient caractériser le produit formé et déterminer si la réaction de conjugaison a été couronnée de succès.
Caractérisation de PLGA-b-PEG nanoparticules
La taille des particules et la distribution de la taille peut être mesurée par diffusion de lumière dynamique. Différents paramètres dans le processus de nanoprécipitation affecter la taille des particules. Les masses moléculaires des polymères utilisés initialement (à la fois PLGA et PEG) a également l'effet de la distribution granulométrique. Microscopie électronique à la transition (TEM) peut également être utilisé pour confirmer la distribution de la taille et la structure des nanoparticules comme on le voit dans la figure 3. La granulométrie est généralement dans la gamme nm. Grandes tailles de particules avec une distribution de taille inégale peut indiquer soit une erreur dans la réaction de conjugaison ou de la méthode nanoprécipitation besoins d'optimisation. De plus, la surface de potentiel zêta peut être mesuré par ZetaPALS.
L'efficacité du chargement de drogue / fret peut être quantifiée avec HPLC standard.
Les particules sont dissoutes dans un solvant organique et par HPLC peuvent être effectuées pour mesurer l'absorbance de la drogue / fret (fig. 4). L'étude cinétique de libération du médicament peut être fait quand elle est connue des quantités fixes de nanoparticules sont dialysées dans 30 Slide-A-Lyzer unités de dialyse MINI. A intervalles de temps fixe, le contenu de l'unité de dialyse sont collectées et un volume égal de solvant organique est ajouté pour dissoudre les nanoparticules. HPLC est effectuée sur ces échantillons pour quantifier la teneur en médicament / fret.
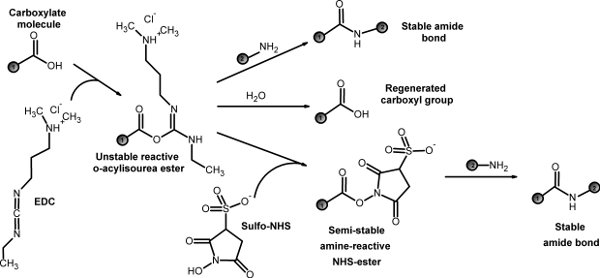
Figure 1. EDC / NHS chimie
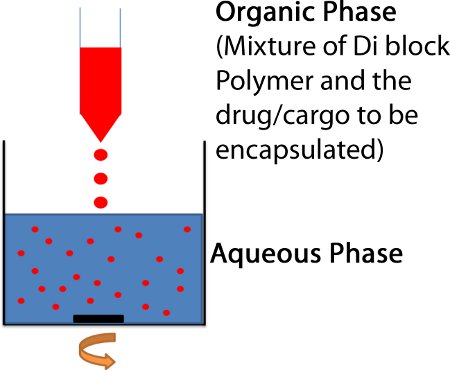
Figure 2. Méthode nanoprécipitation pour préparer des nanoparticules polymériques. La solution organique d'un solvant (acétonitrile ou DCM) contenant le dibloc PEG-PLGA et de la drogue ou des marchandises à charger dans la particule est ajoutée goutte à goutte à 3-5 ml d'agitation H 2 O.

Figure 3. Transmission Electron Microscopy des nanopartices. Une image TEM de PEG-PLGA nanoparticules contenant wortamin. L'acide phosphotungstique a été utilisé comme agent de contraste.
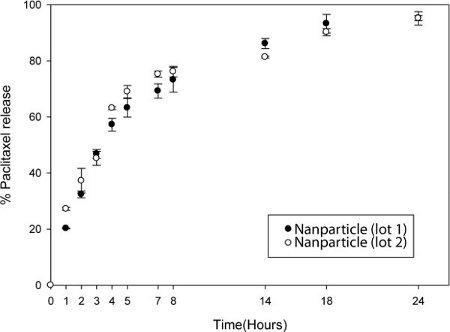
Figure 4. La libération contrôlée de médicament à partir de nanoparticules. Libération de paclitaxel à partir de nanoparticules après la dialyse dans du PBS. Au moment indiqué, les particules ont été retirés de cassettes de dialyse et solubilisé dans l'acétonitrile. La solution a été mesurée par HPLC. Deux lots distincts de nanoparticules ont été comparés.
Discussion
La méthode utilisant nanoprécipitation diblocs co-polymères représente une méthode simple et rapide aux ingénieurs des nanoparticules polymériques. Les nanoparticules obtenues sont composées d'un noyau hydrophobe qui peut être utilisé pour la livraison de composés peu solubles. La couche de surface hydrophile permet une excellente solubilité aqueuse tout en fournissant un motif pour la conjugaison potentielle supplémentaire à un ligand de ciblage.
Il ya des plates-formes de...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été financé par des golfeurs contre le cancer, en Caroline du Centre de nanotechnologie excellence pilote de subvention, l'Université Cancer Research Fund et l'Institut national de la santé K-12 Prix du développement de carrière.
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs | Société | Numéro de catalogue | Commentaires |
| EDC | Thermo Scientific | 22980 | Réactif Conjugaison |
| NHS | Thermo Scientific | 24500 | Réactif Conjugaison |
| amine-PEG-carboxylate | Laysan Bio Inc | NH2-PEG-CM-5000 | Polymère (Peut utiliser n'importe MW PEG, 5000 est indiqué ici) |
| PLGA-carbxylate | Lactel | B6013-2 | Polymères |
| Le dichlorométhane (DCM) | Sigma-Aldrich | 34856 | Solvant |
| Acétonitrile pureté> 99% | Sigma-Aldrich | 34851 | Solvant |
| Méthanol pureté> 99% | Sigma-Aldrich | 34860 | Laver |
Références
- Drotleffa, S., Lungwitz, U., Breuniga, M., Dennis, A., Blunk, T., Tessmarc, J., Goëpferich, A. Biomimetic polymers in pharmaceutical and biomedical sciences. European Journal of Pharmaceutics and Biopharmaceutics. 58, 385-407 (2004).
- Bulte, J. W. M. . Nanoparticles in Biomedical Imaging. 3, (2008).
- Omid, C., Farokhzad, R. L. Impact of Nanotechnology on Drug Delivery. ACS NANO. 3, 16-20 (2009).
- Li, Y. -. P., Pei, Y. -. Y., Xian-Ying, Z., Zhou-Hui, G., Zhao-Hui, Z., Wei-Fang, Y., Jian-Jun, Z., Jian-Hua, Z., Xiu-Jian, G. PEGylated PLGA nanoparticles as protein carriers: synthesis, preparation and biodistribution in rats. Journal of Controlled Release. 71, 203-211 (2011).
- Hermanson, G. T. . Bioconjugate techniques. , (2008).
- Jeong, B., Bae, Y. H., Lee, D. S., Kim, S. W. Biodegradable block copolymers as injectable drug-delivery systems. Nature. 388, 860-862 (1997).
- Yoo, H. S., Park, T. G. Folate receptor targeted biodegradable polymeric doxorubicin micelles. Journal of Controlled Release. 96, 273-283 (2004).
- Cheng, J., Teply, B. A., Sherifi, I., Sung, J., Luther, G., Gu, F. X., Levy-Nissenbaum, E., Radovic-Moreno, A. F., Langer, R., Farokhzad, O. C. Formulation of Functionalized PLGA-PEG Nanoparticles for In Vivo Targeted Drug Delivery. Biomaterials. 28, 869-876 (2007).
- Gu, F., Zhang, L. F., Teply, B. A., Mann, N., Wang, A., Radovic-Moreno, A. F., Langer, R., Farokhzad, O. C. Precise engineering of targeted nanoparticles by using self-assembled biointegrated block copolymers. Proceedings of the National Academy of Science. 105, 2586-2591 (2008).
- Sanna, V., Pintus, G., Roggio, A. M., Punzoni, A., Posadino, A. M., Arca, A., Marceddu, S., Bandiera, P., Uzzau, S., Sechi, M. Targeted Biocompatible Nanoparticles for the Delivery of (-)-Epigallocatechin 3-Gallate to Prostate Cancer Cells. J. Med. Chem. 54, 1321-1332 (2011).
- Abdelwahed, W., Degobert, G., Stainmesse, S., Fessi, H. Freeze-drying of nanoparticles: Formulation, process and storage considerations. Advanced Drug Delivery Reviews. 58, 1688-1713 (2006).
- Holzer, M., Vogel, V., Mäntele, W., Schwartz, D., Haase, W., Langer, K. Physico-chemical characterisation of PLGA nanoparticles after freeze-drying and storage. European Journal of Pharmaceutics and Biopharmaceutics. 72, 428-437 (2009).
- Lee, M. K., Kim, M. Y., Kim, S., Lee, J. Cryoprotectants for Freeze Drying of Drug Nano-Suspensions: Effect of Freezing Rate. Journal of Pharmaceutical Sciences. 98, 4808-4817 (2009).
- Wang, A. Z. Biofunctionalized targeted nanoparticles for therapeutic applications. Expert opinion on biological therapy. 8, 1063-1070 (2008).
- Jeong, B., Bae, Y. H., Kim, S. W. Drug release from biodegradable injectable thermosensitive hydrogel of PEG-PLGA-PEG triblock copolymers. J. Control Release. 63, 155-163 (2000).
- Gref, R. Biodegradable long-circulating polymeric nanospheres. Science. 263, 1600-1603 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon