Method Article
Implantation intracrânienne avec 3D ultérieures In Vivo Bioluminescent imagerie des gliomes murin
Dans cet article
Résumé
L'implantation intracrânienne d'GL261 cellules en souris C57BL / 6 produit gliomes malins qui récapitulent plusieurs des caractéristiques de glioblastome humain. Nous avons utilisé des cellules exprimant de façon stable GL261 luciférase pour nous permettre d'utiliser In vivo Imagerie pour suivre la progression tumorale. La chirurgie et la 3D In vivo Imagerie sont démontrés.
Résumé
La souris gliome 261 (GL261) est reconnu comme un système modèle in vivo qui récapitule plusieurs des caractéristiques du glioblastome humain (GBM). La lignée cellulaire a été initialement provoquée par l'injection intracrânienne de 3-méthyl-cholantrene dans un C57BL / 6 souche de souris syngéniques 1; donc immunologiquement compétentes souris C57BL / 6 peut être utilisé. Bien que nous utilisions GL261, le protocole suivant peut être utilisé pour l'implantation et le suivi de tous les modèles tumoraux de souris intracrânienne. GL261 cellules ont été conçues pour exprimer de façon stable la luciférase de luciole (GL261-Luc). Nous avons également créé le plus lumineux de ligne GL261-luc2 cellule par transfection stable du gène exprimé luc2 du promoteur CMV. Souris C57BL/6-cBrd/cBrd/Cr (variante albinos de C57BL / 6) de l'Institut national du cancer, Frederick, MD ont été utilisés pour éliminer le atténuation de la lumière causée par la peau noire et la fourrure. Avec l'utilisation de C57BL albinos / 6 souris; l'imagerie in vivo en utilisant le spectre IVIS in vivo imle vieillissement du système est possible à partir du jour de l'implantation (Caliper Life Sciences, Hopkinton, MA). Le GL261-Luc et GL261-luc2 lignées cellulaires ont montré le même comportement in vivo que le GL261 parentale cellules. Certaines des caractéristiques histologiques partagé présent dans GBM humain et ce modèle de souris comprennent: nécrose tumorale, pseudopalisades, néovascularisation, une invasion, une hypercellularité et l'inflammation 1.
Avant l'implantation d'animaux ont été anesthésiés par une injection intrapéritonéale de kétamine (50 mg / kg), la xylazine (5 mg / kg) et la buprénorphine (0,05 mg / kg), placé dans un appareil de stéréotaxie et une incision a été faite avec un bistouri au cours de la ligne médiane du crâne. Un burrhole postérieure a été faite à l'0.1mm 2.3mm bregma et à droite de la ligne médiane. Une aiguille est insérée à une profondeur de 0,4 mm 3mm et retiré à une profondeur de 2,6 mm. Deux ul du GL261-Luc ou GL261-luc2 cellules (10 7 cellules / ml) ont été perfusés au cours de 3 minutes. Le burrhole a été ferméavec bonewax et l'incision a été suturée.
Après l'implantation stéréotaxique les cellules bioluminescentes sont détectables à partir du jour de l'implantation et la tumeur peut être analysée en utilisant la fonction image 3D de reconstruction de l'instrument Spectrum IVIS. Les animaux reçoivent une injection sous-cutanée de 150μg luciférine / kg de poids corporel 20 min avant l'imagerie. Charge tumorale est quantifiée en utilisant la bioluminescence tumorale moyenne au cours du temps. Souris porteuses de tumeurs ont été observés quotidiennement pour évaluer la morbidité et ont été euthanasiés lorsque un ou plusieurs des symptômes suivants sont présents: la léthargie, incapacité à déambuler, une posture voûtée, non marié, l'anorexie entraîne une perte> 10% du poids. Les tumeurs ont été évident dans tous les animaux présents sur l'autopsie.
Protocole
1. Culture Cellulaire
- La ligne GL26 cellulaire a été obtenue de la Division du traitement du cancer et du diagnostic (DCTD) du National Cancer Institute (NCI), Frederick, MD. Afin de faciliter une mesure quantitative de la croissance des tumeurs taux GL261 cellules ont été faites en utilisant les bioluminescents Lentiphos HT System (Clontech Laboratories, Inc, Mountain View, CA) avec le mélange Lenti-X HT Emballage (Clontech Laboratories, Inc) et le FUW- GL plasmide (un don généreux du laboratoire de JB Rubin, MD, PhD). Les cellules ont été maintenues dans du milieu Eagle modifié par Dulbecco (DMEM) avec 10% de tétracycline sans sérum de veau foetal (FCS; Clontech Laboratories, Inc.) GL261 cellules ont également été transfectées de façon stable avec le gène codant luc2 utilisant le pGL4.51 [luc2 / CMV / Neo] conditions vecteur (Promega Corp, Madison, WI) et le réactif de transfection FuGENE 6 (Roche Applied Science, Indianapolis, IN) à la suite précisé par le fabricant. Le gène est une version luc2 codon optimisé de luciole luciferasoi qui permet une production significativement supérieure de lumière que le gène standard de Luc. Transfectants stables ont été sélectionnés et maintenus dans les médias DMEM contenant 10% de SVF et 100 pg / ml de généticine (G418, Invitrogen Corp, Carlsbad, CA).
- Avant l'implantation des cellules cultivées sont récoltées par trypsinzation, lavé une fois dans du DMEM sans sérum et remises en suspension dans du DMEM sans sérum à une concentration de 1 x 10 7 cellules / ml.
2. Configuration chirurgie 2
- Un environnement stérile est maintenu pendant toute la chirurgie, y compris tous les instruments chirurgicaux, des fournitures, des gants, des rideaux, etc.
- Dix semaines C57BL/6-cBrd/cBrd/Cr ancienne (albinos C57BL / 6) souris sont achetés auprès de l'Institut national du cancer au Programme Frédéric Production animale et utilisés à un poids moyen de 20 grammes (NCI, Frederick, Maryland).
- Les animaux sont anesthésiés par injection intrapéritonéale de xylazine (5 mg / kg), la kétamine (50 mg / kg) et la buprénorphine (0,05 mg / kg). Pourpincée de e est fait pour s'assurer que l'animal est anesthésié convenablement avant la chirurgie est commencé. Mouvement (même si léger) de toute partie de l'animal est une indication d'une réduction du niveau de l'anesthésie. Animal est immédiatement donné un supplément de 3,3 mg / kg de xylazine et de 26,6 mg / kg de kétamine. La température corporelle est maintenue à l'aide d'une lampe et pansements stériles couvrant le corps.
- Une fois que l'animal est correctement anesthésié, ils sont placés sur le lit rembourrée du chevalement stéréotaxique (modèle 900 petits animaux stéréotaxique, David Kopf Instruments) [figure 1].
- Une petite quantité (1 / 4 pouce) d'AKWA larmes Onguent lubrifiant ophtalmique est appliqué sur la cornée.
- L'animal est garanti dans le cadre stéréotaxique en ouvrant la bouche de l'animal (en plaçant votre index et votre pouce autour de la mâchoire de l'animal) et en glissant les dents de devant en haut dans l'échancrure dans le cadre stéréotaxique. La pince est serrée pour sécuriser la tête de l'animal dans l'oreillette en s'assurant que ee la tête est alignée et les yeux sont centrés, en veillant toutefois à ne pas exercer une force excessive sur la tête de l'animal.
- Le tuyau d'O 2 est enregistrée bas près des narines de l'animal. Débit d'oxygène est de 0,5 l / min.
- Le bas du dos et la queue est enregistrée dans le lit de stéréotaxie en faisant attention de ne pas compromettre respirations.
- Le site de l'incision chirurgicale est rasée. Bâtons Swab Povidine-iode sont utilisés pour laver la zone entre les yeux revenir à la zone entre les oreilles avec de l'iode, en veillant à l'iode ne coule pas dans les yeux de l'animal.
- Les cellules sont préparées pour l'implantation, juste avant la chirurgie et sont périodiquement mélangés afin de s'assurer qu'ils ne sont pas réglées.
- Une ul 10, 50 instruments de précision mm mondiale (WPI), Sarasota, Floride, seringue avec une aiguille de calibre 26 biseauté est chargé avec l'inoculum cellulaire. Si les cellules semblent être groupées, il peut être nécessaire de recharger la seringue.
- La seringue de 10 ul est ensuite placé dans l'Ultram UMP3-1icroPump micro injecteur (WPI, Sarasota, Floride).
3. Implantation intracrânienne 2
- L'incision cutanée est faite en utilisant une taille de 15 lame de scalpel et pince à griffes. Une incision est faite de 10-15 mm longitudinalement d'entre les yeux de l'animal, se déplaçant vers les oreilles de l'animal exposer le bregma (jonction des sutures sagittale et coronale au sommet du crâne). Soyez sûr de bien identifier le bregma car il peut être facilement confondue avec la zone des sinus qui est distale au bregma [Figure 2].
- Après que l'animal est sous sédatif il reçoit une injection intra-cicatricielle de 0,25% (2,5 mg / ml) bupivacaïne.
- Un burrhole est fait 0,1 mm en arrière bregma et 2,3 mm à droite de la ligne médiane par lentement tordre un calibre 16 de 1 ½ pouce par l'aiguille main, appliquant une pression peu à l'aiguille tout en tordant jusqu'à ce que le crâne est pénétré et le cerveau est exposé.
- L'aiguille de la seringue est déplacée vers le bas en position en utilisant la Ste microdriveporte-seringue reotactic jusqu'à ce qu'il touche la surface du cerveau. De cette position, l'aiguille est avancé dans le cerveau à une profondeur de 3 mm et maintenu en place pendant 3 minutes.
- L'aiguille est retirée 0,4 mm à une profondeur totale de 2,6 mm en dessous de la surface du cerveau, créant une petite poche où les cellules sont à perfuser. Elle est facultative à ce stade de prendre une image aux rayons X de l'aiguille dans l'animal pour assurer le placement et à la profondeur.
- La suspension cellulaire est infusé plus de 3 minutes en utilisant l'injecteur micro fixé à un volume de 2000 NL (2 ul) avec un taux de perfusion de 667 nL / minute.
- L'aiguille est laissée en place pendant 2 minutes pour éviter les fuites du site de perfusion.
- L'aiguille est lentement retirée complètement.
- Le burrhole est rempli avec de la cire d'os à l'aide d'un dissecteur Penfield.
- L'incision est suturée avec un 4-0 (1,5 métrique) vicryl de suture en s'assurant qu'aucun des écarts importants sont laissés dans la peau. Vicryl est un matériel de suture qui se dissolvents, et donc les sutures n'ont pas besoin d'être retiré lorsque l'incision est guérie.
- Après la chirurgie, les animaux sont placés dans une cage sous une lampe chauffante qui est fixé à la hauteur requise pour réchauffer la surface du fond de la cage à 30 ° C. Lorsque les animaux sont tout à fait réveillé (à en juger par le mouvement normal dans la cage), ils sont retournés à l'hébergement en groupe. L'ibuprofène par voie orale est ajouté à leur eau potable pendant 5 jours post-opératoire. 100 mg d'ibuprofène pour enfants (100mg/5ml) est ajouté à une norme 473 ml bouteille d'eau contre les rongeurs. Les animaux sont observés quotidiennement et imagés et pesés tous les 3 jours. Deux semaines après l'implantation d'observation est passée à deux fois par jour. Les animaux sont euthanasiés quand ils montrent des signes de déclin de la santé qui comprend une posture voûtée, une mobilité réduite et visible perte de poids (≥ 20%). Ces symptômes sont une réponse publiée à la tumeur et ils apparaissent de manière reproductible d'environ un jour avant le décès dû à la tumeur.
4. In vivo 3
- Démarrez le [Image Vivre] logiciel.
- Le système d'imagerie IVIS est initialisée en cliquant sur le [Initialiser IVIS Système] bouton sur le côté inférieur droit du panneau de contrôle.
- Sélectionnez [luminescents] Imagerie mode sur le côté supérieur gauche du panneau de contrôle.
- Pour déterminer le moment optimal de l'imagerie après l'injection luciférine une étude cinétique est nécessaire [Figure 3]. Cette description est pour la luciférase de luciole;
- Injecter 10 ul de poids corporel / g de D-luciférine de luciole (15mg/ml dans du PBS; Caliper Life Sciences Catalogue XR-1001 ou un produit similaire d'un autre fournisseur) dans l'animal, tel que décrit ci-dessous.
- Attendre 3 minutes, puis anesthésier la souris en la plaçant dans la chambre de l'anesthésie au gaz (2% de gaz isoflurane en O 2).
- Eteignez l'anesthésie gazeuse à la chambre et ouvrir la vanne d'anesthésie et le vide à la tubulure IVIS. Immédiatement placer l'animal sous sédationsur la plateforme d'imagerie à température contrôlée, en veillant à la narine de la souris est correctement placé dans le collecteur d'anesthésie gazeuse. La première image doit être pris environ 5 minutes après l'injection luciférine. Jusqu'à 5 animaux peuvent être visualisés en une seule fois dans l'instrument Spectrum IVIS. Si moins de 5 animaux sont à imager, il est possible de brancher le collecteur inutilisées (s) à conserver sur le gaz isoflurane.
- Continuer à prendre des images toutes les 3 minutes, en créant une séquence allant jusqu'à une heure pour générer une courbe cinétique d'expression luciférine.
- Cliquez sur [Setup Séquence] bouton dans le panneau de contrôle.
- L'éditeur de séquence apparaît.
- Dans le panneau de commande, de spécifier les paramètres de la première image bioluminescente dans la séquence.
- Nous recommandons de commencer avec Binning Medium.
- Nous recommandons également d'auto-exposition afin de déterminer le temps d'exposition optimal.
- Sélectionnez le bouton [Delay] dans l'éditeur de séquence d'unND spécifier un délai de 3 minutes entre chaque acquisition.
- Cliquez sur [Ajouter] dans l'éditeur de séquence. Les paramètres d'acquisition sont ensuite ajoutés à la table.
- Répétez l'étape 4 pour chaque image de la séquence.
- Une fois la courbe est établie, l'imagerie en temps optimal peut être déterminé en traçant la force du signal (intensité) en fonction du temps. Animaux d'image au moment de la plus haute photons in vivo comptent pour obtenir le signal le plus fort et le plus précis.
- Les premières expériences utilisées intrapéritonéale (IP) d'injection de luciférine, cependant, des injections ip occasionnellement conduit à des résultats intermittents montrant peu ou pas de la bioluminescence dans la tumeur. Nous émettons l'hypothèse que le manque occasionnel aléatoire du signal était dû à la livraison de la luciférine à l'intestin ou d'autres organes internes. Nous avons donc commencé à utiliser sous-cutanée (sc) luciférine injections et j'ai vu une plus grande reproductibilité d'imagerie [Figure 3].
- Vingtminutes après l'injection SC, les animaux sont anesthésiés en les plaçant dans une chambre à gaz isoflurane 2% de O 2 jusqu'à ce qu'ils soient insensibles.
- L'animal anesthésié (s) sont déplacés vers la chambre de l'imagerie. Pommade ophtalmique doit être utilisée pour l'étude cinétique en raison de la longueur de l'imagerie. Il n'est pas nécessaire pour les procédures d'imagerie autres parce qu'ils sont de courte durée.
- L'image est acquise au binning moyenne avec un temps d'exposition de 5 minutes. L'option d'acquisition automatique peut également être utilisé.
- Si le signal est saturé et / ou faible au binning moyenne, le temps d'exposition ou de binning peut être ajustée.
- Les fichiers de programme et de commentaires d'images subséquentes sont enregistrées dans le répertoire de l'ordinateur de l'utilisateur.
5. Imagerie 3D 3
- Cliquez sur l'onglet [Imaging Wizard] dans le [Setup Séquence] fenêtre du panneau de contrôle.
- Sélectionnez [bioluminescence] mode d'imagerie sur l'écran d'imagerie assistant de démarrage et click [Suivant].
- Dans la "bioluminescence - DLit« fenêtre de l'assistant d'imagerie, sélectionnez la sonde [Luciole] journaliste. L'émission / d'excitation du spectre Firefly source sélectionnée apparaît avec les six sélections de filtres correspondants à acquérir.
- Le dernier écran apparaîtra avec les choix par défaut qui incluent des paramètres d'exposition automatique de l'acquisition et un champ de paramètres par défaut de C fonctionnent très bien, mais ces paramètres peuvent être modifiés si nécessaire.
- Cliquez sur [Next] et la fenêtre de l'éditeur de séquence sera peuplé de la séquence de six régions spectrales à 20 nm filtres de large (560 nm, 580 nm, 600 nm, 620 nm, 640 nm, et 660 nm). Appuyez sur [Acquérir Séquence]. Le premier filtre (560 nm) comprendra un modèle de lumière structurée à l'aide d'un galvanomètre au laser pour établir la topographie de surface.
- Sélectionnez [Topographie de la surface] onglet dans la palette d'outils. Lissage de surface peuvent être appliqués pour tenir compte des angles vifs créé pendant le processus de reconstruction. L'lissage par défaut faible est recommandée.
- Cliquez sur [Créer] et la boîte d'analyse de tomographie apparaîtra. Dessinez une boîte de culture qui comprend tout l'animal, puis cliquez sur [Suivant].
- L'outil de seuil apparaît comme un masque violet sur la région sélectionnée. Le masque doit être automatiquement réglé pour correspondre à la photo de l'animal. Si nécessaire, ajuster le seuil du masque de manière plus appropriée forme le contour de l'animal.
- Cliquez sur [Terminer] et le maillage reconstruit apparaîtra. La reconstruction peut alors être sauvegardé dans l'onglet Résultats.
- Après la création de la topographie de la surface de l'animal, procéder à la [DLit Reconstruction 3D] déroulant sur la palette d'outils.
- Sous l'[Analyser] onglet sélectionner tous six longueurs d'onde pour effectuer la reconstruction. Décochez les images qui ont donné pixels saturés ou des comptages en dessous de 600. Laisser les réglages dans [Paramètres] onglet par défaut.
- Dans l'onglet [Propriétés], "Muscle" devrait être répertorié comme le choix par défaut pourles propriétés des tissus r, et "Firefly" devrait être répertorié comme le spectre de source.
- Cliquez sur [Reconstruire] sous l'onglet Analyser, et la reconstruction 3D de la surface de l'animal et la reconstruction correspondant de la source du signal devrait apparaître [Figure 4].
- Pour déterminer l'emplacement et l'intensité du signal, sélectionnez le bouton Voxels sur l'onglet 3D Outils de la palette d'outils.
- Dessinez un carré autour de tous les voxels affichés et les mesures du flux total est indiqué dans le bas de l'onglet volume.
- Cliquez sur [Centre de la messe] pour identifier l'emplacement du signal des voxels sélectionnés. Coronale, sagittale et transaxiale tranches de l'animal apparaîtra et en utilisant le [Curseur Affichage Mesure] la distance de la surface de l'animal au centre de voxel peut être mesurée.
- S'il vous plaît se référer au manuel de l'utilisateur du logiciel Living image pour de plus amples informations sur le co-enregistrement des atlas d'orgue et d'autres fonctionnalités avancées.
6. Une des donnéesnalyse 3
- Après l'image est acquise et enregistrée, l'accès au fichier du programme en cliquant sur le bouton [Parcourir] et sélectionner le fichier.
- Les informations de l'image peut être trouvé sous [Affichage] → [Informations sur l'image].
- L'intensité du signal peut être quantifié en sélectionnant la région d'intérêt (ROI) [ROI Outils] bouton. Assurez-vous que l'image est analysée dans le mode [Photon] en sélectionnant "Photon" sur la liste déroulante dans le coin supérieur gauche du panneau de contrôle de l'image.
- Sélectionnez le bouton [Mesure ROI] dans le "Type" dans la liste déroulante. Sélectionnez la forme ROI d'intérêt, les options incluent Cercle, Carré, et ou la grille. Couvrir tous les domaines de l'intensité sur l'image acquise.
- La position ROI est fixé en faisant glisser la sélection de forme ROI à la région contenant le signal de bioluminescence.
- L'intensité du signal du retour sur investissement est calculé en cliquant sur le [Mesure] bouton. L'étiquette affiche le ROI de l'intensité. ROI peuvent être gérés et enregistrés USIng le logiciel vivante image.
7. Les résultats représentatifs:
L'implantation des cellules réussite est évidente lorsque les cellules implantées sont détectables en utilisant le spectre IVIS le jour de la chirurgie. Les deux GL261-Luc et GL261-luc2 cellules sont détectables, toutefois, le gène luc2 fournira un niveau supérieur de la bioluminescence [Figure 5]. Images prises peu après l'implantation peut avoir non spécifiques de signalisation sur les pattes de l'animal et le nez qui devrait être ignorée comme fond. Signal situé sur le site d'implantation est réelle et le signal va augmenter avec le temps [Figure 6]. La baisse de l'intensité du signal sur 6 jours est reproductible et très probablement due à la perte de la tumeur par certains de prendre des cellules implantées. Les mesures quantitatives de la charge tumorale sont reproductibles en ce sens qu'ils devraient augmenter régulièrement jusqu'en l'animal succombe finalement à la maladie. Toutefois, les courbes de croissance dépendra en grande partie sur l'état des cellules implantées, et ou inévitable var mineure RESPONSABILITÉ dans la procédure d'implantation. Notre laboratoire a élu à l'image des animaux implantés tous les trois jours.
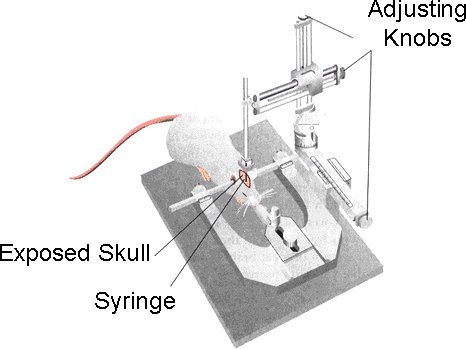
Figure 1. Après la souris est correctement anesthésié, il est placé dans le cadre stéréotaxique. La tête de la souris est sécurisé en utilisant la pince la bouche.

Figure 2. Après la peau est ouverte les principaux sites anatomiques sont identifiés, y compris notamment le bregma, les sutures coronale et sagittale. Le burrhole est 2.3mm à droite de l'bregma par lentement tordre un calibre 16 de 1 ½ pouce avec l'aiguille une petite quantité de pression jusqu'à ce que le crâne est percé et le cerveau est exposé.
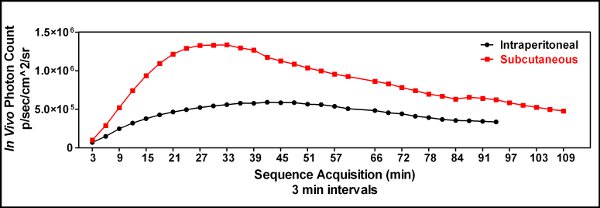
Figure 3. Une comparaison des cinétiques sous-cutanée (iles/ftp_upload/3403/3403fig3_1.jpg "alt =" Figure3.1 "/>) par rapport intrapéritonéale (  ) Luciférine injection a été effectuée pour démontrer l'utilité d'une injection sous-cutanée luciférine et d'identifier le moment optimal de l'image luciférine après l'administration. Trois minutes après la luciférine a été injecté la souris a été mis sous sédation, placé dans l'instrument Spectrum IVIS et imagé toutes les 3 minutes jusqu'à une heure et toutes les 6 minutes après que de générer une courbe cinétique de bioluminescence. Cela a démontré que la voie sous-cutanée de luciférine administration était supérieure à une injection intrapéritonéale dans nos mains, et que le moment optimal pour l'image de l'animal était d'environ 25 minutes suivant l'injection luciférine lors GL261-Luc cellules ont été utilisées.
) Luciférine injection a été effectuée pour démontrer l'utilité d'une injection sous-cutanée luciférine et d'identifier le moment optimal de l'image luciférine après l'administration. Trois minutes après la luciférine a été injecté la souris a été mis sous sédation, placé dans l'instrument Spectrum IVIS et imagé toutes les 3 minutes jusqu'à une heure et toutes les 6 minutes après que de générer une courbe cinétique de bioluminescence. Cela a démontré que la voie sous-cutanée de luciférine administration était supérieure à une injection intrapéritonéale dans nos mains, et que le moment optimal pour l'image de l'animal était d'environ 25 minutes suivant l'injection luciférine lors GL261-Luc cellules ont été utilisées.
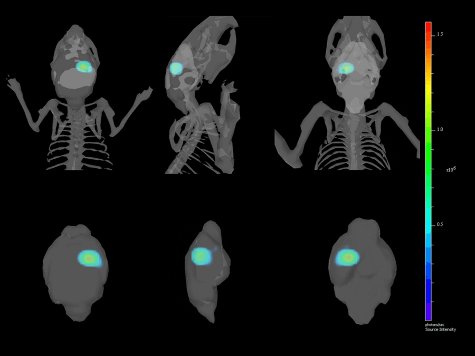
Figure 4 vues. Multiples d'un Reconst 3-Dimensionalruction de l'implantation intracrânienne d'GL261-luc2 cellules co-enregistrées avec le squelette de la souris et le cerveau.
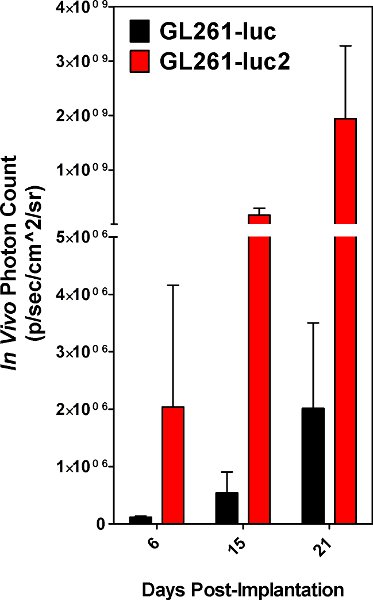
Figure 5. Compte Photon obtenus à partir de tumeurs résultant de Luc-GL261 GL261 vs cellules-cellules luc2. Les résultats sont une moyenne de 5 animaux.

Figure 6. Graphique des GL261-Luc croissance des cellules tumorales dans un albinos C57BL / 6 de la souris. La bioluminescence a été mesurée tous les 3 jours et tracés en photons in vivo comptent comparativement jours post-implantation. Les photographies montrent la bioluminescence à divers moments. La coloration est une indication de la bioluminescence (intensité d'un pixel) qui est relatif au nombre de cellules tumorales (barre de couleur est affichée à droite). Après que l'animal a succombé à la maladie du cerveau a été disséqué et la luciférine a été ajouté par voie topique pour obtenir l'IMAG ex vivoe le montre la figure en médaillon.
Discussion
L'inoculum cellulaire est perfusée à une profondeur de 2,6 mm de la surface du cerveau après la création d'une poche de 0,4 mm. Pour assurer un placement correct et la profondeur de l'aiguille d'une radiographie peut être prise à l'aide d'un C-Arm ou autre dispositif de l'image aux rayons X s'intensifie, mais ceci est optionnel. Les complications de la chirurgie peuvent survenir si l'animal n'est pas correctement sous sédation, à quel point l'animal peut se déplacer pendant la perfusion de cellules. Cela peut provoquer une fuite de mélange de cellules ou des saignements de trajet de l'aiguille. Fuite des cellules provoque une croissance ectopique de cellules tumorales. Il est également important de ne pas percer le ventricule qui peut être fait si le burrhole est fait en dedans de la 2,3 mm décrite dans le protocole 4. Placement correct de la propagation de seringues et de cellules a été testé en infusant une souris avec deux colorants méthylène ul bleu et la dissection du tissu cérébral pour vérifier l'emplacement du colorant infusé.
Dans ce protocole, nous avons utilisé le spectre IVIS l'imagerie in vivo du système et tIl Living logiciel Image (v 4.0) conçu pour une utilisation avec cet instrument. (Caliper Life Sciences). Toute comparables dans le système d'imagerie in vivo et des outils d'analyse d'image peut être utilisée pour obtenir des résultats similaires. Ces systèmes fournissent certains avantages sur l'imagerie par résonance magnétique classique (IRM) pour suivre la croissance d'une tumeur intracrânienne expérimentale. Le plus évident est le coût relatif des deux instruments - machines animales IRM sont beaucoup plus chers et nécessitent généralement des services d'un technicien qualifié IRM. L'imagerie in vivo, comme ce qui était décrit ici peut être fait par l'utilisateur final. Les données quantitatives bioluminescence est, tandis que la quantification des données de l'IRM prend beaucoup de temps et quelque peu inexacte. Par ailleurs, les images IRM montrent un œdème et l'inflammation, en plus de cellules tumorales et il peut être difficile de séparer la tumeur de l'effet du traitement. Pour ces raisons, l'obtention de mesures précises de la tumeur en pleine croissance volumétrique peut être un défi. La bioluminescence nécessite de l'ATP, Donc que les cellules tumorales de vie contribuent à la taille de la tumeur de données. Malgré cela, il ya certains avantages à l'IRM si une machine est disponible. Les cellules n'ont pas à être marqué avec un marqueur bioluminescent être visualisés par IRM. La capacité à visualiser péri-tumoral oedème peut être un avantage pour certains protocoles expérimentaux. A force de ces deux technologies est que l'aide l'un n'empêche pas l'utilisation de l'autre, afin que les données peuvent être obtenus sur la croissance de la tumeur ainsi que la présence de zones péri-tumorale œdème et l'inflammation du même animal, lorsque les deux technologies sont disponibles pour le chercheur.
Déclarations de divulgation
Accès gratuit à cet article est sponsorisé par Caliper Life Sciences.
Remerciements
Nous tenons à remercier le Dr Joshua B. Rubin pour le don généreux de plasmides pour le système de lentivirus ainsi que Mahil Rao pour suggestion utile à la préparation des cellules GL261-Luc.
Nous remercions les étudiants Soutien recherche sur les tumeurs cérébrales (SSBTR), Barrow Neurological La Fondation et la Fondation Wallace pour leur généreux soutien.
Expériences sur les animaux ont été effectuées en conformité avec les directives et les règlements énoncés par le soin des animaux et du Comité institutionnel utilisation de l'Hôpital St. Joseph et Medical Center.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif ou de la fourniture | Société | Numéro de catalogue | Commentaires |
| GL261-luc2 Bioware Ultra | Caliper Life Sciences | GL261-luc2 | |
| Eagle modifié par Dulbecco (DMEM) | Invitrogen | 10313039 | |
| Généticine (G418) | Gibco (Invitrogen) | 11811-023 | |
| Sérum de veau fœtal (SVF) | Invitrogen | 26140079 | |
| Phosphate saline tamponnée (PBS) | Invitrogen | 70011044 | |
| Souris C57BL/6-cBrd/cBrd/Cr | NCI-Frederick | ||
| AKWA larmes onguent ophtalmique Lubrifiant | Akorn Inc | 17478-062-35 | |
| Ketaset (chlorhydrate de kétamine) | Wyeth | 11570775 | |
| Sedazine (chlorhydrate de xylazine) | Wyeth | 10031894 | |
| Petit instrument stéréotaxique animaux | Kopf Instruments | 900 | |
| UltraMicroPump par SYS-Micro4 Controller | Instruments de précision du monde | UMP3-1 | S'il n'est pas disponible, il est possible d'insuffler manuellement |
| Seringue avec 10 ul de calibre 26 biseautés aiguille | Instruments de précision du monde | SGE010RNS | |
| Adison forceps | Instruments de précision du monde | 500092 | |
| Penfield Dissecteur | Codman | 65-1015 | |
| 16g 1 ½ Précision Glide aiguille | Beckton, Dickinson and Company (BD) | 305198 | |
| Poignée lame chirurgicale | BD | 371030 | |
| Taille 15 Lame | BD | 371315 | |
| 4-0 suture Vicryl | Ethicon | VCP496G | |
| La cire d'os | Medline | DYNJBW25 | |
| Bâtons Swab Povidine-iode | Medline | MD93901 | |
| Sel de potassium D-luciférine | Caliper Life Sciences | 122796 | |
| Forane (isoflurane) | Baxter | 1001936060 | |
| OPMI Pentero Microscope | Carl Zeiss, Inc | Toute microscope chirurgical suffira | |
| Xenogen IVIS spectre avec un système d'anesthésie option | Caliper Life Sciences |
Références
- Candolfi, M. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 85, 133-148 (2007).
- Stafford, P., Abdelwahab, M. G., do, K. i. m., Preul, Y., Rho, M. C., M, J., Scheck, A. C. The ketogenic diet reverses gene expression patterns and redudes reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab. 7, (2010).
- Caliper Life Sciences, Inc. . Living Image Software Version 4.0. VivoVision Systems. , (2010).
- Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Jouanneau, E., Poujol, D., Gulia, S., Le, M. I., Blay, J. Y., Belin, M. F. Dendritic cells are essential for priming but inefficient for boosting antitumour immune response in an orthotopic murine glioma model. Cancer Immunol Immunother. 55, 254-267 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon