Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Inactivation génique médiée par ARNi et
Dans cet article
Résumé
Dans ce protocole, nous combinons silencing RNAi-médiée avec un gène In vivo pour étudier l'effet de choc effets de gènes d'intérêt a sur l'excrétion de liquide moustiques.
Résumé
Ce protocole vidéo montre une technique efficace pour effet de choc d'un gène particulier dans un insecte et de mener un essai biologique roman pour mesurer le taux d'excrétion. Cette méthode peut être utilisée pour obtenir une meilleure compréhension du processus de la diurèse chez les insectes et est particulièrement utile dans l'étude de la diurèse dans le sang d'alimentation arthropodes qui sont en mesure de prendre d'énormes quantités de liquide dans un repas de sang unique.
Cette inactivation génique médiée par ARNi combiné avec un test in vivo diurèse a été développé par le laboratoire Hansen pour étudier les effets de l'ARNi à médiation knockdown de gènes d'aquaporines sur moustique Aedes aegypti diurèse 1.
Le protocole est configuré en deux parties: la première démonstration illustre comment construire un dispositif simple moustique injection et comment préparer et injecter ARNdb dans le thorax de moustiques pour inactivation génique médiée par ARNi. La deuxième démonstration illustre comment déterminerles taux d'excrétion chez les moustiques en utilisant un dosage biologique in vivo.
Protocole
Partie I - inactivation génique médiée par ARNi dans les moustiques adultes, Aedes aegypti. Pour un aperçu expérience voir la figure 1.
1. Synthèse ARNdb
- Synthétiser ARNdb spécifiques contre les gènes de ARNdb d'intérêt et de contrôle. Remarque: Nous recommandons amorces développement pour les fragments PCR de l'ordre de 300 à 500 paires de bases situées à l'extrémité 3 'de la 2 ADNc spécifique et avec la séquence d'amorce T7 attaché à l'extrémité 5' (5'-TAA TAC GAC TCA CTA TAG GG-3 '). Unicité des fragments doivent être confirmés par l'analyse BLASTN 3.
- Utilisez le Ambion Megascript T7 Kit Haut Rendement de transcription (Ambion, la table des réactifs) qui utilise la T7 RNA polymérase pour la réaction de transcription de synthétiser ARNdb. Remarque: réactifs et des kits similaires sont disponibles nulle part ailleurs.
- Pour purifier ARNdb, précipiter avec du chlorure de lithium suivant les instructions fournies avec le kit Megascript.
- Après purificatd'ions, dissoudre le culot ARNdb dans l'eau stérile. Afin d'assurer une viscosité adéquate pour la microinjection, la concentration ARNdb ne doit pas dépasser 2 g / ul.
2. Préparation à l'injection
- Un simple micro injecteur peut être construit en utilisant des tubes, des ciseaux, une aiguille en métal, une seringue de 1 ml, 1 ml et un embout de pipette en plastique (voir figure 2). Le tube doit être coupé à environ 40 cm de longueur. Alternativement, un système automatisé micro injecteur peut être utilisé comme Drummond Nanojet II 4.
- Couper l'extrémité de la seringue (moyeu de l'aiguille) à 2 ml graduation et de supprimer la tête de piston en caoutchouc du plongeur.
- Percer un trou à l'aide d'une aiguille métallique dans la tête piston en caoutchouc et le lieu de la tête en caoutchouc piston dans le moyeu de l'aiguille.
- Placez le moyeu de l'aiguille à une extrémité du tube et placer un embout 1 ml en plastique de la pipette dans l'autre extrémité, qui sera utilisé comme pièce d'embouchure (alternativement, un 10 ml syringe peut être utilisé pour produire la pression de l'air nécessaire pour l'injection).
- Placer une aiguille capillaire en verre dans le trou dans le piston en caoutchouc tête et briser la pointe de l'aiguille hors de sorte que la largeur est suffisamment grand pour le liquide à s'écouler à travers. Remarque: La taille optimale de la pointe de l'aiguille doit être déterminé de manière empirique - si la largeur de l'aiguille est trop grosse cela se traduira par un traumatisme et un taux élevé de mortalité des moustiques, si la largeur de l'aiguille est trop petite, il sera impossible de pénétrer l'exosquelette des moustiques.
- Submerger l'aiguille d'injection dans l'échantillon préparé ARNdb et aspirer l'échantillon liquide dans l'aiguille d'injection en aspirant le liquide avec la pièce de bouche (ou une seringue). Remarque: Cette étape est identique pour tous les réactifs liquides qui sont injectés dans les moustiques, y compris du tampon PBS, qui est utilisé dans le test in vivo dans le protocole diurèse (voir ci-dessous).
3. Recueillir et Anesthésier moustiques
- Collecmoustiques t avec un aspirateur à piles dans un flacon de collecte. Placer un bouchon sur le flacon de collecte et de placer le flacon sur une CO 2 tampon propre à anesthésier les moustiques. Remarque: vous pouvez les moustiques peuvent être anesthésiés sur la glace.
4. Injection Mosquito
- Ouvrez le flacon de collecte et de placer les moustiques directement sur le CO 2 pad et attendre jusqu'à ce que les moustiques sont anesthésiés.
- Jeter tous les hommes.
- Alignez les moustiques sur le côté pour permettre un accès plus facile pour l'injection.
- Prenez les moustiques par les jambes ou les ailes pour éviter les blessures. Vous pouvez également utiliser un pinceau fin ou de la plume de manipuler les moustiques.
- Lorsque vous êtes prêt à injecter le moustique d'abord, doucement soutenir d'un côté du thorax avec des pinces et insérez la pointe de l'aiguille de l'autre côté du thorax (Figure 2). Il est préférable d'injecter dans une partie fine de la cuticule et éviter de pousser l'aiguille ào profondément dans le thorax.
- Une fois que l'aiguille est en place, faire sauter le liquide dans le moustique. La quantité désirée peut être déterminée en contrôlant le ménisque du liquide dans l'aiguille. Le nombre de millimètres nécessaires pour un volume spécifique peut être déterminée en calculant le volume du cylindre de l'aiguille capillaire en verre (πr 2 h). La quantité efficace d'ARNdb qui est généralement utilisé pour l'injection est de 1 mg.
- Une fois que le liquide est injecté dans des moustiques, soigneusement retirer l'aiguille. Si quelques grandes formes de gouttelettes liquides à l'extérieur du thorax, le moustique doit être jeté. Ensuite, répéter ce processus avec le prochain moustique.
5. Récupération Mosquito et le stockage
- Après l'injection, placez les moustiques dans un conteneur pour le stockage. Par exemple, une cire pinte bordée tasses en carton (tasses à soupe) d'un filet de recouvrement fixé avec le couvercle en carton. Le couvercle comporte une partie découpée pour le maillage couvrant d'être exposés. Une fois tous les moissquitoes sont placés dans le conteneur, placez le récipient dans une chambre à environnement contrôlé pour l'incubation et de fournir les moustiques avec une source de nourriture, tels que des billes de saccharose 20% coton imbibés placés au-dessus du revêtement en maille. Avant d'effectuer le dosage in vivo la diurèse, priver les moustiques ARNdb injecté d'une source d'eau pendant 12 heures pour normaliser l'état d'hydratation de chaque moustique.
- L'efficacité de inactivation génique ARNdb médiation peut être variable. Gene silencing pourrait commencer un jour après l'injection et cela pourrait durer jusqu'à 6 jours après l'injection 4. Le moment optimal pour atteindre inactivation génique maximale doit être déterminée empiriquement pour chaque gène utilisé. En général, nous attendre 3 jours après l'injection ARNdb avant que nous procédions.
Partie II - En test in vivo chez l'adulte diurèse moustiques du genre Aedes aegypti
Remarque: Ce protocole a été développé par les auteurs etutilisé pour l'ARNi à médiation knockdown de protéines aquaporines dans le moustique de la fièvre jaune Aedes aegypti 1. Pour éviter la variabilité entre les moustiques individuels, les moustiques devraient être analysées dans les groupes. Pour des raisons techniques, nous vous recommandons des groupes de 5 moustiques par traitement - il ya une quantité limitée de temps pour effectuer la mesure du poids d'abord avant de commencer à excréter les moustiques d'urine après l'injection.
6. Recueillir et Anesthésier moustiques
- Avant la collecte des moustiques, enregistrer le poids d'un flacon de prélèvement vide avec un bouchon en utilisant une balance de précision analytique. Ce flacon sera utilisé pour toutes les mesures ultérieures.
- Collecter 5 moustiques femelles dans le flacon de collecte pesé avec un aspirateur. Placez le capuchon sur le flacon de collecte et laissez-le reposer sur le CO 2 pad pendant plusieurs secondes pour anesthésier les moustiques.
7. Mesure du poids initial
- Prenez til la mesure du poids initial des 5 moustiques en plaçant le flacon collection contenant les moustiques avec le couvercle sur la balance de précision.
- Calculer le poids du groupe de 5 moustiques en prenant le poids des moustiques et le flacon de collecte avec bouchon et en soustrayant le poids du flacon avec bouchon collection vide.
- Ouvrir le flacon de collecte et de placer les moustiques directement sur le coussin de CO 2 après l'enregistrement des poids des moustiques. Si les moustiques commencent à se réveiller pendant les mesures de poids, mettre le flacon sur le CO 2 pad pendant plusieurs secondes avant de l'ouvrir et en plaçant les moustiques sur le pavé.
8. Préparation à l'injection
- Mettre en place l'injecteur micro en suivant les instructions données dans le protocole ARNi médiée par des gènes knockdown.
- Placer une aiguille capillaire en verre dans l'injecteur micro et briser la pointe de l'aiguille de sorte que la largeur est assez grand pour LIQuid de s'écouler à travers.
- Immerger l'aiguille dans du tampon PBS et d'en tirer la mémoire tampon dans l'aiguille d'injection, la quantité désirée à utiliser pour ce protocole est de 1,25 l de PBS pour chaque moustique. Remarque: Ce montant imite le montant moyen du plasma sanguin qui est repris par un moustique femelle 5.
9. Injection Mosquito
- Alignez les moustiques afin de permettre un accès plus facile avec l'injecteur micro.
- Une fois que l'aiguille est en place, sauter tampon PBS dans le moustique.
- Une fois que le liquide est injecté dans le moustique, une gouttelette peut former à l'extérieur du thorax. Cette gouttelette doit être soigneusement enlevé avant l'étape suivante.
- Répétez ce processus d'injection avec le prochain moustique. Avec l'expérience, le taux de survie des moustiques sera près de 100% après l'injection.
10. Les moustiques de pesage
- Après l'injection, placez doucement les moustiques dans le flacon de collecteet le bouchon. Prendre la mesure du poids d'abord les 5 moustiques en plaçant le flacon collection contenant les moustiques avec le couvercle sur la balance de précision.
- Calculer le poids du groupe de 5 moustiques en prenant le poids des moustiques et le flacon de collecte avec bouchon et soustraire le poids du flacon avec bouchon collection vide. Remarque: les moustiques commencent à excréter l'urine dans les 2 minutes après le retrait du CO 2 pad anesthésie, il est donc important de prendre la mesure du poids avant qu'ils ne commencent à excréter.
- Placez les moustiques dans un petit récipient où ils commencent à excréter l'urine.
11. Mesures deuxième poids et la suite
Remarque: Les mesures de poids des moustiques doivent être prises à intervalles de 30 minutes, mais cela peut être ajusté à intervalles plus courts ou plus selon les taux d'excrétion.
- Après 30 minutes, recueillir le Group 5 moustiques avec un aspirateur dans le flacon même collection, avec bouchon. Prendre la mesure du poids à côté des moustiques en plaçant le flacon collection contenant les moustiques avec le couvercle sur la balance de précision.
- Après la mesure, placez les moustiques dans le conteneur même exploitation pour les 30 prochaines minutes.
- Répétez cette procédure pour un montant de temps désirée.
12. Détermination Taux d'excrétion Mosquito
- La quantité totale de liquide qui a été injecté dans le groupe de 5 moustiques peut être calculée en soustrayant le poids initial des moustiques du poids immédiatement après l'injection.
- La quantité d'urine qui a été éliminée par le groupe de moustiques à un moment spécifique peut être calculée en soustrayant le poids initial des moustiques de la masse des moustiques au point de temps spécifique.
- Le taux d'excrétion à un moment spécifique peut être calculée par divisionding la quantité d'urine excrétée à ce point de temps de la quantité totale de liquide injecté (Tableau 1).
13. Les résultats représentatifs
ARNi médiée par inactivation génique et en test in vivo la diurèse ont été utilisés par le laboratoire Hansen pour étudier les effets de aquaporines dans moustique Aedes aegypti diurèse. Trois aquaporines qui sont exprimées dans les tubules de Malpighi Aedes aegypti ont été renversés avec des effets significatifs sur les taux d'excrétion par rapport à lutter contre les moustiques 1. La figure 4 montre des résultats représentatifs d'une expérience où le dosage a une diurèse été utilisée pour comparer les taux d'excrétion entre Aedes aegypti et Culex quinquefasciatus à des températures différentes.
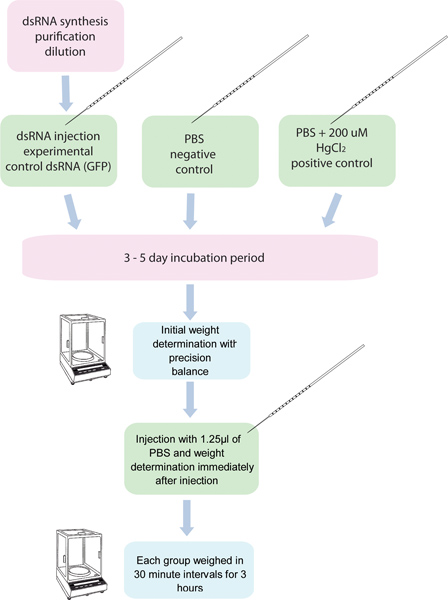
Figure 1. Organigramme de l'essai ARNi / diurèse. 5 groupes de 10 moustiques each sont injectés avec ARNdb pour un gène spécifique, et cinq autres groupes de dix moustiques sont injectés avec un contrôle ARNdb. Un autre groupe de moustiques injectés avec 200 uM dans du PBS HgCl 2 est utilisé comme contrôle positif. Ces moustiques sont pesés avant l'injection, et après l'injection dans les trente minutes d'intervalle pendant 3 heures.
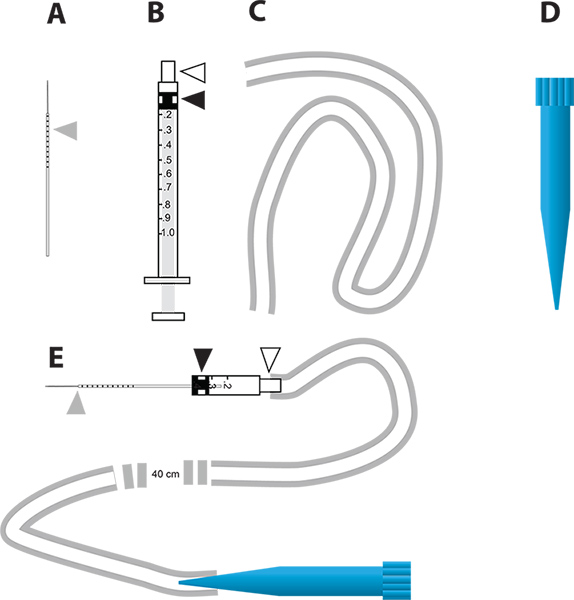
Figure 2. Un dispositif d'injection simple micro pour la inactivation génique médiée par ARNi et test in vivo la diurèse. A. Les aiguilles de verre capillaires utilisés pour l'injection. Le triangle gris représente les incréments millimétriques tirés sur l'aiguille pour indiquer la quantité de liquide injecté dans le moustique. B. 1 seringue ml utilisée pour construire l'injecteur micro. Le triangle blanc représente le moyeu d'aiguille et le triangle noir représente la tête du piston en caoutchouc fixé sur le piston dans la seringue. C. Le tube utilisé pour fixer l'embout buccal pourl'injecteur. D. 1 ml embout jetable de pipette (pointe bleue) qui est utilisé comme porte-parole de l'appareil micro-injection. E. Le dispositif de micro-injection qui intègre des parties AD. Cliquez ici pour agrandir la figure .
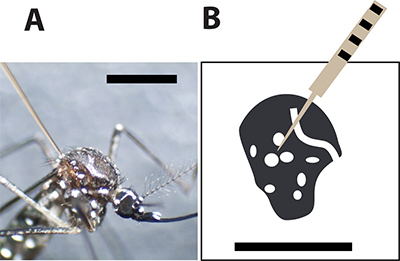
Figure 3. Optimale au site d'injection moustiques. A. Femme moustique Aedes aegypti injecté avec une aiguille capillaire en verre entre les grandes échelles sur le thorax. La barre noire indique 1 mm pour comparaison de taille. B. Un dessin du thorax moustique femelle et les taches blanches représentent les écailles blanches dans l'exosquelette des moustiques. L'aiguille d'injection doit percer le moustique entre les taches afin de minimiser le taux de mortalité lors de l'injection.
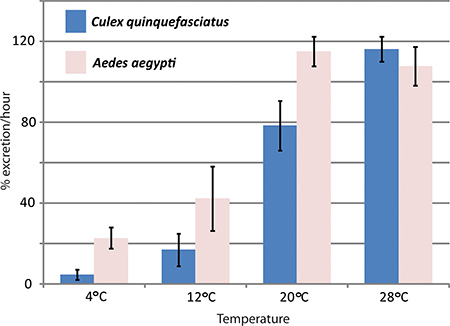
Figure 4. Effets de la températureture sur Culex quinquefasciatus et Aedes aegypti diurèse. Le test a été réalisé avec la diurèse deux espèces de moustiques, Aedes aegypti et Culex quinquefasciatus, à différentes températures. Le taux d'excrétion au cours de la première heure après l'injection est donnée en pour cent.
| Groupe | TARA (G) | ne pas injecter (G) | après l'injection (G) | 1h après l'injection (G) | poids moyen (mg) | quantité injectée (Pl) | quantité excrétée (Pl) | % Excrété |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2.6 | 1,02 | 0,34 | 33,3 |
Tableau 1. Aedes aegypti dans les résultats in vivo de dosage Diurèse. Les données brutes provenant de la diurèse dans le test in vivo réalisées avec les moustiques Aedes aegypti femelles à 4 ° C.
Discussion
Le protocole utilisé ARNi a été développé dans le laboratoire d'Alexandre Raikhel à l'Université de Californie Riverside 6,7 et est semblable à un protocole publié par Garver et Dimopoulos 4. L'approche expérimentale montré dans ce protocole vidéo peut être utilisée pour étudier les gènes impliqués dans la diurèse des insectes dans un cadre en vivo. Les organes excréteurs des insectes, les tubes de Malpighi, ont attiré l'intérêt des générations de ch...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Les auteurs tiennent à remercier Victoria Carpenter pour ses commentaires critiques de ce protocole.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif ou de l'équipement | Entreprise | Numéro de catalogue | Commentaires |
| MEGAscript T7 Kit High Yield | Ambion, Inc | AM1334 | |
| Tampon PBS | Sigma-Aldrich | P4417 | |
| Tubes en plastique | Fournisseur local | PVC | |
| 1 ml en plastique pointe de pipette | VWR | 83007-376 | Embout bleu |
| Seringue de 1 ml | Becton, Dickinson and Company | 309602 | |
| Ciseaux | Fournisseur local | ||
| Aiguille métallique | Caroline Biologicals | 654307 | Taille 5 |
| Fly pad | Genesee scientifique | 789060 | |
| Alimenté par batterie aspirateur w / collection flacon | Labs UPMA | IPMM 2000 | |
| Pince pointe fine | Instruments de précision du monde | 14095 | |
| Aiguilles capillaires en verre pour | Instruments de précision du monde | 1B200-6 | |
| Microscope à dissection stéréo | Leica Microsystems | S6D | |
| Balance de précision analytique | Mettler Toledo | AB54S | |
| Saccharose | Sigma-Aldrich | 84097 | |
| Un demi-litre ciré tasses en carton doublés | Fournisseur local | Tasses à soupe Fabricant | |
| Filet à mailles | Fournisseur local | gaze mouche en plastique |
Références
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon