Method Article
Livraison de gènes et transfection de cellules humaines de cancer du pancréas en utilisant facteur de croissance épidermique ciblant les récepteurs des base de gélatine nanovecteurs Conçu
Dans cet article
Résumé
Type B à base de gélatine système machiné nanovecteurs (SREG) a été développé pour la livraison de gènes systémiques et la transfection dans le traitement du cancer du pancréas. Par modification des récepteurs du facteur de croissance épidermique (EGFR) peptide spécifique sur la surface de nanparticles, ils pourraient cibler le récepteur EGFR et la libération plasmide sous réduisant l'environnement, tels que de fortes concentrations de glutathion intracellulaire.
Résumé
Plus de 32.000 patients sont diagnostiqués avec un cancer du pancréas aux Etats-Unis par an et la maladie est associée à une mortalité très élevée 1. Il est urgent de développer de nouvelles cliniquement traduisible stratégies thérapeutiques qui peuvent améliorer les statistiques de survie lamentable des malades du cancer du pancréas. Bien que la thérapie génique dans le cancer a montré une énorme promesse, le défi majeur réside dans le développement du système de prestation sûre et efficace, qui peut conduire à l'expression du transgène soutenue.
La gélatine est un des biopolymères les plus polyvalents naturelles, largement utilisé dans les produits alimentaires et pharmaceutiques. Des études antérieures de notre laboratoire ont montré que gélatine de type B pourrait physiques encapsuler l'ADN, qui a conservé la structure superenroulé de l'efficacité de la transfection plasmidique et amélioré lors de la livraison intracellulaire. Par thiolation de gélatine, les groupes sulfhydryle pourraient être introduits dans le polymère et serait fpont disulfure ORM au sein de nanoparticules, ce qui stabilise la liaison disulfure ensemble complexe et une fois est rompu en raison de la présence de glutathion dans le cytosol, la charge utile serait libéré 2-5. Poly (éthylène glycol) (PEG) modifiés SREG, lorsqu'il est administré dans la circulation systémique, permet la circulation à long temps et cible préférentiellement à la masse tumorale en raison de l'hyper-perméabilité de la néovascularisation de la perméabilité accrue et 6 effet de rétention. Des études ont montré une sur-expression du récepteur du facteur de croissance épidermique (EGFR) sur Panc-1 des cellules d'adénocarcinome du pancréas 7. Afin de cibler activement lignée cellulaire du cancer du pancréas, l'EGFR a été conjugué peptidique spécifique sur la surface de la particule par une entretoise PEG 8.
La plupart des thérapies géniques anti-tumorale sont axés sur l'administration des gènes suppresseurs de tumeurs, tels que p53 sauvage (WT-p53), pour restaurer la fonction pro-apoptotique dans les cellules 9 10. Dans le cancer du pancréas, la plupart des cellules ont des mutations dans la protéine p53, causant la perte d'activité apoptotique. Avec l'introduction des poids-p53, l'apoptose pourrait être réparé et déclenche la mort cellulaire dans d'autres 11 cellules cancéreuses.
Basé sur le raisonnement ci-dessus, nous avons conçu EGFR peptide modifié thiolé nanoparticules de gélatine pour la livraison du gène p53 et poids-efficacité de la prestation évaluée et la transfection de cellules Panc-1.
Protocole
1. Préparation d'ADN plasmidique encapsulé EGFR ciblées nanoparticules de gélatine
- Synthèse de la gélatine thiolé
- Thiolées la gélatine ont été synthétisés comme méthode précédente 2-5, par la conjugaison covalente avec 2-sur iminothiolane groupes amino primaires de type B de la gélatine. 1 gramme de gélatine a été dissous dans 100 ml d'eau déminéralisée et incubés avec 20 mg de chlorhydrate de 2-iminothiolane à température ambiante pendant 15 heures.
- Réactif n'ayant pas réagi a été éliminé par dialyse contre une solution d'HCl 5 mM, suivie par HCl 1 mM solution pendant 3 heures chacune. Purifié thiolé gélatine a été lyophilisé et stocké à 4 ° C pour une utilisation ultérieure.
- Préparation de l'ADN contenant des nanoparticules
- 200 mg de gélatine thiolé a été dissous dans l'eau et le pH de la solution a été ajusté à 7 par addition de NaOH 0,2 M solution. L'ADN a été ajouté 1mg et doucement mélangée avec une solution de gélatine.
- Éthanol glacée a été ajoutée lentement dans le mélange toutsolution sous agitation à grande vitesse. Les nanoparticules ont été formés lorsque la composition du solvant changé à 75% solution hydro-alcoolique.
- Les nanoparticules ont ensuite été réticulé par addition lente de 0,1 ml de solution de glyoxal 8% (v / v). Réactifs n'ayant pas réagi ont été trempé avec 0,5 ml de solution 0,2 M de glycine.
- Les nanoparticules ont été ultra-centrifugé à 16000 rpm pendant 30 minutes. Culots ont été lavés avec de l'eau déminéralisée à deux reprises et nanoparticules purifiés ont été lyophilisés et conservés à 4 ° C.
- Modification de surface des nanoparticules
- Les nanoparticules ont été suspendues en tampon phosphate 0,1 M (pH 7,4) avec une concentration de 10 mg / ml et incubée avec 2 fois le poids de méthoxy-PEG-succinimidyl ester méthylique carboxy (MPEG-SCM, MW 2000 Da) ou maléimide-PEG-succinimidyle carboxy méthylique (MAL-PEG-SCM, MW 2000 Da) pendant 2 heures à température ambiante sous agitation lente.
- Nanoparticules pégylé ont été recueillies avec l'ultra-centrifugation à 16000 rpm pour 30 minutess. Culots ont été lavés avec de l'eau déminéralisée à deux reprises et nanoparticules purifiés ont été lyophilisés et conservés à 4 ° C.
- MAL-PEG-SCM nanoparticules modifiées ont été suspendues en tampon phosphate 0,1 M (pH 6,5) avec une concentration de 10mg/ml et incubées avec 10% du poids de l'EGFR peptide spécifique (YHWYGYTPQNVI-GGGGC) pendant 6 heures à température ambiante sous agitation lente.
- Peptide nanoparticules modifiées ont été recueillies avec l'ultra-centrifugation à 16000 rpm pendant 30 minutes. Culots ont été lavés avec de l'eau déminéralisée à deux reprises et nanoparticules purifiés ont été lyophilisés et conservés à 4 ° C.
2. Caractérisation des nanoparticules ciblées EGFR
- La taille des particules et la mesure du potentiel zêta
Les nanoparticules ont été suspendus dans l'eau avec la concentration de 1mg/ml. La suspension a été analysée à l'aide du Zetasizer Nano (Malvern Inc.) L'analyse granulométrique a été effectuée à un angle de diffusion de 90 degrés à 25 °C. Zeta potentiel a été mesurée à des paramètres par défaut de la constante diélectrique, indice de réfraction et de la viscosité de l'eau à 25 ° C. - Microscopie électronique à balayage
Nanoparticules lyophilisées ont été montés sur la montagne de l'échantillon d'aluminium et de pulvérisation revêtu de palladium afin d'améliorer la conductivité et de minimiser l'accumulation de charges. Les échantillons ont été observés pour la morphologie de surface sous un champ d'émission Hitachi 4800 microscope électronique à balayage à 3 kV. - Spectroscope à électrons pour analyse chimique (ESCA)
Lyophilisés formulation de contrôle, et le peptide pégylé nanoparticules modifiées ont été analysés par ESCA. Elle a été réalisée à l'ESCA nationale et Centre d'analyse de surface pour les problèmes biomédicaux (NESAC / BIO), Université de Washington (Seattle, WA).- Les échantillons ont été placés sous ultravide et exposés à basse énergie faisceau de rayons X, ce qui induit une émission de photoélectrons secondaires de la surface.
- En traçant le nombre d'électrons détectés en fonction de la poubelleDing énergie, pics du spectre observées ont été assignés à chacun des composants chimiques.
- L'analyse haute résolution des spectres C1s a été réalisée pour déterminer la composition chimique exacte d'hydrocarbures (CC ou CH à 285mV), l'éther (CO) à 286.4mV) et carbonyle (C = O à 288,1 mV), et la composition relative de chaque fonctionnalité a été déterminée par l'aire sous la courbe.
- Stabilité du plasmide encapsulé
La stabilité de l'ADN plasmidique a été confirmé encapsulé en exécutant l'ADN extrait des préfabriqué gels. Les nanoparticules ont été digérés avec 0,2 mg / ml de protéase contenant du PBS (30 min à 37 ° C) et 0,2 U / ml DNAse (10min à température ambiante) séparément, simultanément ou successivement. Les échantillons ont ensuite été chargées sur gel d'agarose 1,2% (GP) (E-Gel, Invitrogen, CA) à une concentration de 100ng/well dans un volume 18μL par puits. Plasmidique nu a été chargé en tant que contrôle et de gel a été exécuté à 75 V pendant 30 minutes. Kodak Digital rayons X de l'échantillon (DXS) Le système a été utilisé pour visualiser bands avec transluminescence UV. - Détermination de chargement plasmidique
Plasmidique nanoparticules encapsulées ont été suspendues à 1mg/ml et digérée par la protéase 0.2mg/ml à 37 ° C pendant 30 minutes. Solution a été centrifugée à 13000 rpm pendant 10 minutes et le surnageant a été prélevé et testé pour la concentration de plasmide avec Picogreen dosage (Invitrogen). Ratio d'encapsulation a été calculée en divisant la concentration encapsulée plasmide avec le chargement initial de 0,5% (p / p).
3. Dans des études de transfection in vitro au Panc-1 cellules cancéreuses du pancréas
- Conditions de culture cellulaire
Panc-1 et Capan-1 lignes du pancréas adénocarcinome à cellules, lignée de cellules ovariennes SKOV3 adénocarcinome et NIH-3T3 lignée murine de cellules fibroblastes ont été obtenus auprès de l'ATCC. Panc-1 et NIH-3T3 ont été cultivées avec du DMEM fourni avec la L-glutamine, Pen-strep et 10% de sérum de veau fœtal à 37 ° C et 5% de CO 2, tandis que Capan-1 nécessaire DMEM fourni 20% de sérum de veau fœtal.SKOV3 a été cultivé dans du RPMI-1640 livrée avec 10% de sérum de veau foetal. - L'analyse Western blot pour expression de l'EGFR
- Lysats cellulaires ont été recueillies auprès de 2 millions de cellules et analysés pour la concentration totale de protéines en utilisant dosage BCA (Pierce). NIH-3T3 a été utilisé comme contrôle négatif et SKOV3 a été utilisé comme contrôle positif pour l'expression d'EGFR.
- 10 ug d'extrait protéique total a été exécuté sur préfabriqués sodium dodécyl sulfate-polyacrylamide gel électrophorèse (SDS-PAGE) système à 135V pendant 90 minutes.
- Par la suite, le gel a été transféré sur une membrane PVDF par iBlot Système buvard sec (Invitrogen).
- Membrane a été bloquée avec 5% de lait écrémé dans du Tween contenant une solution saline de tampon Tris (TBS-T) pendant 1 heure à température ambiante.
- Membrane a été coupé et incubées avec une dilution 1:1000 des primaires de lapin bêta-actine anticorps et la dilution de 1:1000 primaires anticorps anti-EGFR de lapin séparément pour la nuit à 4 ° C.
- Membrane est ensuite lavée deux fois avecTBS-T et incubées avec des dilutions de 1:2000 secondaire anti-lapin peroxydase de raifort conjugué d'IgG dans du TBS-T pour 1 heure à température ambiante.
- Après rinçage anticorps en excès avec du TBS-T et de l'eau, 4 ml ECL substrat (Pierce, Rockford, Illinois, Etats-Unis) a été ajoutée et incubée avec des membranes pendant 5 minutes.
- Bandes de chimioluminescence ont ensuite été visualisés à l'aide de Kodak Digital X-ray de l'échantillon (DXS) Système.
- Des études de viabilité cellulaire avec des formulations différentes
- Panc-1 des cellules ont été cultivées en plaques 96 puits à 10.000 cellules par puits dans 200 ul de DMEM complété durant la nuit.
- Le milieu de croissance a été remplacé par milieux exempts de sérum contenant différentes concentrations de nanoparticules avec 0, 0,5, 1, 2, 4, 6 mg / ml. 1mg/ml PEI, un cytotoxiques polymères cationiques connus, a été utilisé comme contrôle positif.
- Les cellules ont été traitées avec 200 pl nanoparticules pendant 6 heures puis remplacé par 20 pi de MTS réactif et 100 ul complètemilieux de culture.
- Après incubation post pendant 3 heures à 37 ° C dans 5% de CO 2, l'absorbance du produit formazan a été mesurée à 490 nm avec Biotek SynergyHT lecteur de plaque (Winooski, VT).
- La viabilité pour cent des cellules a été exprimé par le rapport de l'absorbance des cellules polymère traité par rapport au contrôle négatif (0mg/ml) multiplié par 100 et tracés en fonction des concentrations en polymère.
- Des études du trafic cellulaire
- Rhodamine B isothiocyanate (RBITC) a été utilisé pour conjuguer de gélatine thiolé par réaction avec le groupe amine. Après la dialyse et lyophilisation, RBITC étiquetés thiolé gélatine a été utilisé pour la préparation des nanoparticules.
- Avant de désolvatation, 25 pi PicoGreen a été mélangé avec 1 mg de plasmide pour 1 minute et plasmides marqués ont été ajoutés à une solution de gélatine. Différentes formulations ont été faites suivant la méthode précédente.
- Panc-1 des cellules ont été cultivées dans des plaques 6 puits contenant des lamelles de verre avec 200.000 cellules peuh bien. Après une croissance durant la nuit, 2ml de nanoparticules marquées ont été traités dans chaque puits avec une concentration de 1mg/ml en milieu sans sérum.
- Après différents temps, de 15 minutes à 6 heures, le milieu a été remplacé par du milieu de culture contenant de l'Hoest 1μg/ml 33342 (Invitrogen) pour 15 minutes d'incubation à température ambiante. 2 ml de solution de paraformaldéhyde à 4% a été remplacé dans chaque puits pour fixer les cellules. Les cellules ont ensuite été lavées avec du PBS deux fois.
- Coversilps étaient montés sur lames de verre. Microscopie confocale à balayage laser de fluorescence a été utilisé pour prendre des images de cellules fixées.
- Détermination qualitative d'efficacité de la transfection par microscopie à fluorescence avec pEGFP-N1 encapsulé nanoparticules
- pEGFP-N1 plasmides ont été encapsulés dans des nanoparticules en suspension dans du sérum médias libres avec une concentration équivalente à 10 pg par ml plasmides pour d'autres traitements.
- Panc-1 des cellules ont été cultivées pendant la nuit dans des plaques 6 puits ContaiNing verre lamelles avec 200.000 cellules par puits. 2ml de pEGFP-N1 nanoparticules encapsulées plasmides ont été traités dans chaque puits. 20 pg de plasmides ont été mélangés avec 20 pi Lipofectin, cationiques réactif de transfection des lipides, et il a été utilisé comme contrôle positif, tandis que les cellules non traitées ont été utilisées comme contrôle négatif.
- Les cellules ont été incubées avec des formulations différentes pour 6 heures.
- Medium a été remplacé par un milieu de culture et les cellules ont été post-transfectées pendant 24, 48, 72 et 96.
- Après post-transfection, le milieu a été remplacé par du milieu de culture contenant de l'Hoest 1μg/ml 33342 (Invitrogen) et incubées avec des cellules pendant 15 minutes à température ambiante.
- Lamelles ont été montées sur des lames de verre et d'expression de la GFP dans les cellules a été observé par microscopie à fluorescence. Contraste d'interférence différentiel (DIC) et des images de fluorescence Olympus BX61 acquis à l'aide du microscope et les images numériques ont été traitées avec le logiciel Image J.
- Détermination quantitative de l'efficacité de transfection par ELISA avec pEGFP-N1 encapsulé nanoparticules
- pEGFP-N1 plasmides ont été encapsulés dans des nanoparticules en suspension dans du sérum médias libres avec une concentration équivalente à 10 pg par ml plasmides pour d'autres traitements.
- Panc-1 des cellules ont été cultivées pendant la nuit dans des plaques 6 puits avec 200.000 cellules par puits. 2ml de pEGFP-N1 nanoparticules encapsulées plasmides ont été traités dans chaque puits. 20 pg de plasmides ont été mélangés avec 20 pi Lipofectin, cationiques réactif de transfection des lipides, ce qui a été utilisé comme contrôle positif et les cellules non traitées ont été utilisées comme contrôle négatif.
- Les cellules ont été incubées avec des formulations différentes pour 6 heures.
- Medium a été remplacé par un milieu de culture et les cellules ont été incubées pendant l'après-24, 48, 72 et 96.
- Après post-transfection, lysats cellulaires ont été recueillies auprès de chaque puits et analysés pour la concentration totale de protéines en utilisant dosage BCA (Pierce).
- plaque de puits a été coaTed avec 100 ul de 1:1000 dilutions d'anticorps monoclonaux anti-GFP anticorps dans chaque puits. Après une incubation de 2 heures, la plaque est lavée avec du PBS-0.5% (p / v) de Tween-80 pour 4 fois.
- 300μl tampons SCT bloquant ont été ajoutés dans chaque puits et incubés pendant 2 heures. Puis la plaque a ensuite été lavées avec du PBS-0.5% (p / v) de Tween-80 pour 4 fois.
- 30μg de protéines de chaque groupe ont été ajoutés dans la plaque et incubés une nuit à 4 °. Puis la plaque a ensuite été lavées avec du PBS-0.5% (p / v) de Tween-80 pour 4 fois.
- 100 pi de dilutions de 1:2400 secondaires anticorps anti-GFP par rapport à la phosphatase alcaline ont été ajoutés à chaque puits et incubés pendant 1 heure. Puis la plaque a ensuite été lavées avec du PBS-0.5% (p / v) de Tween-80 pour 4 fois.
- 100 ul substrats de phosphatase alcaline ont été ajoutés à chaque puits et incubés pendant 30 minutes à 1 heure. Plaque a été mesurée avec BioTek Synergy lecteur de plaque HT pour l'absorbance à 405nm.
- Concentration de la GFP exprimée a été signalé comme nanogrammes par kmlligrams des protéines totales.
- Détermination qualitative d'efficacité de la transfection par RT-PCR avec des poids-p53 plasmide nanoparticules encapsulées
- Poids-p53 plasmides ont été encapsulés dans des nanoparticules en suspension dans du sérum avec les médias libres concentration équivalente à 10 pg ml par plasmide pour d'autres traitements.
- Panc-1 des cellules ont été cultivées pendant la nuit dans des plaques 6 puits avec 200.000 cellules par puits. 2ml de poids-p53 plasmides nanoparticules encapsulées ont été traités dans chaque puits. 20 pg de plasmides ont été mélangés avec 20 pi Lipofectin, cationiques réactif de transfection des lipides, ce qui a été utilisé comme contrôle positif et les cellules non traitées ont été utilisées comme contrôle négatif.
- Les cellules ont été incubées avec des formulations différentes pour 6 heures.
- Medium a été remplacé par un milieu de culture et les cellules ont été post-incubées pendant 48 heures.
- ARNm ont été extraits de chaque puits en utilisant High Pure RNA kit d'isolement (Roche, Indianapolis, IN) et mesuré avec Nanodrop 2000 (Thermo scientifique, Wilminton DE, DE).
- RT-PCR a été réalisée en utilisant QIAGEN une étape de RT-PCR kit (Qiagen, Valencia, CA). Amorces pour la p53, Bax, Bcl-2, la bêta-actine, DR5, Apaf-1, PUMA, la survivine ont été synthétisés par la société Eurofins MWG Operon (Huntsville, AL).
- Les produits de PCR ont été évalués par électrophorèse sur gel et les pixels des bandes d'ADNc ont été analysés avec le logiciel ImageJ.
- La détermination quantitative de l'efficacité thérapeutique avec WT-p53 palsmid nanoparticules encapsulées
- Poids-p53 plasmide a été encapsulé dans des nanoparticules en suspension dans du sérum avec les médias libres concentration équivalente à 10 pg par ml plasmides pour un traitement ultérieur.
- Panc-1 des cellules ont été cultivées pendant la nuit dans des plaques 6 puits avec 200.000 cellules par puits. 2ml de poids-p53 plasmides nanoparticules encapsulées ont été traités dans chaque puits. 20 pg de plasmides ont été mélangés avec 20 pi Lipofectin, cationiques réactif de transfection des lipides, ce qui a été utilisé comme contrôle positif et les cellules non traitées ont étéutilisé comme contrôle négatif.
- Les cellules ont été incubées avec des formulations différentes pour 6 heures.
- Medium a été remplacé par un milieu de culture et les cellules ont été incubées pendant l'après-24, 48, 72 et 96.
- Condensation de la chromatine / Membrane de perméabilité / Dead Kit apoptose cellulaire (Invitrogen, Carlsbad, CA) a été utilisé pour marquer les cellules apoptotiques, les cellules nécrotiques et des cellules vivantes avec des colorants différents.
- iCys recherche en imagerie du cytomètre CompuCyte (Westwood, MA) a été utilisé pour analyser et comparer les niveaux de l'apoptose après le traitement. Sur la base des images de fluorescence microscopique, les intensités de toutes les couleurs ont été enregistrées et tracées en fonction de chefs d'accusation et les pourcentages pour les différentes populations ont été calculés.
- Comparé au contrôle négatif, ce qui signifie qu'il n'y avait pas de traitement pour les cellules, les cellules apoptotiques changements ont été calculés à plier et énumérés dans le graphique.
- Assay Kit 3.8.8 Apo-ONE Caspase-3 homogène / 7 (Promega, Madison, WI) a été utilisée pour examiner la pro-apoptotique activité après transfection de poids-p53 plasmide. 1mg/ml PEI a été utilisé comme contrôle négatif pour éliminer toute l'activité apoptotique. Après post-transfection, les cellules ont été traitées avec de la rhodamine 110, bis-(amide d'acide N-CBZL-aspartyl-L-glutamyl-L-valyl-L-aspartique, Z-DEVD-R110), qui est un substrat de la caspase 3 / 7, pour un maximum de 18 heures.
- Plaque a été mesurée avec BioTek Synergy lecteur de plaque HT pour la fluorescence à 490/520 nm. Basé sur l'intensité de la fluorescence verte, activité pro-apoptotique pourrait être évalué.
4. Les résultats représentatifs
1. Synthèse et Chatacterization des nanoparticules ciblées EGFR
EGFR peptide modifié nanoparticules ont été synthétisés comme le schéma montré dans la figure 1. Les nanoparticules préparées par désolvatation ont été caractérisés pour la taille des particules et le potentiel zêta. La charge moyenne taille et la surface des particules préparées à partir de gélatines thioléavec différents degrés de thiolation sont répertoriés dans le tableau 1. Les particules de diamètre moyen de différentes nanoparticules étaient entre 150 à 250 nm. Nanoparticules thiolé ont plus petite taille par rapport aux nanoparticules de gélatine, pourrait due à la formation pont disulfure à l'intérieur des particules. Avec des modifications de surface différentes, de tailles de nanoparticules ont augmenté. Les potentiels zêta des différentes formulations ont été autour de -20 mV. Avec l'analyse MEB, la taille, la morphologie de surface et la forme sphérique des nanoparticules ont été observés et correspondant à la suite Zetasizer. Efficacités de chargement de l'ADN dans des nanoparticules de gélatine et la gélatine thiolé nanoparticules ont été supérieurs à 95% (tableau 1).
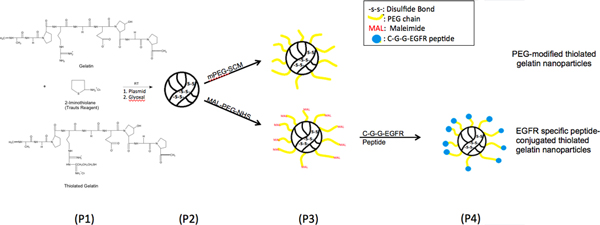
Figure 1. Schéma de réaction chimique, modification de surface illustrant des thiolé nanoparticules de gélatine de croissance épidermique factor récepteur (EGFR) de liaison peptidique par un poly (éthylène glycol) (PEG) entretoise.
Caractérisation des nanoparticules
| Formulation | Diamètre des nanoparticules (nm) | Potentiel zêta (mV) | Plasmidique efficacité du chargement ADN (%) |
| Gel NP | 151,4 ± 23,5 | -17,1 ± 5,23 | 95,6 ± 2,2 |
| SH-Gel NP | 132,6 ± 17,9 | -24,6 ± 5,16 | 97,0 ± 3,8 |
| SH-Gel-PEG | 179,0 ± 30,9 | -22,3 ± 9,50 | 95,8 ± 6,5 |
| SH-Gel PEG Peptide | 230,8 ± 41,5 | -18,1 ± 4,02 | 94,8 ± 5,1 |
Tables 1. efficacités taille des particules, la charge de surface, et le plasmide ADN encapsulation de contrôle et de l'EGFR ciblées gélatine et la gélatine thiolé nanoparticules.
Haute résolution C 1S scans de spectroscopie électronique pour analyse chimique (ESCA) a été utilisé pour analyser les composants de surface de la gélatine thiolé (SH-Gel NP), le PEG-modifiés thiolé gélatine (SH-Gel PEG) et EGFR-peptide gélatine modifiée thiolé nanoparticules (SH-Gel PEG Peptide). Les résultats dans le tableau 2 montre les intensités des pics du CH (hydrocarbures), CO (éther), et C = O (carbonyle) groupes à 285,0, 286,3, 288,1 et eV, respectivement. Le signal de CO éther a augmenté après la modification et le PEG a diminué après la conjugaison des peptides. Alors que la composition d'azote a diminué après la modification et le PEG a augmenté après la modification des peptides, qui a confirmé la présence de l'EGFR ciblant peptide sur les nanoparticules. Analyse ESCA a en outre confirmé PEG et de modification de surface de peptides.
Spectroscopie électronique pour analyse chimique de la surface des nanoparticules de composition
| Formulation | C 1s (%) | O 1s (%) | N 1s (%) |
| SH-Gel NP | 59,3 ± 0,8 | 22,9 ± 0,5 | 12,9 ± 0,1 |
| SH-Gel-PEG | 58,2 ± 0,6 | 28,0 ± 1,2 | 9,5 ± 0,7 |
| SH-Gel PEG Peptide | 56,7 ± 0,8 | 25,9 ± 0,7 | 12,3 ± 0,6 |
| Formulation | CC (%) | CO, N (%) | C = O (% ) |
| SH-Gel NP | 51,5 | 26,6 | 21,9 |
| SH-Gel-PEG | 17,1 | 63,1 | 19,8 |
| SH-Gel PEG Peptide | 33,1 | 42,8 | 24,1 |
Tableau 2. C 1S haute résolution des scans de spectroscopie électronique pour analyse chimique (ESCA)
Afin d'examiner la stabilité du plasmide encapsulé, les nanoparticules ont été traités avec la protéase ou DNAse séparément, simuntaneously ou séquentiellement. Après électrophorèse, les résultats de la figure 2 ont montré que l'ADN plasmidique encapsulé dans tous les nanoparticules sont protégées par des nanoparticules et stable, l'ADN plasmidique nu comparable à. Ces études ont montré que tous ces nanoparticules pourraient encapsuler et de préserver la structure plasmidique après encapsulation.
/ Files/ftp_upload/3612/3612fig2.jpg "/>
Figure 2. Stabilité de l'ADN plasmidique encapsulé dans thiolé la gélatine, le PEG-modifiés thiolé gélatine, et EGFR-peptide thiolé nanoparticules modifiées gélatine par électrophorèse sur gel. Les nanoparticules ont été traités avec 0,2 mg / ml de protéase pour prouver l'encapsulation d'ADN plasmidique dans la matrice des nanoparticules
2. Expression de l'EGFR base dans les cellules du cancer du pancréas
Deux lignées humaines de l'adénocarcinome à cellules pancréatiques (Panc-1 et Capan-1) ont été analysés par western blot pour expression de l'EGFR. Adénocarcinome ovarien humain (SKOV3) et fibroblastes murins ((NIH-3T3), les cellules ont été choisis comme témoins positifs et négatifs, respectivement. Bêta-actine a été analysée comme le contrôle de chargement de protéine. Panc-1 des cellules ont montré l'expression EGFR supérieur par rapport à Capan-1 et de cette lignée cellulaire a ensuite été utilisé pour les éléments suivants dans des études in vitro
3. La cytotoxicité de contrôle et de SurfaCE-jour thiolées nanoparticules de gélatine
Afin d'évaluer l'interaction cellulaire des nanoparticules, tests de cytotoxicité ont été effectués après le traitement avec des nanoparticules. Sur la base des résultats de la figure 3, les contrôler et les nanoparticules à surface modifiée ont été relativement sûrs et biocompatibles dans Panc-1 des cellules, même à des concentrations élevées, avec une comparaison à l'Île. Les études suivantes ont été réalisées avec des nanoparticules 1mg/ml.
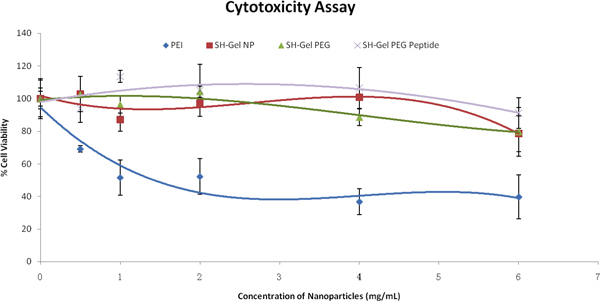
Figure 3. Viabilité cellulaire Pourcentage en fonction des concentrations de formulation de nanoparticules dans les cellules Panc-1, évalué par tétrazolium colorant (MTS) de dosage
4. Absorption cellulaire médiée par le récepteur dans les cellules Panc-1
Pour confirmer l'accessibilité de surface de l'EGFR ciblant des peptides et médiée par le récepteur d'endocytose absorption de nanoparticules, un système a été conçu par l'étiquetage de chaque composante avec fluorescence différente pour la visualisation de l'absorption des nanoparticules et le trafic dans les cellules. Avec ce système d'étiquetage, l'ADN plasmidique, les nanoparticules et noyau de la cellule n'a pu être identifié. Microscopie confocale à balayage laser de fluorescence a été utilisé pour prendre des images à différents moments, de 15 minutes à 6 heures. En comparant les images des différentes formulations, peptide conjugué nanoparticules de gélatine a montré l'absorption rapide et la libération de plasmide dans les 30 minutes. Ce résultat encore prouvé que l'EGFR peptide conjugué nanoparticules subi endocytose facilitée par l'interaction rapide entre l'EGFR peptide spécifique et des récepteurs EGFR à la surface cellulaire, ce qui était beaucoup plus rapide, par rapport à d'autres nanoparticules, qui a subi non spécifiques endocytose.
Étude trafic cellulaire
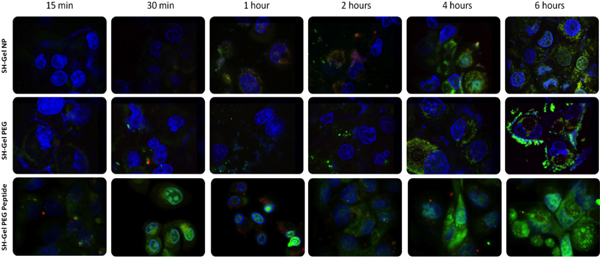
Figure 4. Microscopie confocale de fluorescence unealysis d'ADN encapsulé absorption des nanoparticules et le trafic de Panc-1 des cellules. (Rouge = marqué à la rhodamine nanoparticules, vert = PicoGreen marqué l'ADN plasmidique, et bleu = DAPI-étiquetés noyau). La puissance du laser a été 7 fois moins de quatre derniers chiffres du panneau inférieur.
5. Qualitatives et quantitatives transfection in vitro avec Green Fluorescent Protein améliorée
ELISA dans la Figure 5 et la fluorescence analyse microscopique dans la figure 6 ont été utilisées pour mesurer l'efficacité qualitative et quantitative transfection GFP dans les cellules Panc-1 lors de l'administration des non modifiée, le PEG-peptide modifié et EGFR-modifiés thiolé nanoparticules de gélatine. Plasmides délivré par l'EGFR ciblée des nanoparticules entraîné le plus haut niveau d'expression de GFP après 48 heures par rapport à d'autres contrôles, y compris les Lipofectin complexé ADN.
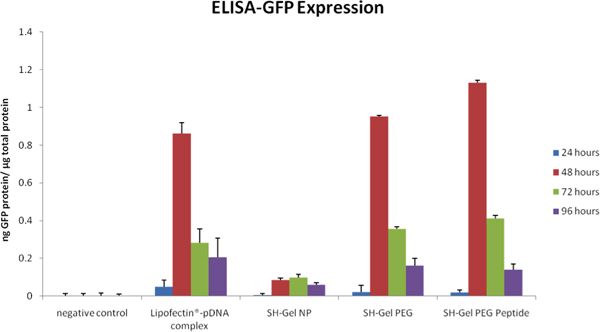
Figure 5. Une expression de la GFPnalyzed par ELISA tracée en fonction du temps post-administration d'ADN plasmidique dans le contrôle et l'EGFR ciblée des nanoparticules.
Analyse microscopique de fluorescence pour la transfection GFP
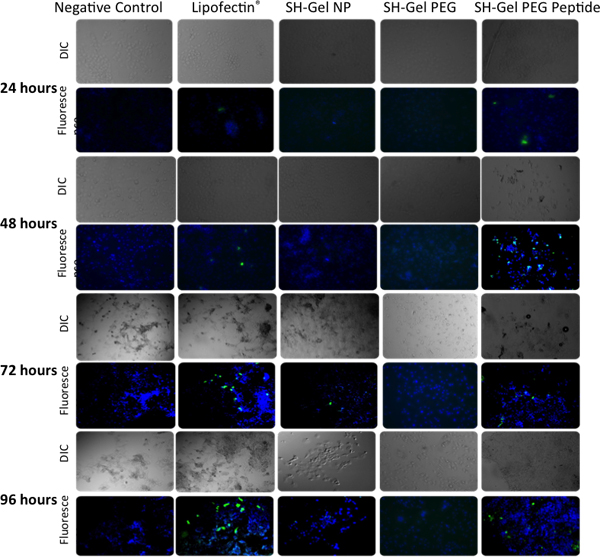
Figure 6. L'analyse qualitative de l'expression de la protéine fluorescente verte Panc-1 des cellules par microscopie epifluoresence après 24, 48, 72 et 96 heures post-transfection avec EGFP-N1. Lipofectin complexe ADN a été utilisé comme contrôle positif.
6. En transfection in vitro avec la p53 sauvage plasmidique dans les cellules Panc-1
Plasmides p53 sauvage pORF-hp53, avec un objectif EF-1α / HTLV promoteur hybride ont été extraits de E. coli et encapsulé dans des nanoparticules d'étudier l'effet apoptotique thérapeutiques. Panc-1 cellules ont été traitées avec des particules pendant 6 heures et l'après-transfectées pour 24 supplémentaires, 48, 72 et 96 heures.
Depuis p53 pourrait induire l'apoptose dans les cellules et pour accomplir cette fonction, de nombreux facteurs de transcription en aval seraient impliqués et directement réglementée par l'expression de WT-p53. Parmi eux, Bax, la caspase-3, la caspase-9, DR5, PUMA et Apaf-1 serait-régulée par l'expression de p53 et tout Bcl-2, la survivine serait régulé à la baisse. Afin d'examiner les niveaux de ces facteurs de transcription, l'ARNm a été extrait de cellules Panc-1 après 48 heures post-transfection et utilisé pour la RT-PCR. Les produits ont été évalués par électrophorèse sur gel et les bandes ont été analysés avec ImageJ. Basé sur les résultats ont montré dans la figure 7, la survivine diminué de manière significative avec le traitement de l'EGFR ciblées thiolé nanoparticules de gélatine par rapport aux autres traitements, aucun changement évident a été vu dans Bcl-2, Bax et l'expression de la caspase-3, la caspase-9, DR5, PUMA et Apaf-1increased avec le traitement des nanoparticules ciblées.
les/ftp_upload/3612/3612fig7.jpg "/>
Figure 7. Les taux d'ARNm de facteurs en aval de poids-p53 ont été comparés d'expression par RT-PCR après 48 heures post-transfection.
Après poids-p53 transfection, condensation de la chromatine / Membrane de perméabilité / Dead kit apoptose cellulaire a été utilisé pour différencier les cellules apoptotiques, les cellules nécrotiques et des cellules vivantes avec des colorants différents. iCys recherche en imagerie du cytomètre CompuCyte (Westwood, MA) a été utilisé pour analyser et comparer les niveaux de l'apoptose après le traitement. Comparé au contrôle négatif, les cellules apoptotiques changements ont été calculés à plier et énumérés dans la figure 8. EGFR ciblées thiolé nanopaticles gélatine ont montré la plus forte population de cellules apoptotiques après le post-transfection. Analyse de la caspase 3 / 7 l'activité a également montré que l'EGFR ciblée des nanoparticules avaient internalisation rapide et le plus haut niveau de l'activité apoptotique dans les cellules Panc-1.
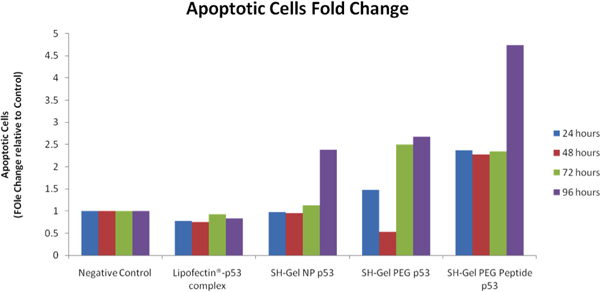
Figure 8. Analyse cytométrique d'activité pro-apoptotique dans le contrôle poids-p53 transfectées Panc-1 des cellules en utilisant l'imagerie iCys ° Cytomètre
Discussion
Contrôle et EGFR ciblées thiolé nanoparticules de gélatine ont été préparées avec l'ADN d'encapsulation efficace et la stabilité. Les tailles de particules de tous ces systèmes ont été dans la gamme de 150-250 nm de diamètre. Potentiel Zeta a prouvé que ce système est un système légèrement négative. Avec l'analyse MEB, la taille des nanoparticules ont été les mêmes avec un résultat Zetasizer. Analyse ESCA pourrait confirmer PEG et de modification de surface des peptides.
Western blot analyse a montré que les cellules Panc-1 a eu un niveau élevé d'expression de l'EGFR et cette lignée cellulaire a été utilisé pour les études in vitro. Tant le contrôle et les nanoparticules à surface modifiée ont été relativement moins cytotoxiques dans les cellules Panc-1 par rapport au PEI.
Des études ont montré le trafic cellulaire absorption rapide et la libération de l'EGFR plasmidique ciblée des nanoparticules dans Panc-1 des cellules. Livraison de la journaliste plasmides d'ADN exprimant l'EGFR ciblée des nanoparticules conduit à plus hauts niveaux deExpression de la GFP par rapport à d'autres contrôles, y compris les Lipofectin complexé ADN. Avec le même système, la transfection avec WT-p53 plasmidique a déclenché la voie aval apoptotiques et l'apoptose induite rapide de Panc-1 des cellules.
Ces résultats préliminaires suggèrent que l'EGFR ciblées thiolé nanoparticules de gélatine peut servir de système de livraison ADN sûr et efficace pour la thérapie génique comme traitement pour le cancer du pancréas.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Cette étude a été soutenue par l'Alliance du National Cancer Institute en nanotechnologie pour le Cancer Center pour l'excellence nanotechnologie et le cancer (CCNE) accorder U54 CA151881-.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Gélatine de type B, 225 Bloom | Sigma-Aldrich | G9391 | |
| 2-iminothiolane chlorhydrate | Sigma-Aldrich | I6256 | |
| pEGFP-N1 plasmidique | Elim Biopharm | N / A | |
| pORF-hp53 E. coli | Invivogen | porf-hp53 | |
| Solution de glyoxal (40wt.% en H 2 O) | Sigma-Aldrich | 128465 | |
| Glycine | Sigma-Aldrich | 410225-250G | |
| QIA filtre Plasmid Mega kit | Qiagen | 12281 | |
| Beckman LE 80K Ultracentrifuger | Beckman | N / A | |
| Console FreeZone 6 litres Gel systèmes secs | Labconco | 7753020 | |
| mPEG-SCM, MW 2000 Da | Laysan | mPEG-SMC-2K-1g | |
| MAL-PEG-SCM, MW 2000 Da | Jenkem technologie | A5001-1 | |
| Zetasizer Nano | Malvern | Zetasizer Nano ZS | |
| Émission de champ Hitachi 4800 microscope électronique à balayage | Hitachi | S-4800 FE-SEM UHR | |
| Quant-iT PicoGreen Réactif ADNdb et kits | Invitrogen | P7589 | |
| Réactif de transfection Lipofectin | Invitrogen | 18292011 | |
| DMEM | Mediatech Cellgro | 10 013 CM | |
| RPMI | Mediatech Cellgro | 50 020 PB | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| iBlot Système sec Blotting | Invitrogen | IB1001 | |
| XCell SureLock Mini-Cell et XCell II Blot Module Kit marquage CE | Invitrogen | EI0002 | |
| Pierce ECL Western Blot Substrat | Thermo Scientific | 32109 | |
| Kodak Digital rayons X de l'échantillon (DXS) Système | Kodak | N / A | ; |
| CellTiter AQ 96 ueous Un test de prolifération cellulaire Solution (MTS) | Promega | G3580 | |
| BioTek SynergyHT lecteur de plaque | BioTek | N / A | |
| Nanodrop 2000 | Thermo Scientific | N / A | |
| One-step RT-PCR kit | Qiagen | 210212 | |
| Condensation de la chromatine / Membrane de perméabilité / Dead Kit apoptose des cellules | Invitrogen | V23201 | |
| Apo-ONE homogène Caspase-3 / 7 Assay Kit | Promega | G7790 | |
| Hybaid PCR Sprint Thermocycleur | Thermo Scientific | N / A | |
| Anticorps anti-récepteur EGF | Cellulairede signalisation | 2232 | |
| β-actine Anticorps | La signalisation cellulaire | 4967 | |
| IgG anti-lapin, HRP-anticorps liés | La signalisation cellulaire | 7074 | |
| Anticorps monoclonal de souris GFP | Novus Biologicals | NB600-597 | |
| D'anticorps polyclonaux de chèvre GFP (phosphatase alcaline) | Novus Biologicals | NB600-1502 | |
| Kit substrat de la phosphatase | Thermo Scientific | 37620 |
Références
- Vimalachandran, D. Genetics and prevention of pancreatic cancer. Cancer. Control. 11, 6-14 (2004).
- Kommareddy, S., Amiji, M. Preparation and evaluation of thiol-modified gelatin nanoparticles for intracellular DNA delivery in response to glutathione. Bioconjug. Chem. 16, 1423-1432 (2005).
- Kommareddy, S., Amiji, M. Poly(ethylene glycol)-modified thiolated gelatin nanoparticles for glutathione-responsive intracellular DNA delivery. Nanomedicine. 3, 32-42 (2007).
- Kommareddy, S., Amiji, M. Antiangiogenic gene therapy with systemically administered sFlt-1 plasmid DNA in engineered gelatin-based nanovectors. Cancer. Gene. Ther. 14, 488-498 (2007).
- Kommareddy, S., Amiji, M. Biodistribution and pharmacokinetic analysis of long-circulating thiolated gelatin nanoparticles following systemic administration in breast cancer-bearing mice. J. Pharm. Sci. 96, 397-407 (2007).
- Kaul, G., Amiji, M. Tumor-targeted gene delivery using poly(ethylene glycol)-modified gelatin nanoparticles: in vitro and in vivo studies. Pharm. Res. 22, 951-961 (2005).
- Bardeesy, N., DePinho, R. A. Pancreatic cancer biology and genetics. Nat. Rev. Cancer. 2, 897-909 (2002).
- Li, Z. Identification and characterization of a novel peptide ligand of epidermal growth factor receptor for targeted delivery of therapeutics. FASEB. J. 19, 1978-1985 (2005).
- McCormick, F. Cancer gene therapy: fringe or cutting edge. Nat. Rev. Cancer. 1, 130-141 (2001).
- Green, D. R., Kroemer, G. Cytoplasmic functions of the tumour suppressor p53. Nature. 458, 1127-1130 (2009).
- Barton, C. M. Abnormalities of the p53 tumour suppressor gene in human pancreatic cancer. Br. J. Cancer. 64, 1076-1082 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon