Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthodes pour l'étude de la morphogenèse neuronale:
Dans cet article
Résumé
Pour procéder à une évaluation rapide de la fonction des gènes dans le développement du cortex cérébral, nous décrivons des procédés impliquant l' Ex vivo de plasmides co-exprimant inhibitrice ARN (ARNi) et de la GFP dans le cortex embryonnaire murin. Ce protocole est susceptible d'être l'étude des divers aspects de développement neurologique tels que la neurogenèse, la migration neuronale et de la morphogenèse neuronale, y compris la croissance axonale et dendritique.
Résumé
Le cortex cérébral dirige les fonctions cognitives supérieures. Cette structure à six couches est généré dans un intérieur et unième, hors-dernière de manière, dans lequel les premiers neurones nés restent plus proches de l'ventricule tandis que les neurones derniers nés migrer au-delà des premiers neurones nés vers la surface du cerveau 1. En plus de la migration neuronale 2, un processus clé pour la fonction corticale normale est la régulation de la morphogenèse neuronale 3. Alors que la morphogenèse neuronale peut être étudiée in vitro dans des cultures primaires, il ya beaucoup à apprendre de la façon dont ces processus sont régis dans les environnements de tissus.
Nous décrivons les techniques pour analyser la migration neuronale et / ou la morphogenèse en tranches organotypiques du cortex cérébral 4,6. Un vecteur pSilencer modifié est utilisé, qui contient à la fois un promoteur U6 qui entraîne les ARN à double brin en épingle à cheveux et une cassette d'expression qui code pour la protéine distincte GFP entraînée bya promoteur CMV 7-9. Notre approche permet de l'évaluation rapide des défauts dans la croissance des neurites sur knockdown spécifique de gènes candidats et a été utilisé avec succès dans un écran pour les régulateurs de croissance des neurites 8. Parce que seul un sous-ensemble de cellules expriment les constructions RNAi, les tranches organotypiques de permettre une analyse de la mosaïque des phénotypes potentiels. En outre, parce que cette analyse se fait dans une approximation proche de l'environnement in vivo, il offre un faible coût et alternative rapide à la génération d'animaux transgéniques ou knock-out pour les gènes de la fonction corticale inconnue. Enfin, en comparaison avec la technologie d'électroporation in vivo, le succès des anciens expériences d'électroporation in vivo ne dépend pas de la chirurgie de développement des compétences et de maîtrise peut être réalisée avec un temps de formation plus courte et la compétence.
Protocole
1. Préparation des solutions de la Culture et médias (pas dans la vidéo)
- Préparez 1 litre de solution complète saline équilibrée de Hank (HBSS) contenant HBSS 1x, 2,5 mM HEPES (pH 7,4), 30 mM de D-glucose, 1 mM CaCl 2, 1 mM MgSO 4 et 4 mM NaHCO 3. Ajouter l'eau bidistillée (FD 2 O). Stériliser par filtration avec un filtre de 0,2 um et conserver à 4 ° C.
- Préparer le milieu de culture tranche en utilisant 35 ml de milieu de Eagle basale des médias, 12,9 mL de HBSS complètes, 20 mM D-glucose (1,35 ml d'une solution 1 M), 1 mM Glutamax (0,25 ml d'une solution 200 mM), 0,5 ml de pénicilline stock de la streptomycine-100x. Stériliser par filtration avec un filtre de 0,2-um, puis ajouter inactivé par la chaleur du sérum de cheval à une concentration finale de 5%.
- Préparer la solution de laminine de travail en faisant un 1 mg / ml de la solution stock de laminine avec de l'eau stérile désionisée distillée. Préparer des aliquots de 100 ul de 0,5 mL tubes eppendorf et congeler à -80 ° C.
- Préparer poly-L-lysine de travail afinlution par addition de 5 ml de H 2 O stérile à 5 mg de poly-L-lysine pour faire une à 1 mg / ml de solution concentrée. Préparer des aliquotes de 1 mL et congeler à -20 ° C.
- Préparer la solution de revêtement en diluant 1 ml de poly-L-lysine et 100 ul de la laminine à un volume final de 12 ml avec de l'eau stérile. Faire de cette solution fraîche à chaque fois.
2. Préparation Insère organotypique (pas dans la vidéo)
- Préparer deux plaques de six puits avec un insert de culture par puits en utilisant des pinces stériles. Ajouter 2 ml de solution stérile O ddH 2 sous les inserts de culture.
- Ajouter 1 mL de la solution de revêtement au-dessus de la membrane en prenant soin de ne pas percer la membrane. Incuber une nuit dans un incubateur humidifié à 37 ° C et 5% de CO 2.
- Retirez le support de revêtement et les laver à membrane avec stériles H 2 0 trois fois. Laissez inserts sec avant utilisation. Ajouter 1,8 ml de milieu de culture tranche et le lieu à 37 ° C incubateur. Envelopper les plaques inutilisées avec du Parafilmet conserver à 4 ° C pour un maximum de 4 semaines.
3. Préparation pour l'électroporation (pas dans la vidéo)
- Préparer des constructions RNAi pour l'électroporation. Double inserts brin en épingle à cheveux d'ARN ont été clonés dans un vecteur pSilencer. Les plasmide contient: 1) un promoteur qui entraîne U6 l'ARN double brin génération, et 2) une cassette d'expression de la GFP dirigée par le promoteur CMV 8,9. Ce plasmide a été précédemment décrit par Konishi et ses collègues 9 et d'autres 7,8. Plasmides sont purifiés en utilisant une Qiagen maxi-kit de préparation, et utilisé à une concentration de 1 mg / ml.
- Afin de visualiser l'ADN tandis que l'injection, préparer un 0,5% solution rapide colorant vert et de l'utiliser à 1:20 avec l'ADN doit être injecté (généralement de 20 uL d'ADN avec 1 pl de vert rapide). Gauche sur l'ADN-rapide mélange de colorant vert peuvent être stockés à -20 ° C pendant jusqu'à une semaine.
- Zone de dissection propre, dissectides outils et des navires ng vibratome avec de l'éthanol 70%. Réfrigérer HBSS complètes, de sorte qu'il est glacée. Refroidissement vibratome navire par l'emballage de la glace autour de lui à l'intérieur du vibratome avec un peu d'eau pour le refroidissement rapide. Préparer 3% bas point de fusion d'agarose en utilisant HBSS complètes. Micro-ondes pendant 1 min. Évitez de trop bouillante. Conserver dans un bain-marie à 42 ° C jusqu'à son utilisation.
- Paramètres d'électroporation sont fixés comme suit. Pour une utilisation d'embryons E15 35 V, 5 impulsions, longueur de 100 ms, 900 ms d'intervalle entre les impulsions. Pour animaux plus, pour assurer l'électroporation, utiliser une tension plus élevée jusqu'à 50 V ou augmenter le nombre d'impulsions jusqu'à 8 impulsions. Pour éviter d'endommager le tissu chez les jeunes animaux, utiliser des impulsions soit moins ou jusqu'à 2 légumineuses et basse tension jusqu'à 25 V. Ces paramètres peuvent être modifiés et déterminés de façon empirique en fonction de l'âge de l'animal.
4. Dissection et électroporation (en vidéo)
- Après l'euthanasie d'une femme enceinte, disséquer des embryons à en glacées HBSS complètes. Keep chaque embryon dans leurs sacs individuels placentaires.
- Disséquer embryon sortir et couper la tête après la première vertèbre. Gardez à l'glacées HBSS complètes.
- Pour l'injection, placez la tête sur un morceau de parafilm sur le dessus d'une boîte de Pétri. Utilisation sur mesure Hamilton seringue (voir tableau I) injectent environ 6 à 8 pi de l'ADN: rapide vert mix colorant à travers le troisième ventricule afin de combler dans les deux ventricules latéraux dans les vésicules corticales. Sinon, l'injection peut être effectuée directement dans chacun des ventricules latéraux.
- Pour l'électroporation ex vivo, utiliser des électrodes de platine BTX-pincement. Placez l'électrode positive vers le côté du cortex que vous voulez dire électroporer dessus de la tête pour le cortex dorsal.
- Après électroporation, incuber les têtes sur la glace pendant au moins 5 minutes avant de dissection.
- Disséquer les cerveaux dans HBSSby glacée faisant une petite incision sur le côté de la tête et le pelage de la peau sur les côtés de la tête. Ensuite, avecune pince fine délicatement éplucher les pia du cerveau. Retirez le cerveau intact du crâne, en prenant soin de ne pas endommager le cortex.
5. Inclusion et la coupe de cortex électroporées (en vidéo)
- Transfert de 3% d'agarose à faible point de fusion dans un grand moule placé sur la glace. Le fond du moule va commencer à se solidifier plus rapidement ce qui permettra d'éviter les cerveaux de sombrer vers le fond du moule. Doucement, le transfert des cerveaux avec des pinces fines, un par un après avoir enlevé l'excès de tampon avec un Kimwipe ou papier filtre. Utiliser un embout de pipette 10 pL à faire tourbillonner le cerveau à l'intérieur du moule pour assurer l'interface entre le maximum de l'agarose et le tissu cérébral.
- Orienter les cerveaux pour assurer tous les cerveaux sont dans la même orientation et à peu près au même niveau dans l'agarose. Laissez l'agarose solidifier pendant environ 5 min. Utilisez adhésif de liaison (folle colle) pour fixer les blocs d'agarose afin que les bulbes olfactifs sont debout. Une fois que les blocs sont attachés, immédiatement je ajoutersexies HBSS froid et les garnitures de l'agarose pour s'assurer que les tranches individuelles sont obtenus pour chaque cerveau.
- Pour couper les blocs, mis la vitesse de la vibratome à une faible vitesse (environ la moitié du maximum) et définissez la fréquence de vibration de lame au réglage le plus élevé. Générer de 250 um d'épaisseur coupes coronales. Récupérer tranches à l'aide d'une spatule coudée fine et les transférer à des puits de tissu avec un pinceau fin ou une pince.
- Dans hotte culture de tissus, de transférer les tranches dans des inserts en revêtement. Ajouter 500 ul de milieu de culture à chaque tranche d'insertion pour faciliter le transfert. Jusqu'à 5 tranches peuvent être placés par insert. Retirez les supports en excès à partir du haut des tranches et incuber à 37 ° C en incubateur humidifié.
6. Culture et de l'analyse de tranches organotypiques (en vidéo)
- Afin de maintenir en bonne santé tranches, les médias frais doit être ajouté au moins tous les deux jours sous la membrane en remplaçant la moitié des médias à chaque fois.
- Afin d'analyser les tranches après la djour esired dans la culture, fixer les tranches dans la membrane. Laver avec une solution saline tamponnée 1x phosphate (PBS) à 37 ° C à trois reprises pendant 10 min à chaque fois. Ensuite, fixer avec du paraformaldéhyde à 4% (PFA) nuit à 4 ° C ou pendant 1 h à température ambiante.
- Tranches peuvent être analysés avec différents marqueurs cellulaires ou colorés au Hoechst seul à visualiser les cellules électroporées et non électroporé. Perméabiliser et de bloquer les tranches de 2 h à température ambiante avec du sérum de chèvre 10%, Triton de 0,1% en PBS 1x en agitant doucement.
- Colorer avec Hoechst pendant 1 h à température ambiante, se laver 3 fois avec du PBS 1x 10 min à chaque fois avec agitation douce.
- Pour monter tranches couper la membrane avec un scalpel, et utiliser une pince fine pour transférer la membrane contenant des tranches d'un verre dépoli coulissant dans une chambre d'eau. Jusqu'à 5 tranches peuvent être placés par lame de verre. Retirer l'excès d'eau, et ajouter une goutte de solution Flourmount à chaque tranche du cerveau. Placez délicatement une lamelle sur le dessus des tranches de cerveau et de supprimer uney bulles d'air. Analyser tranches à l'aide d'un microscope confocal.
7. Inclusion dans la paraffine de tranches organotypiques Alternative (pas dans la vidéo)
- Tranches organotypiques peuvent également être intégrés à la paraffine pour une analyse plus fine morphologique, à cette fin la membrane contenant les tranches organotypiques peut être fixé à 4% PFA tel que décrit ci-dessus.
- Les tranches fixes sont intégrés dans 1% (pré-chauffé à 37 ° C) d'agarose, et solidifié dans la glace pendant 30 min. Les blocs d'agarose peuvent ensuite être post-fixes dans 4% PFA à 4 ° C pendant 30 min.
- Le bloc d'agarose contenant la tranche organotypique seront ensuite inclus en paraffine et traitées pour immunofluorescence comme décrit précédemment 10.
8. Les résultats représentatifs
Une représentation schématique de l'électroporation du cortex murin et la culture de tranches organotypiques est illustré à la figure 1. Cette méthode est une stratégie utile pour rapiévaluation d de la fonction de gènes impliqués dans le développement neuronal 11. Selon la quantité d'ADN électroporé et le stade embryonnaire à l'électroporation, l'efficacité de transfection peut varier. Tranches va commencer exprimant la GFP au moins 8 heures après l'électroporation et les cellules-seront soumises à la séquence normale des événements neurologiques (prolifération, la migration, et au début de la différenciation neuronale) dans la culture. La figure 2 montre une tranche du cerveau électroporé qui est l'expression d'un contrôle pSilencer-GFP vecteur et on peut observer progéniteurs neuronaux, de neurones migrent et les neurones différenciés dans la tranche. Tranches organotypiques garderont leur morphologie aussi longtemps qu'ils sont maintenus dans un bon media-interface air sur les membranes et peut être utilisé jusqu'à au moins 5 jours de culture.
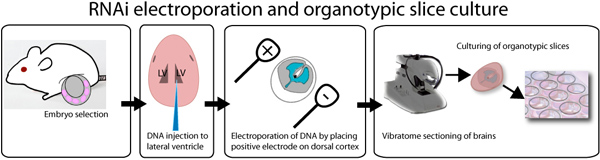
Figure 1. Illustration de l'électroporation ex vivo et organotypiquela culture d'essai. E14.5 embryons sont disséqués, et individuellement injecté avec de l'ADN mélangé avec le colorant vert rapide afin de visualiser le site d'injection. L'ADN peut être injecté dans les deux ventricules latéraux comme illustré dans l'illustration ou dans le troisième ventricule, afin de remplir les ventricules latéraux. Après l'injection, les cerveaux sont une électroporation avec un électroporateur onde carrée, en plaçant l'électrode positive du côté désiré du cerveau. Brains sont intégrés dans 3% d'agarose à faible point de fusion et sectionné l'aide d'un vibratome. 250 tranches de cerveau um sont placés sur 0,4 um inserts et cultivées jusqu'à une semaine. GFP peut être observée après 8 après transfection heures.
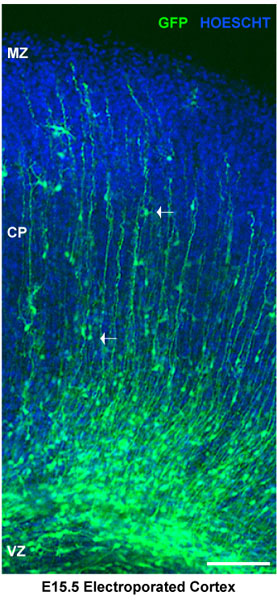
Figure 2. Analyse des tranches de cerveau électroporées. Tranches de cerveau électroporées ont été colorées pour Hoescht. Cortex dorsal montre électroporés progéniteurs neuronaux à la zone ventriculaire (vz). Les neurones dans le cortical plaque (cp) sont délimitées par la zone marginale (mz). Les flèches blanches indiquent les neurones migrent. Dans ce cas, les cerveaux ont été injectés à E15.5 et électroporation avec un vecteur de contrôle pSilencer GFP. Les sections représentent explants corticales 4 jours après l'électroporation. Échelle barre de 100 um.
Dépannage:
- Efficacité de la transfection faible: Ajuster la concentration de l'ADN utilisé pour au moins 1 ug / uL. Toujours utiliser l'ADN très propre à partir d'une préparation maxi si nécessaire utiliser une endo-libre Quiagen kit pour purifier l'ADN.
- Les cellules transfectées dans une région du cerveau différente de la fréquence souhaitée: Veiller à ce que les électrodes sont positionnées correctement avec la position électrode positive vers le côté du cerveau à être une électroporation.
- Tranches organotypiques perdre la morphologie: les médias changent chaque jour et de s'assurer que les tranches ne sont pas flotter dans les médias
- Tranches de se détacher de l'agarose comme ils sont coupés dans la vibratome: Veiller à ce qu'une bonne interface est faite lors de l'incorporation des cerveaux dans le bas point de fusion d'agarose.
Access restricted. Please log in or start a trial to view this content.
Discussion
Ces procédés impliquant l'électroporation ex vivo de plasmides codant pour l'ARN double brin épingles à cheveux 8 et la culture de tranches organotypiques 4 fournissent plusieurs avantages distincts. Tout d'abord, ces méthodes permettent une évaluation rapide de l'ARNi dérivés phénotypes. L'inclusion d'une cassette d'expression codant pour la GFP dans le vecteur pSilencer même qui contient le promoteur U6 qui entraîne le double brin d'ARN en épi...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous remercions le Dr Shirin Bonni pour fournir la construction pSil-GFP, M. Alper Uzun pour l'illustration de la figure 1, et l'installation de bio-imagerie Leduc pour la microscopie confocale. EMM est pris en charge par la bourse de carrière pour les sciences médicales de l'Burroughs Wellcome Fund, un NARSAD Prix des jeunes chercheurs, et les NIH NCRR COBRE P20 RR018728-01. SBL est soutenu par le NIH NCRR P20 COBRE RR018728-01, et a reçu le soutien de PHS NRSA 5T32MH019118-20.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Hamilton seringue | HAMILTON | 80008 | De calibre 31, 0,5 cm de long, PT-4 (niveau de biseautage point), le volume 10 pi |
| Tweezertrodes Platinum | BTX | 45-0489 | La taille de 5mm |
| ECM830 électroporateur | BTX | 45-0002 | |
| BTX Footswitch | BTX | 45-0208 | Pour une utilisation avec ECM830 électroporateur |
| Microtome à lame vibrante | LEICA | VT1000 S | |
| 6 - plat bien à utiliser avec des inserts | FALCON | 353502 | Contient encoches pour s'adapter à inserts |
| Inserts de culture de tissus | FALCON | 353090 | 0,4 micromètre |
| Fast Green | SIGMA | F7252 | |
| Faible fusion Agarose | FISHER | BP165-25 | L'ADN de qualité |
| La laminine | Sigma-Aldrich | L2020 | |
| Poly-L-lysine | Sigma-Aldrich | P5899 | |
| Milieu de base d'Eagle | Sigma-Aldrich | B-1522 | |
| HBSS 10x sans Ca et Mg | GIBCO | 14180-046 | |
| HEPES sans acide | Sigma-Aldrich | H4034 |
Références
- Angevine, J. B. Jr, Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon