Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de l'échantillon de
Dans cet article
Résumé
Le profil métabolomique des Mycobacterium tuberculosis Est déterminé après la croissance dans les bouillons de culture. Les conditions peuvent être modifiées pour tester les effets des suppléments nutritionnels, des oxydants et des agents anti-tuberculeux sur le profil métabolique de ce micro-organisme. Procédure de préparation d'extrait est applicable à la fois pour 1D 1 H et 2D 1 H- 13 C analyses RMN.
Résumé
Mycobacterium tuberculosis est une cause majeure de mortalité chez les êtres humains à l'échelle mondiale. L'émergence de deux multi-(MDR) et ultra-(XDR) souches résistantes aux médicaments menace de faire dérailler les efforts actuels de lutte contre les maladies. Ainsi, il ya un besoin urgent de développer des médicaments et des vaccins qui sont plus efficaces que ceux actuellement disponibles. Le génome de M. la tuberculose est connue depuis plus de 10 ans, mais il ya d'importantes lacunes dans notre connaissance de la fonction des gènes et l'essentialité. De nombreuses études ont depuis utilisé l'analyse de l'expression des gènes, tant au niveau transcriptomique et protéomique afin de déterminer les effets des médicaments, des oxydants et des conditions de croissance sur les tendances mondiales de l'expression des gènes. En fin de compte, la réponse définitive de ces modifications est reflétée dans la composition métabolique de la bactérie, y compris quelques milliers de petits produits chimiques de poids moléculaire. En comparant les profils métaboliques de type sauvage et des souches mutantes, non traitées ou treated à un médicament particulier, peut effectivement permettre l'identification des cibles et peut conduire au développement de nouveaux inhibiteurs des anti-tuberculeux activité. De même, les effets de deux ou plusieurs conditions sur le métabolome peut également être évaluée. La résonance magnétique nucléaire (RMN) est une technologie puissante qui est utilisée pour identifier et quantifier les intermédiaires métaboliques. Dans ce protocole, les procédures pour la préparation de M. extraits cellulaires tuberculose pour la RMN métabolomique analyse sont décrites. Des cultures de cellules sont cultivées dans des conditions appropriées et de biosécurité de niveau requis de confinement 3, 1 récoltées et soumises à une lyse mécanique, tout en maintenant le froid pour optimiser la préservation de métabolites. Les lysats cellulaires sont récupérés, filtrés stérilisés et stockés à des températures ultra basses. Des aliquotes de ces extraits de cellules sont étalées sur gélose Middlebrook 7H9 pour unités formant colonies pour vérifier l'absence de cellules viables. Après deux mois d'incubation à 37 ° C, en l'absence de vicolonies capables sont observées, les échantillons sont retirés de la zone de confinement pour le traitement en aval. Extraits sont lyophilisées, resuspendues dans un tampon deutéré et injecté dans l'appareil RMN, la saisie des données spectroscopiques qui est ensuite soumis à une analyse statistique. Les procédures décrites peuvent être appliquées à la fois à une dimension (1D) RMN 1 H et en deux dimensions (2D) 1 H-13 C analyses RMN. Cette méthodologie fournit plus fiable d'identification petit poids moléculaire et plus métabolite fiables et sensibles des analyses quantitatives des compositions extrait métaboliques cellulaires que les méthodes chromatographiques. Variations de la procédure décrite à la suite de l'étape de lyse cellulaire peut également être adapté pour l'analyse protéomique parallèle.
Protocole
1. Texte du Protocole
Ce protocole met en évidence l'adaptation de la méthodologie RMN à M. tuberculose (agent de classe III). Par conséquent, en matière de biosécurité pratiques Niveau 3 (BSL3) doivent être suivies lors de la conduite de M. recherche sur la tuberculose dans un laboratoire certifié chaque année. L'exposition aux aérosols produits par les laboratoires est le danger le plus important rencontré par le personnel travaillant avec ces micro-organismes. Les procédures suivantes sont réalisées dans notre institution et des variations peuvent exister en fonction des recommandations de la biosécurité de l'établissement du Comité. Personnel communs équipement de protection se compose d'une combinaison Tyvek, bonnet bouffant, chaussons, respirateur N95, lunettes de protection, manches, et d'une double paire de gants en nitrile. Le travail impliquant M. cultures de tuberculose et / ou des manipulations avec M. ouverte tuberculose conteneurs est effectué dans le type A2 ou B2 enceinte de sécurité biologique. Plastique recouverte de papier absorbant est placé sur le poidsravailler surface. Tous les matériaux / fournitures devant être éliminés ou retiré de l'installation doivent être placés dans deux sacs biohazard et décontaminés par autoclavage. Les surfaces de travail et des équipements utilisés dans l'armoire (FastPrep-24 de lyse, homogénéisateur spectrophotomètre, un seau avec de la glace, etc) doivent être désinfectés après chaque séance de travail avec Amphyl 1% (tuberculocide, agent bactéricide, fongicide, virucide et). M. cultures de tuberculose doit être placée sous double confinement pour le transport de gros équipements situés à l'extérieur de l'enceinte de sécurité biologique tels que les congélateurs, incubateurs, centrifugeuses et un réfrigérateur. La centrifugation est réalisée avec des tasses de sécurité qui accompagnent et tubes à vis des joints toriques haut. Pour une analyse plus poussée en dehors du laboratoire BSL3, des extraits acellulaires sont filtrés à travers un filtre de 0,2 um ou de chaleur micro-organismes tués à 95 ° C pendant 15 min. 2 Les échantillons sont plaqués pour vérifier l'absence d'unités formant des colonies avant leur évacuation de confinement.
- Transfert 110 ml de milieu complet Middlebrook 7H9 contenant du polysorbate 80 (Tween 80 pour empêcher l'agglutination) de bouillon (CCAM-TW) ou un fluide approprié dans une fiole Erlenmeyer de 250 ml. Cultures en triple sont couramment cultivés par l'état lors de l'utilisation 13 C-métabolites, et dix cultures identiques sont cultivés pour le profilage 1D 1 H RMN. Pendant deux conditions (par exemple, avec ou sans addition de médicament), le volume double de la culture par répétition peut être cultivé et divisé en deux cultures identiques. Toutes les recettes de réactifs et de la solution sont prévus à la fin du protocole.
- Inoculer un bouillon avec 0,150 ml de M. stock de glycérol tuberculose de 50% (laisser décongeler sur la glace). Voir la note 1 ci-dessous.
- Laissez croître la culture à 37 ° C sous agitation à 100 rpm pendant environ 6 jours (DO 600 0,6-0,8). Voir la note 2 ci-dessous.
- Si aucun des antibiotiques, des ajouts ou traitements alternatifs autres sont nécessaires, les cultures sont prêtes à être récoltées. Si les traitements sont utilisés, continuerdirectement à l'étape 5. Suppression d'un échantillon de 0,5 ml dans chaque flacon, transférer dans un microtube et à 4 ° C pour le titrage de la culture et de contrôle de qualité: tests de contamination, l'analyse phénotypique, les tests PCR. Voir la note 3 ci-dessous. À ce stade, passez à l'étape 6.
- Retirer flacons de shaker et effectuer le traitement souhaité (par exemple, ajouter médicament ou ses métabolites). Lieu flacons de retour dans le shaker et incuber pendant une période supplémentaire (par exemple, 6-18 h). A la fin de ce temps, prendre une autre portion de 1,0 ml et déterminer OD 600. Suppression d'un échantillon de 0,5 ml dans chaque flacon, transférer dans un microtube et à 4 ° C pour le titrage de la culture et du contrôle qualité.
- Placer les cultures sur de la glace pendant 5 min. Après cette étape, laissez les cellules sur la glace tout au long de l'ensemble du protocole restant. Récolte des cultures par centrifugation à 2000 xg et à 4 ° C pendant 15 min dans des tubes de 50 ml en utilisant une centrifugeuse de paillasse. Chaque culture a besoin de quatre tubes de 25 ml chacun (un total de 100 ml est nécessaire pour obtenir suffisamment de signal-à-bruit pour 2D 1 H-13 C expériences de RMN, où seulement 50 ml par culture est nécessaire pour des expériences de RMN 1D 1 H).
- Laver chaque culot cellulaire deux fois avec de l'glacée O ddH 2 (environ 15 ml de la première et de 10 ml pour la deuxième fois) par les paramètres de centrifugation décrit ci-dessus. Pour le second lavage, mélanger les aliquotes de 10 ml dans le même tube avant le filage. Remettre en suspension le culot cellulaire dans un volume final de 1,0 ml ddH O 2 (réglage nécessaire pour culot cellulaire volume). Si une suspension cellulaire unique exempt de grumeaux est souhaité à ce stade, les cellules peuvent être brièvement soniquée et / ou passé à travers une aiguille de calibre 27 à trois reprises. Alternativement, le culot cellulaire peut être congelé à -80 ° C et stockés jusqu'à leur traitement ultérieur. Dans ce dernier cas, les granulés congelés sont décongelés sur de la glace avant remise en suspension. Remettre en suspension les culots de cellules dans un volume final de 1,0 ml ddH O 2 comme indiqué ci-dessus.
- Transfer la suspension 1,0 ml de cellules dans un tube de 2,0 ml bouchon à vis contenant lyse matrice B (0,1 mm sphères de silice). Placez l'homogénéisateur FastPrep-24 lyse à l'intérieur du poste de sécurité microbiologique. Mettre les échantillons dans le porte-échantillon, fixer la plaque de retenue a parlé au-dessus du tube. Traiter les échantillons pendant 60 secondes dans l'homogénéisateur à une vitesse de 6 m / s.
- Faites tourner les échantillons dans une microcentrifugeuse à 15.000 xg et à 4 ° C pendant 10 min pour les débris culot de cellules et des cellules intactes.
- Retirer l'échantillon surnageant et passe à travers un filtre seringue (0,2 um) dans un tube stérile. Plaque 0,1 ml d'échantillon (ou une partie représentative de l'échantillon, comme par exemple 10%) sur gélose CCAM afin de vérifier qu'il n'y a pas de cellules viables. Les chercheurs peuvent aussi effectuer plus d'une étape de filtration et / ou de vérifier la présence de cellules viables dans les extraits à l'aide de procédés de coloration live-morts afin de prévenir ou d'identifier des problèmes potentiels en matière de biosécurité. Congeler les échantillons dans un bain de glace sèche-éthanol pour stockerà -80 ° C jusqu'à ce qu'ils soient prêts à être lyophilisées et traitées dans une installation de RMN.
- Après 2 mois, vérifiez plaques de vérifier l'absence d'unités formant des colonies. Si l'UFC ne se trouvent, les échantillons peuvent être pris hors du laboratoire BSL3. Une analyse plus approfondie est mise en oeuvre dans une installation de type RMN, qui sert normalement multi-utilisateurs et fonctionne sous aucune condition de confinement spécifiques.
- Lyophiliser les échantillons à sec, puis remettre en suspension dans 0,7 ml de tampon RMN et transférer dans un tube à centrifuger. Centrifuger 3 min à 13000 x g. Retirer 0,6 ml et transférer dans un tube RMN de 5 mm. Les échantillons lyophilisés peuvent être envoyés à une installation externe non un danger biologique des prélèvements réguliers.
- Données RMN est perçue immédiatement. Malgré toutes les précautions, les enzymes actives peuvent encore être présents et l'échantillon n'est généralement pas stables pendant de longues périodes de temps. Changements dans le spectre de RMN sont perceptibles lorsque les échantillons sont laissés à température ambiante ou à 4 ° C pendant mlus de 1 semaine. En outre, la collecte des données RMN est alterné entre traités et non traités, la drogue cultures où les échantillons sont choisis au hasard dans chaque catégorie. Cela permet d'éviter un biais, car une catégorie particulière eu un délai plus long avant les spectres RMN ont été recueillies. Un biais dans les données qui se produirait si les spectres RMN pour tous les échantillons non traités ont été collectées en premier, puis suivi par les échantillons de drogues traités. Si les échantillons ne peuvent pas être immédiatement analysé par RMN, les échantillons doivent être conservés dans 1 ml tubes Eppendorf à -80 ° C.
- Après avoir inséré les échantillons dans un étalonnage changeur BACS-120 de l'échantillon, qui consiste à deux pas de routine peu comme le verrouillage, la cale air, et l'optimisation de la longueur 90 ° impulsion, est nécessaire pour maximiser la qualité des résultats. Un seul échantillon est utilisé pour calibrer la longueur 90 d'impulsion ° et accorder l'instrument pour les autres échantillons. Verrouillage, calage, et la RMN collecte de données pour chaque échantillon est automatisé using ICONNMR et gradshim.
- Un 1D spectre RMN 1 H sont recueillis au moyen du Bruker zgesgp séquence d'impulsions avec suppression de l'eau en utilisant la sculpture d'excitation. Un total de points de données 32k avec une largeur de balayage de 5482.5Hz, 128 analyses, et 16 analyses fictives sont utilisées. Un 2D 1 H-13 C HSQC spectre est recueillie à l'aide de la séquence d'impulsions Bruker hsqcetgp. Un total de 2048 points de données avec une largeur de balayage de 5000,0 Hz sont collectées directement le long de la dimension 1 H et 64 points de données avec une largeur de balayage de 18864,9 Hz le long de la dimension indirecte 13 C. Le spectre est collecté avec 128 scans et 16 scans fictives pour obtenir un bon signal à bruit.
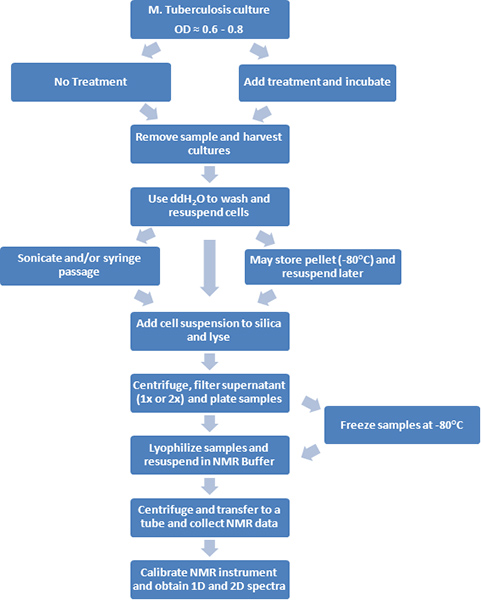
Figure 1. Schéma de principe des procédures expérimentales est représenté.
RMN tampon
Solution mère de 50 mM de phosphate de potassium buffer avec 50 uM TMSP:
- 2,17 g de K 2 HPO 4 (phosphate de potassium dibasique)
- 1,70 g KH 2 PO 4 (phosphate de potassium monobasique)
- 7,86 mg Sodium-3-triméthylsilylpropionate (TMSP-2 ,2,3,3-D 4 (D, 98%))
- Dissoudre dans 500 ml de "100%" D 2 O
- La solution finale doit être à un pH 7,2 (non corrigé)
CCAM-TW ou MOADC-TW (1 L)
- 4,7 g bouillon Middlebrook 7H9 base de
- 900 ml ddH 2 O
- 2 ml de glycérol
- Mélanger les composants et les autoclaves pour 25 min. Liquide froid au toucher et ajouter les solutions suivantes:
- 100 ml ADC lors de la préparation CCAM ou 100 ml OADC lors de la préparation MOADC
- 2,5 ml de 20% de Tween 80 (alternativement, 1 ml de non-métabolisable Tyloxapol 20%)
- 10 ml de cycloheximide 1%
ADC (1 L)
- 20 g de D (+)-glucose
- 50 g de BSA FractionV
- 8,5 g de NaCl
- 800 ml ddH 2 O
- Dissoudre ensemble, ajuster le volume à 1 L et stériliser à 0,2 um filtre. Stocker à 4 ° C.
Sinon, pour préparer OADC (1L), ajouter tous les éléments énumérés ci-dessus, plus 50 ml d'acide oléique 1% (recette ci-dessous fait un lot de 250 ml). Dissoudre ensemble, ajuster le volume à 1 L et stériliser à 0,2 um filtre. Bouteille doit être enveloppé dans du papier aluminium et conserver à 4 ° C.
- 2,5 g d'acide oléique
- 250 ml de NaOH 0,2 M
- L'acide oléique Thaw (se solidifie au froid) par chauffage à 55 ° C pendant 10 minutes et ajouter à la solution de NaOH et de la chaleur sous agitation pendant 60 min. Conserver dans des bouteilles en verre stériles qui sont enveloppés dans du papier aluminium. Seal bouteilles avec du parafilm et conserver à 4 ° C.
Si vous préférez, vous pouvez acheter des BD BBL Middlebrook commerciale ADC ou OADC avec enrichissement catalase.
Le cycloheximide 1% (100 ml)
- 1 g cycloheximide
- 100 ml ddH 2 O
Dissoudre et stériliser avec filtre de 0,2 um. Stocker à 4 ° C. Attention: cycloheximide est toxique si manipuler avec un soin extrême.
20% (v / v) de Tween 80 (100 ml)
- 20 ml de Tween 80
- 80 ml ddH 2 O
Alternativement, peser 20 g de Tween 80 (environ 18,9 ml; densité 1,06 g / ml), pour préparer 20% p / v de solution. Solution de chaleur à 55 ° C pendant 30 min pour dissoudre et mélanger complètement. Stériliser liquide avec un filtre de 0,2 um. Conserver la solution finale à la température ambiante.
20% (v / v) Tyloxapol (100ml)
- 20 ml Tyloxapol
- 80 ml ddH 2 O
Alternativement, peser 20 g de Tyloxapol (environ 18,2 ml; densité de 1,1 g / ml), pour préparer 20% p / v de solution. Solution de chaleur à 55 ° C pendant 30 min à dissolve, et bien mélanger. Stériliser liquide avec un filtre de 0,2 um. Conserver la solution finale à la température ambiante.
Note 1: Les stocks de glycérol de M. la tuberculose sont préparés selon le protocole suivant.
Stockage de M. tuberculose
- M. croître tuberculosis dans 50 ml de saturation CCAM (DO 600 = 1,5 à 2,0) à 37 ° C dans des conditions agitation (100 rpm). Selon la souche, cela prendra 7-14 jours.
- Spin échantillons à 2000 xg à 4 ° C pendant 15 min à la culture granulés. Retirer le surnageant.
- Remettre en suspension dans 6 ml de glycérol 50% stérile.
- Aliquote de 1,5 ml dans 4 flacons cryogéniques Corning et l'étiquette appropriée.
- Immédiatement flacons de gel flash dans un mélange éthanol / bain de glace sèche et les conserver à -80 ° C.
Note 2: souche H37Rv inoculation (-80 ° C de stock jusqu'à 1,5 ans) dans 70 ml d'CCAM médias donne une DO 600 </ Sub> d'environ 0,6 après 5 jours de croissance à 37 ° C dans des conditions agitation (100 rpm) dans un shaker Innova 40.
Note 3: Pour tester la contamination de la culture, les enquêteurs pourraient ensemencer une partie aliquote de la culture sur milieu riche standard et vérifier l'absence de croissance, après une nuit d'incubation. Régulièrement, les cultures sont étalées sur gélose CCAM pour observer la morphologie des colonies et examiner par microscopie à contraste de phase. Si vous le souhaitez, les cultures peuvent être vérifiées par PCR en utilisant les amorces IS 6110 tel que décrit 3.
2. Les résultats représentatifs
Un échantillon qui est bien préparée permettra d'obtenir un spectre RMN similaire à celle représentée à la figure 2. Ce spectre est une représentation de la M. la tuberculose piscine sauvage de type métabolique. Les métabolites identifiés sont directement ou indirectement associés à la filière D-alanine. Également, l'amplitude de l'intensité des pics est proportionnelle à la concentration des métabolites présentsdans l'extrait cellulaire. Donc des changements dans les intensités des pics entre les cultures non traitées, traitement de la toxicomanie et des souches mutantes peuvent indiquer des perturbations de métabolites et des voies métaboliques. L'M. la tuberculose 1D 1 H RMN ont été recueillies sur un spectromètre Bruker Avance 500 MHz équipé d'un triple résonance, cryosonde gradient Z-axe. Le spectre contient env. 400 sommets, à partir de laquelle il a été possible d'identifier et de quantifier les métabolites 40-50, y compris les acides aminés, précurseurs nucléotidiques et d'acides intermédiaires glycolytiques et citrique. Un changeur BACS-120 échantillons avec Bruker Icône logiciel a été utilisé pour automatiser la collecte des données RMN. 1D 1 H RMN ont été recueillies en utilisant 4 sculpter excitation d'éliminer efficacement le solvant et maintenir une ligne de base plate, éliminant ainsi la nécessité pour la collecte de base qui peut induire des artefacts dans l'analyse subséquente composante principale (ACP) ou orthogonale au moins partielle analyse discriminante carrés (OPLS- DA). A 1D Spectre RMN 1 H est recueilli à 25 ° C avec une largeur spectrale de 5482,5 Hz et 32K points de données. Un total de 16 analyses fictives et 128 analyses ont été utilisés pour obtenir le spectre. L'ACD 1D Labs processeur logiciel RMN a été utilisée pour semi-traiter automatiquement tous les 1D 1 H RMN. Les spectres ont transformée de Fourier, par étapes, et référencé à la pointe TMSP (0,0 ppm). Le logiciel a été utilisé NMRpipe pour traiter individuellement le 2D 1 H-13 C RMN et analysées avec NMRDraw. La FID Bruker fichier de données a été converti en un format de fichier reconnaissable par NMRpipe puis le spectre a été transformée de Fourier, phase corrigée, et remplis de zéros. Les pics de RMN observés dans le spectre 1D 1 H RMN 2D 1 et H-13 C Spectre de RMN sont affectés à l'aide de métabolites spécifiques 1 H et 13 C tolérances de déplacement chimique de 0,05 et 0,50 ppm, respectivement, et la base de données de Madison Métabolomique Consortium (MMCD ), 5, la BioMagResBank, 6 et la base de données du métabolome humain. 7 En particulier, les spectres RMN 1D et 2D sont cueillies manuellement pic, où la liste pic des déplacements chimiques de RMN sont ensuite téléchargées vers la base de données du métabolome humain. Les métabolites identifiés par la base de données du métabolome humain sont affectés au spectre RMN basée à la fois sur la maximisation du nombre de résonances RMN correspondant et appartenant à un réseau métabolique. Chaque composé ou un métabolite a généralement plusieurs paires CH et des résonances RMN en conséquence multiples. Ainsi, plus de ces résonances RMN qui sont observées dans le spectre RMN expérimentale, plus le métabolite est présent. De même, l'identification des métabolites multiples associés à la même voie augmente la probabilité de corriger des devoirs. La présence de métabolites et des voies métaboliques sont vérifiées avec l'Encyclopédie de Kyoto des gènes et génomes (KEGG) 8 et les bases de données MetaCyc 9. Mycobacterium smegmATIS est un système modèle utile pour M. la tuberculose et d'autres pathogènes de mycobactéries. Comme il est décrit ailleurs, des échantillons de M. smegmatis pourrait également être perturbé par sonication 10.
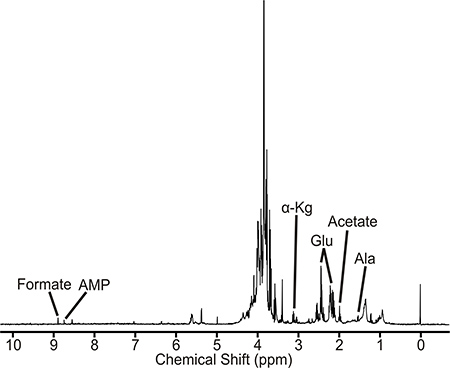
Figure 2. 1D spectre RMN 1 H de l'extrait de Mycobacterium tuberculosis cellule. RMN pics associés à des métabolites représentatifs sont marqués. Les abréviations sont les suivantes: AMP, adénosine monophosphate, α-kg, α-cétoglutarate, Glu, glutamate, et Ala, alanine.
Discussion
Un nombre important d'études ont analysé les profils transcriptomiques et protéomiques de M. la tuberculose sous une variété de tests in vitro et in vivo. 11-16 En fin de compte, les changements dans l'expression des gènes et l'activité enzymatique conduire à des variations dans les concentrations de petites molécules de poids moléculaire. La description complète de ces composés constitue le métabolome. Ainsi, les effets des drogues et des condition...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier tous les membres des laboratoires du Dr Barletta et le Dr Powers pour leurs commentaires utiles tout en développant le protocole. Nous tenons à remercier Wendy Austin pour des discussions utiles et relecture du manuscrit. Les travaux décrits dans ce manuscrit a été financée par des subventions pilotes de semences à chaque enquêteur énumérés ci-dessus, de l'Université de Nebraska-Lincoln Center Biologie Redox (parent subvention no 017675 NCRR 2P20RR, D. Becker, PI). En outre, nous tenons à remercier le Dr Ofelia Chacon pour fournir des fonds de son subvention R21 (1R21AI087561-01A1) pour les fournitures de recherche et de soutien M. Halouska de salaire partiel de standardiser les techniques de RMN inclus dans cette publication.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / Equipement | Entreprise | Numéro de catalogue | Commentaires |
| L'enrichissement ADC | BD BBL Middlebrook | 212352 | |
| BACS-120 Passeur d'échantillons | Bruker | ||
| RMN Bruker Avance | Bruker | 500 MHz | |
| Sérum Albumine Bovine | Fisher Scientific | BP1600-100 | Fraction V |
| Centrifuger | Beckman Coulter | Allegra X-15R | Benchtop |
| Tubes à centrifuger | Corning | 430291 | 50 ml stérile en polypropylène |
| Les flacons cryogéniques | Corning | 430488 | 2,0 ml en polypropylène stérile |
| Cycloheximide | AG scientifique | C-1189 | Toxique |
| D (+) - Glucose | ACROS | 41095-0010 | |
| Oxyde de deutérium | Sigma Aldrich | 617385 | |
| Erlenmeyer | VWR | 89095-266 | Stérile, fond plat, polycarbonate, 0,22 capuchon membrane en PTFE um ventilé |
| Flacon Gel flash | VWR | 82018-226 | 750 ml |
| Lyophilisateur | VWR | 82019-038 | 4,5 L de table |
| Glycérol | GibcoBRL | 15514-029 | |
| Incubateur | Nouveau-Brunswick | Innova 40 | De table shaker |
| Lyse matrice B | MP Biomédical | 6911-100 | |
| Machine de lyse | MP Biomédical | FaastPrep-24 | |
| Microcentrifugeuse | Eppendorf | 5415D | Benchtop |
| Microcentrifugeuse | Beckman Coulter | Microfuge 22R | Benchtop |
| Middlebrook 7H9 Broth | Difco | 271310 | |
| RMN tubes | Norell | ST500-7 | 5 mM |
| Enrichissement OADC | BD BBL Middlebrook | 212351 | |
| Acide oléique | Sigma | O1008 | |
| Phosphate de potassium dibasique | VWR | BDH0266 | |
| Phosphate de potassium monobasique | VWR | BDH0268 | |
| Rotor - Microfuge 22R | Beckman Coulter | F241.5P | Scellé et polypropylène |
| Rotor - Allegra X-15R | Beckman Coulter | SX4750 | Avec la bio-certifiés couvertures |
| Chlorure de sodium | Fisher Scientific | S271-3 | |
| Sodium-3-triméthylsilylpropionate-2 ,2,3,3-D4 | Cambridge Isotope | DLM-48 | |
| Spectrophotomètre | Beckman Coulter | DU-530 | |
| Cuves de spectrophotomètre | Corde de sécurité | LS-2410 | 1,5 ml en polystyrène, 2 faces claires |
| Seringue | Becton Dickinson | 309585 | Stérile, 3 ml Luer-Lok |
| Filtre seringue | Nalgene | 190-2520 | Acétate 0,2 um de cellulose stérile |
| Tween 80 | Fisher Scientific | BP338-500 |
Références
- Larsen, M. H., Biermann, K., Tandberg, S., Hsu, T., Jacobs, W. R. Genetic Manipulation of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 2 (2007).
- Larsen, M. H., Biermann, K., Jacobs, W. R. Laboratory Maintenance of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 1 (2007).
- Clarridge, J. E., Shawar, R. M., Shinnick, T. M., Plikaytis, B. B. Large-scale use of polymerase chain reaction for detection of Mycobacterium tuberculosis in a routine mycobacteriology laboratory. J. Clin. Microbiol. 31, 2049-2056 (1993).
- Nguyen, B. D., Meng, X., Donovan, K. J., Shaka, A. J. SOGGY: solvent-optimized double gradient spectroscopy for water suppression. A comparison with some existing techniques. J. Magn. Reson. 184, 263-274 (2007).
- Cui, Q. Metabolite identification via the Madison Metabolomics Consortium Database. Nat. Biotechnol. 26, 162-164 (2008).
- Ulrich, E. L. BioMagResBank. Nucleic Acids Res. 36, 402-408 (2008).
- Wishart, D. S. HMDB: the Human Metabolome Database. Nucleic Acids Res. 35, 521-526 (2007).
- Kanehisa, M. KEGG for linking genomes to life and the environment. Nucleic Acids Res. 36, 480-484 (2008).
- Karp, P. D. Expansion of the BioCyc collection of pathway/genome databases to 160 genomes. Nucleic Acids Res. 33, 6083-6089 (2005).
- Halouska, S. Use of NMR metabolomics to analyze the targets of D-cycloserine in mycobacteria: role of D-alanine racemase. J. Proteome. Res. 6, 4608-4614 (2007).
- Boshoff, H. I. The transcriptional responses of Mycobacterium tuberculosis to inhibitors of metabolism: novel insights into drug mechanisms of action. J. Biol. Chem. 279, 40174-40184 (2004).
- Mehaffy, C. Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis. Proteomics. 10, 1966-1984 (2010).
- Schnappinger, D. Transcriptional Adaptation of Mycobacterium tuberculosis within Macrophages: Insights into the Phagosomal Environment. J. Exp. Med. 198, 693-704 (2003).
- Schnappinger, D., Schoolnik, G. K., Ehrt, S. Expression profiling of host pathogen interactions: how Mycobacterium tuberculosis and the macrophage adapt to one another. Microbes. Infect. 8, 1132-1140 (2006).
- Shui, W. Quantitative proteomic profiling of host-pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids. J. Proteome. Res. 8, 282-289 (2009).
- Talaat, A. M., Lyons, R., Howard, S. T., Johnston, S. A. The temporal expression profile of Mycobacterium tuberculosis infection in mice. Proc. Natl. Acad. Sci. U.S.A. 101, 4602-4607 (2004).
- Forgue, P. NMR metabolic profiling of Aspergillus nidulans to monitor drug and protein activity. J. Proteome Res. 5, 1916-1923 (2006).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22, 245-252 (2004).
- Shin, J. H. NMR-based Metabolomic Profiling in Mice Infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238-2247 (2011).
- Jaki, B. U., Franzblau, S. G., Cho, S. H., Pauli, G. F. Development of an extraction method for mycobacterial metabolome analysis. J. Pharm. Biomed. Anal. 41, 196-200 (2006).
- de Carvalho, L. P. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17, 1122-1131 (2010).
- de Carvalho, L. P. Activity-based metabolomic profiling of enzymatic function: identification of Rv1248c as a mycobacterial 2-hydroxy-3-oxoadipate synthase. Chem. Biol. 17, 323-332 (2010).
- Marrero, J., Rhee, K. Y., Schnappinger, D., Pethe, K., Ehrt, S. Gluconeogenic carbon flow of tricarboxylic acid cycle intermediates is critical for Mycobacterium tuberculosis to establish and maintain infection. Proc. Natl. Acad. Sci. U.S.A. 107, 9819-9824 (2010).
- Tang, Y. J. Central metabolism in Mycobacterium smegmatis during the transition from O2-rich to O2-poor conditions as studied by isotopomer-assisted metabolite analysis. Biotechnol. Lett. 31, 1233-1240 (2009).
- Kweon, O. A polyomic approach to elucidate the fluoranthene-degradative pathway in Mycobacterium vanbaalenii PYR-1. J. Bacteriol. 189, 4635-4647 (2007).
- Hasan, M. R., Rahman, M., Jaques, S., Purwantini, E., Daniels, L. Glucose 6-phosphate accumulation in mycobacteria: implications for a novel F420-dependent anti-oxidant defense system. J. Biol. Chem. 285, 19135-19144 (2010).
- Soga, T. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J. Proteome Res. 2, 488-494 (2003).
- Metz, T. O. The future of liquid chromatography-mass spectrometry (LC-MS) in metabolic profiling and metabolomic studies for biomarker discovery. Biomark Med. 1, 159-185 (2007).
- Ludwig, C., Viant, M. R. Two-dimensional J-resolved NMR spectroscopy: review of a key methodology in the metabolomics toolbox. Phytochem. Anal. 21, 22-32 (2010).
- Simpson, R. J., Inglis, J. . Proteins and Proteomics: A Laboratory Manual. , 425-595 (2003).
- Beste, D. J., McFadden, J. System-level strategies for studying the metabolism of Mycobacterium tuberculosis. Mol. Biosyst. 6, 2363-2372 (2010).
- Rhee, K. Y. Central carbon metabolism in Mycobacterium tuberculosis: an unexpected frontier. Trends Microbiol. , (2011).
- Who. Health Organization. Anti-tuberculosis Drug Resistance in the World: Report No. 4. , (2008).
- Jassal, M., Bishai, W. R. Extensively drug-resistant tuberculosis. Lancet Infect Dis. 9, 19-30 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon