Method Article
Préparation individuelle Drosophila Œuf Chambres pour l'imagerie en direct
Dans cet article
Résumé
La Drosophila Oeuf chambre est un excellent modèle pour étudier les mécanismes de localisation des ARNm. Afin de capturer les événements dynamiques qui sous-tendent les processus de localisation, rapide imagerie à haute résolution des tissus vivants est nécessaire. Ici, nous présentons un protocole pour la dissection et l'imagerie d'échantillons vivants avec une perturbation minimale.
Résumé
Imagerie des cellules vivantes est une technique importante appliquée à un certain nombre de tissus de Drosophila utilisées comme modèles pour étudier des sujets tels que la spécification axe, la différenciation cellulaire et de l'organogenèse 1. Une bonne préparation des échantillons expérimentaux est un élément crucial, souvent négligé, étape. Le but de la préparation est de s'assurer de la pertinence physiologique et à créer les conditions optimales d'imagerie. Afin de maintenir la viabilité des tissus, il est essentiel pour éviter la déshydratation, l'hypoxie, la détérioration de surchauffe ou de milieu 2.
La chambre de Drosophila oeuf est un système bien établi pour examiner les questions relatives, mais sans s'y limiter, à la modélisation du corps, la localisation des ARNm et organisation du cytosquelette 3,4. Pour les chambres d'oeufs au début et à mi-étape, le montage dans de l'huile d'halocarbure est bon pour la survie en ce qu'il permet la libre diffusion de l'oxygène, prévient la déshydratation et de l'hypoxie et possède de superbes propriétés optiques pour la microscopie. Imle vieillissement des protéines fluorescentes est possible grâce à l'introduction de transgènes dans la chambre de l'œuf ou l'injection physique de l'ARN marqués, protéine ou des anticorps 5-7. Par exemple, plus de constructions à l'MS2 génome d'animaux permet l'observation en temps réel d'ARNm dans l'ovocyte 8. Ces constructions permettent le marquage in vivo d'ARNm grâce à l'utilisation de l'interaction bactériophage MS2 ARN tige-boucle avec son protéine d'enveloppe 9.
Ici, nous présentons un protocole pour l'extraction des ovaires ainsi que l'isolement ovarioles individuelles et des chambres d'œufs de la femelle chez la drosophile. Pour une description détaillée de la drosophile ovogenèse voir Allan Spradling C. (1993, réédité 2009) 10.
Protocole
1. La préparation avant la drosophile pour la dissection (Selon E. Gavis, l'Université de Princeton)
- Jeter les adultes à partir d'une bouteille à faible densité de ensemencées et de transférer la bouteille à 25 ° C à l'avance de votre expérience. Une fois que les nouveaux adultes ont commencé à émerger, attendez deux jours.
- Prendre un flacon contenant environ 10 ml à la mouche de la nourriture solide et ajouter 0,5-0,7 grammes de levure sèche (voir tableau) sur un angle de 45 degrés. Ne pas couvrir toute la surface de la nourriture volée avec de la levure.
- Ajouter quelques gouttes d'eau à la levure, suffisante pour hydrater (figure 1A). Placer le flacon à 45 degrés et permettent d'environ 3 minutes pour la levure pour absorber l'eau (figure 1B).
Remarque: Vous pouvez pré-mélange une levure coller dans un récipient séparé et ajouter la pâte à la fiole avec une spatule.
- Anesthésier les mouches dans le flacon en injectant du gaz CO 2. Quand ils cessent de bouger, faire pencher les mouches inconscients sur le CO 2 pour le tri (figure 1C).
- Isoler 10-15 femelles et 5 mâles du génotype désiré sous un microscope à dissection avec un pinceau à pointe fine (figure 1D). Mâles sont évidente par la présence de forcipules, une structure en saillie sombre, à leur postérieure.
- Ajouter les mouches sélectionnées pour le flacon pâtes levées (figure 1E). Lieu à 25 ° C pendant 24-60 heures. Incuber pendant des périodes plus courtes pour une plus grande pour cent des jeunes et le milieu chambres oeufs de stade et des périodes de temps plus longues pour la fin chambres oeufs de stade.
2. La dissection des ovaires chez la drosophile
- Placer une petite goutte d'huile sur un halocarbure n ° 1,5, 22 x 50 mm lamelle (figure 2A). Réglez la lamelle préparée du côté où il ne sera pas de la manière.
- Anesthésier les mouches dans la vile pâtes levées par l'injection de CO 2 du gaz et de pointe sur un tampon de CO 2.
- Utilisez tranchants bien-nez pince à saisir un individu engraissés femme à la partie antérieure de l'abdomen (et non entre el'abdomen et du thorax e) (Figure 2B-C).
- Maintenez la femelle avec les forceps et voir sous un microscope à dissection, environ 2-3 cm au-dessus de la lamelle préparée.
- Tout en maintenant à la partie antérieure, utiliser un deuxième ensemble de pince pour enlever le tissu à l'extrême postérieure de la femelle (figure 2D). Remarque: les tissus Gut sera généralement sortir avec l'extrémité postérieure. Essuyez le tissu retiré de la pince.
- Tout en maintenant la femelle à la partie antérieure, utilisez la pince essuyé pour presser doucement ou masser l'abdomen, le travail de la partie antérieure vers la postérieure. Massez le ventre de la même façon que la suppression de la pâte dentifrice de l'extrémité d'un tube.
- Deux grandes structures opaques seront poussés de l'abdomen et le bâton à l'extrémité de la pince (Figure 2E-F). Ce sont les ovaires par paires.
- Touchez les ovaires sur l'huile d'halocarbure sur la diapositive ci-dessous.
- Répétez la dissection 1-2 fois pour donner un total de 4-6 ovaires dans l'huile sur la lamelle (Figure 2G).
3. Ovarioles isolation
Remarque: Chaque ovaire contient environ 16 ovarioles constitués de 6 à 10 chambres d'œufs de différentes étapes disposées comme des perles sur une chaîne de 10.
Remarque: Avant d'isoler les ovarioles, ajuster la source lumineuse sur le microscope à dissection de telle sorte que l'éclairage frappe à un angle faible de l'échantillon. Cela donne la différence de l'échantillon et permet la visualisation des chambres des jeunes d'oeufs sur scène.
- Dans l'huile, séparer les deux ovaires en retirant le tissu conjonctif à l'extrémité postérieure (stades anciens) avec des pinces fermées (figure 3A).
- Orient un ovaire individuel avec les plus anciens stades de la phase de gauche les plus jeunes et vers la droite. Les chambres des jeunes d'oeufs dans l'ovaire stade sont transparents et forment l'extrémité la plus pointue de l'ovaire.
- Avec une paire de pince à la main dominante, saisir doucement la partie postérieure de l'ovaire, de préférence par les restes de etissus conjonctifs e. Tout en maintenant l'ovaire en place avec les pinces, utiliser une sonde de dissection (ou une aiguille de tungstène) de démêler ovarioles individuels (figure 3B-D).
Remarque: ovarioles individuels seront de pause entre les stades jeunes (germarium de mettre en scène 10) que les stades les plus âgés sont trop gros pour être séparé de l'ovaire complète.
Remarque: La perforation d'un ovocyte stade avancé avec la sonde de dissection se traduira dans le cytoplasme des fuites dans l'huile et facilite l'extraction des ovarioles individuels très difficile. Si un ovocyte stade tardif est percé, passer à un ovaire frais.
- Une fois l'ovariole est libre de l'ovaire, utiliser la sonde de dissection à le faire glisser vers le centre de la goutte d'huile et d'orienter dans l'orientation souhaitée pour l'expérience. Remarque: ovarioles dans l'huile sera à s'établir et à adhérer au verre.
- Répétez ce processus (3.3 à 3.4) jusqu'à ce qu'il n'y 15-25 ovarioles individuels. Remarque: Cela peut nécessiter la dissection de la multipareLe ovaires. L'ensemble du processus devrait prendre moins de 15 minutes.
Remarque: Il est conseillé de disséquer un ovaire chaque partir de plusieurs mouches plutôt que disséquer les deux ovaires de moins de mouches à augmenter le nombre n de mouches pour l'expérience.
Remarque: Une manipulation brutale de l'ovariole se traduira dans les ovocytes malsaines et peut conduire à des artefacts dans l'expérience.
Remarque: Les ovocytes va commencer à afficher les modifications phénotypiques dues au stress de 40 minutes après avoir été disséqués à partir de l'ovaire (Figure 7E comparer à F).
- Une fois ovarioles sont dans une orientation adéquate (Figure 3E), utiliser la sonde de dissection et les pinces fermées pour déplacer l'excès de tissu ovarien sur l'huile. Ce matériau peut être rayé de la pince sur une serviette en papier.
4. Isolation individuelles fin chambres oeufs de stade (d'après E. Gavis, l'Université de Princeton)
- Avec une paire de pince dans le dominmain fourmi, saisir la partie postérieure de l'ovaire isolé, de préférence par les restes du tissu conjonctif. Tout en maintenant l'ovaire en place avec les pinces, introduire la sonde de dissection dans l'extrémité postérieure de l'ovaire à proximité de la pince (figure 4A). Éviter de percer les chambres d'oeufs en insérant la sonde entre la fin des chambres d'oeufs sur scène.
- Retirez l'aiguille de dissection par l'ovaire jusqu'à ce qu'il quitte au début des chambres d'oeufs étape (figure 4B). Une fois fait correctement, la sonde va supprimer le tissu conjonctif contenant les ovarioles et la fin des chambres oeufs de stade en place.
- Répétez l'étape 4.2 jusqu'à ce que les ovarioles sont étalées sur la lamelle. Note: Lorsque chambres d'oeuf ne sont plus empilés les uns sur les autres, cette étape est terminée.
- En utilisant la sonde de dissection, séparer les ovocytes fin pour permettre à l'imagerie facile (figure 4C).
Remarque: La perforation d'un ovocyte en disséquant la fin chambres oeufs de stade n'est pas en condamnant comme i dissectionovarioles ertaines pour les jeunes stades.
Remarque: Pour les chambres stade de l'œuf 14, utiliser les forceps pour saisir les appendices dorsaux pour l'orientation.
5. Préparation injectable
Remarque: Pour l'injection d'ovocytes stade intermédiaire, orienter le ovarioles perpendiculairement à l'axe longitudinal de la lamelle.
- Allumez le microscope d'imagerie [dans notre cas un Core DeltaVision de précision appliquée] et charger les paramètres d'imagerie appropriées (Figure 5A-B).
- Allumez l'appareil d'injection (figure 5C).
- Chargez l'aiguille d'injection avec une pointe de chargement (Figure 5D-E). Solutions à injecter doit être centrifugé brièvement à grande vitesse pour éviter les dépôts qui pourraient bloquer l'aiguille d'injection.
- Fixer l'aiguille d'injection chargé à l'injecteur. Prenez soin d'éviter de casser l'aiguille (figure 5F).
- Pour aider avec des aiguilles de décolmatage, placez un petit morceau de verre 2x10 mm à partir d'une coupure ou une lamelle brisée unet un côté de la goutte d'huile contenant des ovarioles. Assurez-vous que ce fragment de verre est recouvert d'huile. Ce verre servira à la RAM de l'extrémité de l'aiguille contre pour casser ou de déboucher l'aiguille.
6. L'injection de l'ARN fluorescent
Avant de commencer: Mettre en place le dispositif d'injection et la micro-manipulateurs de ces contrôles que l'aiguille d'injection est positionné sur le centre du champ de vue.
- Monter l'échantillon à être injecté sur la platine du microscope.
- Sélectionnez l'objectif 20x. Objectifs à fort grossissement plus ou moins élevés peuvent également être utilisés.
Remarque: Si vous utilisez un stade avec une capacité automatisée point de visite, il est conseillé de marquer toutes les étapes 8-9 pour l'injection des ovocytes avant de commencer. Cela permet de visiter facilement et l'injection des ovocytes sélectionnés.
- Abaisser l'aiguille d'injection jusqu'à ce qu'il touche l'huile. Centre de la pointe de l'aiguille au cours de la lentille de l'objectif.
- Tournerhors des lumières de la pièce et tournez sur la lumière-matière pour le microscope. Sélectionnez le premier point (ovocyte) sur la liste marquée points. Tout en regardant dans les oculaires, se concentrer sur l'ovocyte (figure 6A).
- Abaisser l'aiguille manuellement jusqu'à ce qu'il soit dans le même plan de mise au point que l'ovocyte et à côté visible à l'ovocyte.
- Utilisation des commandes de manipulateur, déplacer le point de l'aiguille d'injection jusqu'à ce qu'il soit à l'intérieur de l'ovocyte. Un mouvement rapide coup de poignard est souvent plus efficace qu'une lente progression. Une fois à l'intérieur, éjecter un petit volume de l'aiguille et d'évaluer visuellement les effets, répéter au besoin. Si l'injection est réussie, le cytoplasme à l'intérieur de l'ovocyte sera déplacé, si ce n'est pas apparente, de répétition. Il n'est pas nécessaire à l'image de la fluorescence pour déterminer si le matériel a été injecté. Après l'injection, retirez l'aiguille de l'intérieur de l'ovocyte (figure 6B-G).
- La quantité précise de fluide injecté est difficile de quantifier. Pour augmenter le volume injecté, adjuer la pression ou le temps de l'impulsion d'injection, briser le bout de l'aiguille pour augmenter l'ouverture légèrement ou utiliser des impulsions d'injection répétées.
Note: Le processus d'injection entier devrait prendre moins de 10 secondes quand il est exécuté correctement. Vaste coup de poignard ou s'attarder à l'intérieur de l'aiguille d'ovocytes se traduira par de graves dommages à la chambre de l'œuf.
- Avant de sélectionner l'ovocyte suivante marquée, soulever l'aiguille d'injection suffisamment élevée dans l'huile afin de ne pas communiquer avec d'autres ovocytes dans le trajet de déplacement.
- À l'ovocyte nouvelle, répétez l'étape 6.6. Continuez de cette façon jusqu'à ce que tous les ovocytes nécessaires sont injectés.
Remarque: Si une erreur est commise lors de l'injection, passer à la suivante a été marquée ovocyte. Ne perdez pas de temps sur les ovocytes endommagés.
Remarque: L'aiguille peut être obstrué lors d'une séance d'injection. Dans ce cas, déplacer l'aiguille adjacente à la pièce cassée de verre dans de l'huile sur la lamelle. Esprith, le verre et l'aiguille dans le même plan focal, doucement enfoncent l'aiguille dans le verre (Figure 6H). Vérifiez que l'aiguille est débloquée en appuyant sur le bouton d'injection et de voir si du liquide sort de la pointe de l'aiguille.
- Lorsque toutes les ovocytes ont été injecté, déplacer manuellement l'aiguille, hors de l'huile et l'orienter en dehors du trajet de faisceau pour le microscope. Assurez-vous qu'il est dans une orientation sûre, pour éviter des dommages aux yeux.
Remarque: Si une longue période de temps s'est écoulé entre l'œuf et chambre d'isolement d'injection d'ovocytes, les ovocytes sera difficile à injecter et présentent des modifications phénotypiques liées au stress. Des questions similaires peuvent se produire à la manipulation grossière de l'ovocyte ou l'injection de volumes excédentaires (comparer les figures 6I, J, K).
7. Live conception d'imagerie expérimentale
- Sélectionnez l'ovocyte d'abord injecté dans la liste. Essai que l'injection était à l'intérieur de l'ovocyte par imagerie de fluorescence d'une image dans (as dans la figure 6G).
- Configurer les paramètres expérimentaux, y compris: longueur d'onde d'excitation, voie d'émission, le temps d'excitation, Z-stack et le temps entre les collections. Remarque: Pour plus d'informations à ce sujet, voir R. Parton, et al. (2010) 2.
- Rassembler l'ensemble des données.
8. Les résultats représentatifs
In vitro synthétisé Alexa-546 grk ARN injecté dans un oeuf Me31B :: GFP chambre (figure 7A). L'ARN se localise dans la partie antérieure dorsale de l'ovocyte et forme un bouchon autour du noyau (figure 7B). Pour plus d'exemples de la localisation d'ARN voir MacDougall N., et al. (2003) 11.
Ovocytes stade moyen et tardif exprimant la protéine fluorescente marquée (Tau-GFP, figure 7C) ou des systèmes de marquage d'ARN (GRK * mCherry, figure 7D) peuvent être visualisés sans injection.

Figure 1.

Figure 2.
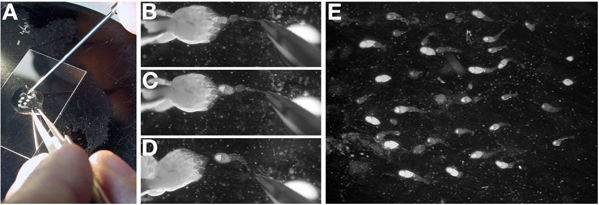
Figure 3.
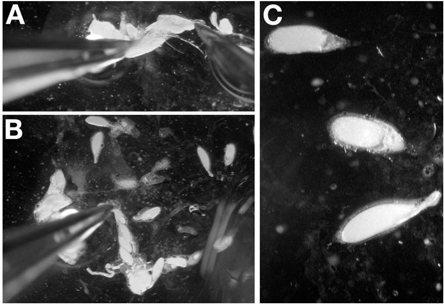
Figure 4.

Figure 5.
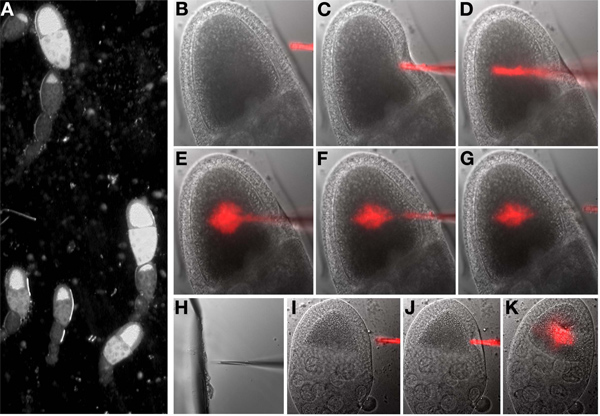
Figure 6.
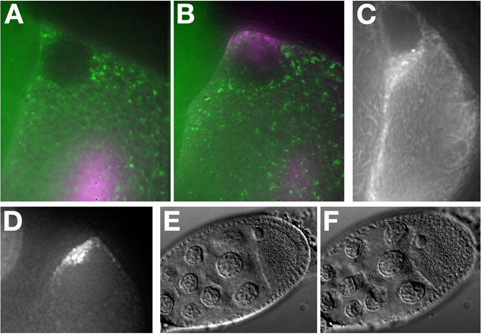
Figure 7.
Discussion
Imagerie des cellules vivantes est un test puissant pour l'examen des processus cellulaires en temps réel. En plus de l'observation simple champ lumineux, l'ajout de marqueurs fluorescents pour les protéines et les ARN d'intérêt a conduit à de nombreuses percées. Ici, nous avons établi un protocole pour les ovocytes d'imagerie de vie individuels qui peuvent être utilisés en combinaison avec des tests génétiques et biochimiques.
Dans ce protocole, nous expliquent également comment manipuler expérimentalement ovocytes de vie par injection. Il existe de nombreuses possibilités pour le matériel à injecter, y compris in vitro synthétisé fluorescentes ARN marqué pour le dosage de la capacité d'une structure secondaire de l'ARN de localisation directe (Ball et Davis, non publié) et des anticorps qui inhibent la fonction des protéines 6. Les travaux futurs seront probablement voir l'introduction d'éléments d'étiquetage et d'autres machinerie cellulaire des ovocytes de vie permettant mécanismes moléculaires à tester.
t "> Préserver la viabilité et la santé du tissu est essentielle lorsque l'on travaille avec des cellules vivantes. Dans ce protocole, nous signalons un certain nombre d'étapes qui peuvent conduire au stress de la chambre de l'œuf. Par exemple, en dépit de l'huile étant supérieure à l'imagerie, culture étendue dans l'huile peut conduire à insister sur la chambre de l'œuf. Ceci peut être facilement surveillés en vertu de l'exposition aux champs lumineux en examinant la morphologie nucléaire et de la position, membrane ovocytaire qui déforment et bulle sous contrainte (Figure 7E comparer (sans contrainte) à Figure7F ( souligné)). Stade 9 chambres d'oeufs montrent la localisation de l'ARN et la migration des cellules frontière 12 sur plusieurs heures. Cependant, une étape 7/8 chambre œuf commencent à présenter des effets néfastes à l'huile de carbone halo après environ 40 minutes de l'ovaire est retiré de la femmes. tardives chambres oeufs de stade, le stade de 11 à 14, peut se développer normalement dans de l'huile ou un milieu aqueux en raison de la sécrétion de la coquille de l'oeuf à partir des cellules folliculaires à ces 13 étapes. Il a été reported que l'ajout de l'insuline à moyen insectes aqueuse peut maintenir scène 9 ovocytes pour un maximum de 6 heures 14 et germaria jusqu'à 14 heures 15. Dans tous les cas, une manoeuvre agressive de la chambre de l'œuf doit être évitée, car elle met l'accent sur les ovocytes et réduit sa viabilité. Imagerie moins chambres d'oeufs et prenant soin de traiter chacun d'eux est doucement la meilleure façon d'assurer une viabilité optimale.Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail a été soutenu par une bourse du Wellcome Trust Senior Research à I. Davis.
matériels
Les outils utilisés dans la dissection doit être propre, mais n'ont pas besoin d'être autoclavés. Essuyez les outils avec de l'EtOH et laissez-les sécher avant de commencer.
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Beaux-pinceau à pointe (Artistes Sable, rond, taille 00 ou 0) | Disponible à partir de fournitures artistiques les plus sorties | Un pinceau de bonne qualité est important | |
| Produits halocarbures Corporation, Série 95 | Produits halocarbures Corporation, 887 Kinderkamack Road, River Edge NJ 07661 | Distributeur européen: Solvadis (GMBH) Assurez-vous d'oxygéner par barbotage d'air dans l'huile. | |
| Couvrir glisser-No. 1,5, 22 x 50mm | International-No1-VWR Cat = 631-0137-22-50mm | Menzel-Glaser-22-40mm-400-070T MNJ | |
| Dumont n ° 5 - Dumostar | Outils belle science | 11253-20 | "Biologie" pointe est également bon, mais plus fragile |
| Dissection de sonde | Outils belle science | 10140-01 | |
| Microscope à dissection | Olympe | SZ61 | |
| CO2 pad | Disponible par le biais http://www.flystuff.com / (Une division de Genesee scientifique) | 59-114 (789 060 Dutscher) | Distributeur européen: Dutscher www. dutscherscientific. com / Il est aussi relativement facile à construire votre propre tampons mouche |
| KIMCARE | Kimbery Clark-KIMCARE médicaux lingettes | KLEW3020 | |
| Microscope-DeltaVision | Applied Precision | DC-CORE | |
| Micromanipulateur | Micromanipulateurs Burleigh de Lumen Dynamics Group inc. 2260 Argentia Road, Mississauga, Ontario, L5N 6H7 Canada | Burleigh PCS-5000 série, le TS-5000-300 | http://www.ldgi-burleigh.com / (Anciennement Exfo) |
| Appareil d'injection | Tritech Research, Inc 2961, avenue des anciens combattants Los Angeles, CA 90064 | Minj-1 | Mise à jour avec un support pour prendre Eppendorf Femptotips |
| Aiguille d'injection | Eppendorf stérile Femtotips I et II | 930000043 | Différents conseils sont meilleurs pour différentes applications |
| Chargement des conseils 20 pi | Eppendorf | 5242956.003 | |
| Levure sèche active | Fleischmann Yeast | # 2192 |
Références
- Arias, A. M. Drosophila melanogaster and the development of biology in the 20th century. Methods Mol. Biol. 420, 1-25 (2008).
- Parton, R. M., Valles, A. -. M., Dobbie, I. D., Davis, I., Goldman, R. D., Swedlow, J. R., Spector, D. L. Pushing the Limits of Live Cell Imaging in Drosophila. Live Cell Imaging: A Laboratory. , 387-418 (2010).
- Johnston, D. Moving messages: the intracellular localization of mRNAs. Nat. Rev. Mol. Cell Biol. 6 (5), 363-375 (2005).
- Jansen, R. mRNA Localization: Message on the Move. Nat. Rev. Mol. Cell Biol. 2, 247-256 (2001).
- Van De Bor, V., Hartswood, E., Jones, C., Finnegan, D., Davis, I. gurken and the I factor retrotransposon RNAs share common localization signals and machinery. Dev. Cell. 9 (1), 51-62 (2005).
- Delanoue, R., Herpers, B., Soetaert, J., Davis, I., Rabouille, C. Drosophila Squid/hnRNP helps Dynein switch from a gurken mRNA transport motor to an ultrastructural static anchor in sponge bodies. Dev. Cell. 13 (4), 523-538 (2007).
- Jaramillo, A. M., Weil, T. T., Goodhouse, J., Gavis, E. R., Schupbach, T. The dynamics of fluorescently labeled endogenous gurken mRNA in Drosophila. J. Cell. Sci. 121 (Pt. 6), 887-894 (2008).
- Forrest, K. M., Gavis, E. R. Live imaging of endogenous mRNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159-1168 (2003).
- Bertrand, E. Localization of ASH1 mRNA particles in living yeast. Mol. Cell. 2 (4), 437-445 (1998).
- Spradling, A. C., Bate, M., Martinez-Arias, A. Developmental genetics of oogenesis. The Development of Drosophila melanogaster. 1, 1-70 (1993).
- MacDougall, N., Clark, A., MacDougall, E., Davis, I. Drosophila gurken (TGFalpha) mRNA localizes as particles that move within the oocyte in two dynein-dependent steps. Dev. Cell. 4 (3), 307-319 (2003).
- Tekotte, H., Tollervey, D., Davis, I. Imaging the migrating border cell cluster in living Drosophila egg chambers. Dev. Dyn. 236 (10), 2818-2824 (2007).
- Weil, T. T., Parton, R., Davis, I., Gavis, E. R. Changes in bicoid mRNA anchoring highlight conserved mechanisms during the oocyte-to-embryo transition. Curr. Biol. 18, 1055-1061 (2008).
- Prasad, M., Jang, A. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nat. Protoc. 2 (10), 2467-2473 (2007).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon